类泛素化neddylation修饰调控乳腺癌中核纤层蛋白lamin B1的表达
贾晓青,孙晓寅,蒋蓓琦,梅章懿,傅 韵,莊志刚
同济大学附属第一妇婴保健院乳腺科,上海 201204
Neddylation修饰是新近发现的一种类泛素化蛋白翻译后修饰方式,类泛素分子神经前体细胞表达发育下调蛋白8(neural precursor cell expressed,developmentally downregulated 8,NEDD8)在NEDD8活化酶1(NEDD8-activating enzyme 1,NAE1)、NEDD8结合酶UBC12和底物特异性NEDD8-E3连接酶的催化下,经过三步级联酶促反应被活化,活化的NEDD8结合到其底物蛋白上并使之通过蛋白酶体降解[1]。Cullin家族作为多亚基Cullin-RING E3连接酶(Cullin-RING ligases,CRL)的必要组成部分,是neddylation最常见的底物[2]。CRL通过靶向数以百计的蛋白,主要是抑癌蛋白并使之通过蛋白酶体降解,从而调控多种生物学过程[3]。CRL的功能异常将会导致肿瘤的发生[4]。研究发现neddylation修饰在多种肿瘤中高度活化,包括肺癌[5]、肝癌[6]、脑胶质瘤[7]和淋巴瘤[8]等。进一步研究发现靶向neddylation修饰可显著抑制肿瘤的生长和转移。本课题组前期研究[9]发现,neddylation修饰在乳腺癌中过度活化,靶向neddylation修饰可增加雌激素受体(estrogen receptor,ER)阳性乳腺癌对氟维司群的敏感性。在研究过程中,我们发现靶向neddylation修饰可诱导乳腺癌MCF-7细胞发生细胞衰老,其具体机制仍不清楚。
核纤层位于核外缘,紧靠核膜,维持细胞核的大小、形状和稳定性[10]。核纤层主要成分是核纤层蛋白,包括A型核纤层蛋白(lamin A)和B型核纤层蛋白(lamin B)[11]。哺乳动物中,lamin A包括lamin A和lamin C,两者是同一基因的两种不同转录产物,有相同的氨基酸序列。Lamin B包括lamin B1和lamin B2[11]。核纤层参与多种细胞核活动,包括DNA复制和转录、染色质结构和重塑、细胞周期进展、细胞发育和分化、细胞核迁移及细胞凋亡[11-14]。此外,核纤层还维持细胞核的结构,调控核孔复合体(nuclear pore complex,NPC)及启动细胞有丝分裂[15]。研究[16]报道,lamin B1缺失诱导细胞衰老,其在细胞衰老过程中发挥了关键作用。我们推测靶向neddylation修饰诱导的细胞衰老与lamin B1有关,Neddylation修饰与lamin B1可能存在相关性,本研究旨在探索neddylation修饰与lamin B1之间是否存在调控关系及可能的机制。
1 材料和方法
1.1 材料
MCF-7细胞系购自美国典型培养物保藏中心(American Type Culture Collection,ATCC),胎牛血清、100 U/mL青霉素、100 U/mL链霉素、RPMI-1640培养基、胰蛋白酶、磷酸盐缓冲生理盐水(phosphate-buffered saline,PBS)均购自美国Gibco公司,LipofectamineTM2000购自美国Invitrogen公司,抗NEDD8抗体购自美国Cell signaling Technology公司,抗NAE1抗体购自德国默克公司,抗lamin B1抗体购自上海泊湾生物科技有限公司,抗P53抗体购自美国Santa Cruz公司,GAPDH抗体和辣根过氧化物酶标记的山羊抗小鼠和山羊抗兔IgG(H+L)二抗购自美国Proteintech公司,免疫组织化学检测试剂盒购自丹麦DAKO公司。
1.2 CRISPR/Cas9技术敲低NEDD8
首先构建NEDD8gRNA 质粒。在网站(http://www.genome-engineering.org/crispr/)上进行NEDD8 gRNA的设计。将针对NEDD8的gRNA序列分别克隆至lenti-guide-puro质粒中。将包含NEDD8 gRNA的lenti-guide-puro质粒(4 μg)与慢病毒包装质粒AGP091(3.0μg)和AGP090(1.2μg)共转染HEK-293T细胞。48 h后收集、过滤病毒上清液,并感染MCF-7/Cas9细胞,用嘌呤霉素(2 μg/mL)筛选1~2周,从而获得NEDD8稳定敲低细胞系。
1.3 细胞培养与转染
采用含10%胎牛血清、100 U/mL青霉素、100 U/mL链霉素的RPMI-1640培养基,将细胞置于37 ℃,CO2体积分数为5%培养箱中培养。待细胞贴壁生长融合度达80%时,加入胰蛋白酶消化并传代。取对数生长期的细胞,接种于6孔板中,待细胞密度达到70%左右。将20 μL P53-RNAi片段及20 μL NC-RNAi片段分别与100 μL不含10%胎牛血清的空RPMI-1640培养基混匀,静置5 min;同时将6 μL LipofectamineTM2000与不含10%胎牛血清的空RPMI-1640培养基混匀,静止5 min;将以上两种复合物混匀,静置20 min,轻轻滴加至细胞中,充分混匀。6~8 h后更换含10%胎牛血清的新鲜培养基。
1.4 蛋白质印迹法(Western blot)检测
在6 cm培养皿中加入100 μL RIPA裂解液,置于冰上,用细胞刮迅速将细胞刮下,移至预冷的1.5 mL Eppendorf试管中,冰上裂解40 min,于4 ℃ 12 000 r/min离心15 min,吸取上清液至新的预冷1.5 mL Eppendorf试管中,利用蛋白定量试剂盒调整蛋白浓度一致。加入5×十二烷基硫酸钠(sodium dodecylsulphate,SDS)上样缓冲液,100 ℃煮沸10 min。冷却至室温后进行SDSPAGE电泳。60 V恒压电泳2 h,220 mA恒流转膜90 min,5%脱脂牛奶室温封闭1 h后,加入一抗(NEDD8、NAE1、lamin B1、P53和GAPDH)4 ℃过夜,次日TBST洗涤10 min×3次后加二抗室温温育1 h,TBST洗涤10 min×3次后,加入ECL发光显影。
1.5 临床标本收集
乳腺癌组织芯片购自上海芯超生物科技有限公司。该组织芯片包含2000年1月—2003年12月接受手术的113例乳腺癌患者,有完整的临床及病理学资料,包括年龄、肿瘤大小、肿瘤分期、组织学分级、淋巴结状态、ER及孕激素受体(progesterone receptor,PR)、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)蛋白表达等。该项研究已经相关伦理委员会通过。
1.6 免疫组织化学法检测
石蜡包埋组织切片常规脱蜡,用含3%过氧化氢的甲醇溶液封闭内源性过氧化物酶。对neddylation修饰过程中关键蛋白NEDD8和NAE1,采用0.01 mol/L柠檬酸溶液(pH=6.0)进行抗原修复,煮沸20 min,取出后置于柠檬酸缓冲液中在室温下自然冷却。对于lamin B1,采用EDTA溶液进行抗原修复,煮沸10 min,取出后置于EDTA溶液中在室温下自然冷却。封闭20 min。依次加入鼠抗人NAE1(1∶100)单克隆抗体、兔抗人NEDD8(1∶80)多克隆抗体和兔抗人lamin B1多克隆抗体(1∶1 000),即用型辣根过氧化物酶标记的二抗室温温育1 h,DAB显色,苏木精对比染色细胞核,常规脱水、透明、中性树胶封固。PBS代谢一抗作为阴性对照,其余步骤同上。用已知阳性切片作为各蛋白的阳性对照。
1.7 染色结果判读
随机选取5个高倍视野(×400),计数肿瘤细胞和阳性细胞数,得出阳性细胞百分率。本课题前期研究[9]报道了NEDD8和NAE1的免疫染色结果。对于lamin B1染色结果的判断,阳性细胞率0%~5%记为0分,6%~25%记为1分,26%~50%记为2分,51%~75%为3分,76%~100%为4分。再按多数阳性细胞呈现的染色强度予以计分,低表达为1分,中等表达为2分,强表达为3分。将上述2项得分相加,0~1分判为“-”,2~3分判为“+”,4分判为“++”,5~7分判为“+++”。由3位有经验的临床病理医师阅片,采用双盲评估的方法,根据其评分的平均值来确定判定结果。本研究进行结果分析时,以“++”和“+++”定义该蛋白为高表达,“-”和“+”定义为低表达。
1.8 统计学处理
应用SPSS 20.0统计学软件进行统计学分析。图表采用GraphPad Prism 8.0软件绘制。相关性分析采用Spearman rank分析。P<0.05为差异有统计学意义。
2 结果
2.1 Neddylation修饰过程关键蛋白NEDD8和NAE1及lamin B1在乳腺癌中的表达
采用免疫组织化学方法分析了neddylation修饰过程关键蛋白NEDD8和NAE1及lamin B1在113例乳腺癌组织标本中的表达情况。结果显示,在NEDD8和NAE1高表达的组织中,lamin B1表达也升高;而在NEDD8和NAE1低表达的组织中,lamin B1表达也降低(图1)。提示二者之间可能存在相关性。
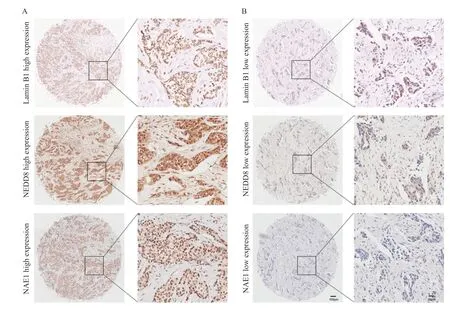
图1 免疫组织化学方法检测NEDD8、NAE1及lamin B1在乳腺癌中的表达Fig.1 The expressions of NEDD8,NAE1 and lamin B1 in breast cancer were detected by immunohistochemistry
2.2 Neddyaltion修饰与lamin B1表达呈正相关
为了明确neddylation修饰与lamin B1表达之间是否存在相关性,我们进一步进行了相关性分析。结果表明,NEDD8(r=0.817,P<0.000 1)和NAE1(r=0.406,P<0.000 1)的表达与lamin B1表达呈显著正相关(图2)。
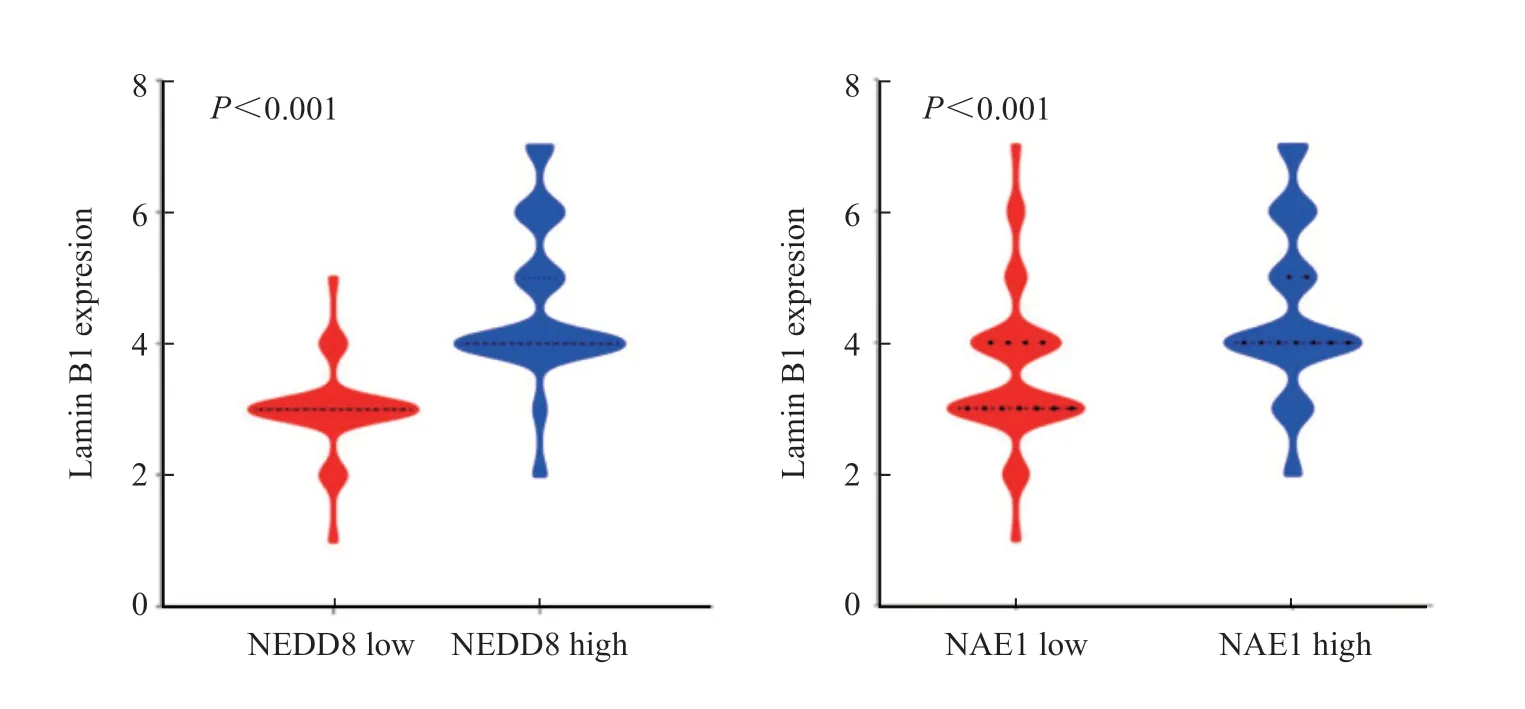
图2 NEDD8和NAE1与lamin B1表达呈正相关Fig.2 The expressions of NEDD8 and NAE1 were positively correlated with lamin B1 expression
2.3 Neddylation修饰调控lamin B1表达
为了明确neddylation修饰是否调控lamin B1表达,我们利用CRISPR/Cas9技术敲低了乳腺癌MCF-7细胞中NEDD8表达(以下称MCF-7/gNEDD8细胞)以阻断neddylation修饰。通过Western blot方法检测NEDD8敲低情况及其对lamin B1表达的影响。结果显示,NEDD8成功被敲低(图3A),敲低NEDD8显著抑制了lamin B1的表达(图3B)。
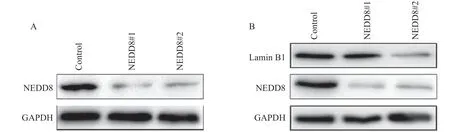
图3 Neddylation修饰调控lamin B1的表达Fig.3 Neddylation modification regulates lamin B1 expression
2.4 Neddylation修饰通过P53依赖的方式调控lamin B1表达
我们进一步研究了neddylation修饰如何调控lamin B1的表达。研究报道,细胞衰老标志物P53调控lamin B1表达[17],而P53是neddylation修饰的底物[18]。我们推测neddylation修饰可能通过P53调控lamin B1的表达。首先利用si-P53和si-NC分别转染MCF-7/gNEDD8细胞和MCF-7/con细胞以沉默P53表达,Western blot方法检测P53及lamin B1表达变化。结果显示,敲低NEDD8表达以阻断neddylation修饰后,P53蛋白发生了积聚(图4A)。沉默P53部分逆转了阻断neddylation修饰对lamin B1的抑制(图4B)。以上结果提示,neddylation修饰可能通过P53依赖的方式调控lamin B1表达。
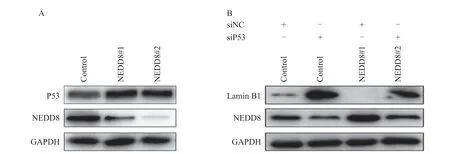
图4 Neddylation修饰通过P53依赖的方式调控lamin B1表达Fig.4 Neddylation modification regulated lamin B1 expression in P53-denendent manner
2.5 Lamin B1高表达在乳腺癌中的预后价值
我们前期研究发现neddylation过度活化患者预后较差[9]。考虑到neddylation修饰对lamin B1的调控作用,lamin B1在乳腺癌中的预后作用显得尤为重要。目前对于lamin B1的预后价值仍有争议。我们利用Kaplan-Meier Plotter在线预后分析网站(https://kmplot.com)进行了分析,结果发现lamin B1高表达与患者较差的无进展生存时间(progression-free survival,PFS)(图5A)和总生存时间(overall survival,OS)(图5B)呈正相关,提示lamin B1高表达患者预后较差。
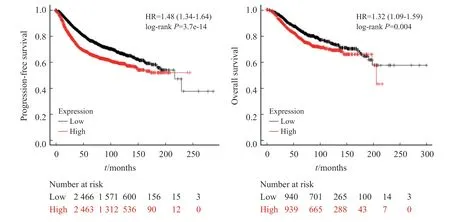
图5 Kaplan-Meier Plotter网站分析Lamin B1表达对PFS和OS的影响Fig.5 The effect of lamin B1 expressions on PFS and OS were analyzed using Kaplan-Meier Plotter dataset
3 讨 论
本研究利用乳腺癌组织芯片免疫组织化学染色,发现neddylation修饰与lamin B1表达呈正相关。进一步发现阻断neddylation修饰可抑制lamin B1表达,沉默P53表达可部分逆转阻断neddylation修饰对lamin B1的抑制。由此我们得出初步结果,neddylation修饰通过P53依赖的方式调控lamin B1的表达。
关于neddylation修饰与lamin B1之间的关系,目前未见研究报道。本研究发现neddylation修饰与lmain B1表达呈显著正相关,弥补了之前研究的空白。本课题组前期研究发现neddylation修饰在乳腺癌中过度活化并提示较差预后[9]。本研究的结果发现,neddylation修饰调控lamin B1表达,lamin B1高表达提示患者较差预后。Neddylation修饰和lamin B1结合传统的预后因子可能为乳腺癌提供更加敏感和精确的预后模型。关于Lamin B1在乳腺癌中的预后预测价值及两者的结合是否能够提供更好的预测模型,尚待进一步的研究。
靶向neddylation修饰可作为一种潜在的肿瘤治疗方法。MLN4924作为一种小分子neddylation抑制剂,已进入Ⅰ/Ⅱ期临床试验阶段,并取得了不错的结果,证明了其较好的安全性和有效性[19]。lamin B1作为核被膜的主要组成成分,维持细胞核的形状和结构[11]。lamin B1表达缺失可诱导细胞衰老,从而抑制肿瘤细胞的生长和增殖[16]。本研究发现阻断neddylation修饰抑制lamin B1表达,据此推测neddylation修饰可能通过lamin B1发挥作用,进一步我们证实neddylation修饰通过P53调控lamin B1表达。lamin B1可能作为乳腺癌的潜在治疗靶点,有待于进一步研究证实,并明确neddylation修饰如何通过P53调控lamin B1表达。
本研究存在一定的局限性。首先,对于lamin B1的检测,以往的研究多采用免疫组织化学法,也有研究者采用实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)的方法进行分析。本研究采用的是免疫组织化学法,存在一定的偏倚。其次,研究的样本量较小,可能会使结果的可信度下降。未来将增加样本量,继续深入研究。
本研究的结果表明,neddylation修饰调控lamin B1表达。基于neddylation修饰及lamin B1也许可以建立更好的乳腺癌预后预测模型,需要进一步的前瞻性研究加以证实。Lamin B1可能作为乳腺癌治疗的潜在靶点。
利益冲突声明:所有作者均声明不存在利益冲突。

