色谱技术在肽分离中的应用
张硕,陈炬龙,唐雨欣,蔡宝国
(上海应用技术大学 香料香精化妆品学部,上海,201418)
伴随食品、医药和生物等科学与工程技术的不断交叉发展,肽的应用范围不断扩大。随之肽的需求呈现快速增长的趋势,这对于肽的分离和纯化工作提出了更高的要求。对肽进行精确且系统的分离是获取优质肽、提高其性能及扩大其应用的重要前提。肽存在结构和性质多样性的特点,肽分离的仪器也随之更新迭代,以适应实际分离需要。色谱分离为肽分离和制备提供了良好的技术支持,常用的色谱技术有:离子交换色谱、分子排阻色谱和反相高效液相色谱。目前,对色谱技术在肽分离中的应用进行综合和系统的评述较少。本文将阐述3种色谱技术的原理及其在肽分离中的应用,为肽分离工作提供合理的理论指导和技术支持,以进一步扩大肽在食品、医疗和化妆品中的应用。
1 肽的简述
肽是一类介于氨基酸和大分子蛋白质之间的线性聚合体。因其具有分子质量低、易于吸收、生物活性高和免疫原性低等特性,逐渐成为食品[1-2]、医药治疗[3-4]、美容[5-6]和化妆品[7-8]领域的重点研究对象。肽的生物活性和功能取决于它们的氨基酸组成、序列和分子质量[9]。人体内的多种自然生理活动都与特定肽的相互作用产生的信号传递和调节有关[10]。一般而言,按照氨基酸的组成和数量的不同,分为2~10个氨基酸的寡肽、10~50个氨基酸的多肽和50个以上氨基酸组成的蛋白质。功能肽的分子质量普遍在300~1 200 Da,以平均每个氨基酸120 Da的分子质量计算,相当于肽数目在3~10个。当肽的分子质量小于10 000 Da,易于渗透组织,被人体吸收的效果较好[11]。与此同时,在市场销售的化妆品用肽原料同样也是普遍在十肽及以下,如六肽-1、五肽-3和三肽-2等。
肽具有独特的带电性、亲疏水性、不同的分子质量,以及可形成不同构型的特点[12],为色谱对其进行分离分析提供了理论基础。例如,肽根据本身含有的某些氨基酸特定结构如苯环结构可以产生一定的光学性质(紫外吸收和荧光吸收),如α-氨基酸可以发生茚三酮反应、Sanger反应和Edman降解等,如酰胺键可以发生双缩脲。根据R基的电荷性和极性,多肽可以表现出酸性、碱性和中性,强水溶性和弱水溶性等。
常见肽以获取来源可以分为天然提取肽、生物合成和人工化学合成肽[13]。其中,天然提取肽,通常是从海洋、可食用植物中提取,动物提取较少。其受到提取材料的地理和环境的影响,操作工艺较为复杂,产量较低,成本高。生物合成肽,适合制备大于50个氨基酸组成的目的多肽,较易获得,且随基因重组技术发展,推动了该技术的快速发展。人工合成肽,主要是通过化学合成的方法来制备多肽,产量高且成本低[11],但由于合成过程副产物多,且环境不友好,因而受到限制。
2015年多肽类药物在全球销售额达到220亿美元,目前约有80种肽类药物被批准销售上市,处于开发研究和临床试验阶段的还有上百种。据透明度市场研究(Transparency Market Research)调查报告《Protein Hydrolysates Market》显示,肽作为蛋白质水解产物的重要功能性成分之一,越来越多地被用于食品、临床营养、化妆品和个人护理等领域[14]。据全球领先数据提供机构市场观察(MarketWatch)报道,2021年口服肽复合年增长率为6.6%,到2026年预计将达到11.394亿美元[15]。肽具有食品营养和呈味、疾病治疗、美容抗衰老等功能,在食品、医疗和美容化妆品等领域应用广泛。在食品领域,来自天然生物质资源的蛋白质水解物和肽可根据其生物活性被用作功能性食品,例如一些从海洋提取的具有抗氧化作用生物活性肽,从植物获得的抗菌肽等,抗菌肽AMPs在食品保存中能起到抑菌作用达到抑制脂质氧化[16]。在医疗方面,肽疗法在医疗实践中发挥了显著的作用,宿主防御肽(host defense peptide,HDP)表现出广泛的抗菌和免疫调节活性[17],ACE-抑制肽具有抗血压、降血脂的功能[18]。另外,有些肽经研究发现具有抗抑郁作用[19]。在美容化妆品领域,肽不仅可以治疗面部老化,还可以治疗痤疮和改善皮肤的先天免疫系统,以及紧致皮肤和淡化色斑[10]。因此,随着肽的种类和数量需求的快速增加,对于肽的分离技术提出了更高的要求。
2 色谱技术原理及其应用
2.1 离子交换色谱
2.1.1 离子交换色谱的原理及其特点
离子交换色谱(ion exchange chromatography,IEC)是分离带电肽的一类重要的色谱技术。在一定pH下,待分离的肽和流动相,与固定相上的离子交换剂基团进行可逆的相互作用,因作用力强弱不同与离子交换剂基团相互竞争吸附。阴离子交换剂优先对作用力强的负电荷含量高的肽进行静电吸附,而含正电荷的肽被洗脱下来[20],最后通过高盐浓度梯度或pH梯度洗脱液将待分离肽洗脱下来从而达到分离目的。洗脱过程中,与离子交换剂结合作用弱的先被洗脱下来,而结合作用强的被后洗脱下来[21](图1)。

图1 离子交换色谱原理Fig.1 Principle of ion exchange chromatography
“离子电荷性质”是离子交换色谱分离肽溶液的核心。有学者指出离子交换色谱在亲水性化合物的分析和纯化中发挥了重要作用[22]。肽溶质与离子交换剂的交换结合力,主要取决于它们的物理化学性质和等电点呈现的离子状态,例如环境pH高于等电点时,肽带负电荷与阴离子交换剂结合,相反则与阳离子交换剂结合。HENNEMAN等[23]在探究分离多肽及其混合物中指出根据肽或蛋白质的理化性质在已知pH的电荷下可以采用离子交换色谱进行分离。同时,环境pH与等电点的差值越大,肽与离子交换剂的结合力越强。被分离的肽的电荷密度和等电点值与色谱柱上的离子交换剂的离子容量大小决定保留能力的强弱。离子交换色谱最为明显的优势在于它的分离条件最接近生物的生理环境,利于温和条件下的可逆洗脱操作且不易导致肽变性,对生物分子有一定的兼容性。但是,由于其定性能力较差,需要联合其他多种分离技术进行操作,而且该色谱较昂贵,结构复杂,不太适合分离对pH和金属离子敏感的生物分子。
2.1.2 离子交换色谱在肽分离中的应用
离子交换色谱分离肽和小分子蛋白质的应用步骤主要包括:(1)根据预分离的肽性质选择适合的离子交换色谱;(2)肽溶液先在缓冲溶液预平衡;(3)以含有不同浓度NaCl的缓冲溶液以特定流速和检测波长进行洗脱。
如表1所示,琼脂糖凝胶和纤维素是最为常见的2种载体。一般阴离子键合固定相基团有二乙胺基乙基(diethyllaminoethyl,DEAE)和三甲胺基烷基季铵基(trimethylamino alkyl quaternary ammonium group,Q)等,阳离子键合固定相基团有磺丙基(sulfopropyl,SP)和羧甲基(carboxymethyl,CM)等。它们可以被键合于交联葡聚糖(sephadex)、纤维素(cellulose)等一些载体上。例如, DEAE键合于高流速琼脂糖凝胶能够形成一种弱碱性环境的阴离子交换介质,即阴离子交换色谱。有学者在研究芳族基团与多峰和常规离子交换树脂的相互作用机理中,指出芳香族部分可与多峰和常规离子交换树脂发生相互作用,阳离子(例如Na+)有助于减弱芳香族部分与配体的结合[21]。同时,由于液相色谱中存在的金属离子对于具有负电荷的多肽在阴离子交换色谱中的影响,有学者利用螯合剂进行处理[24],结果分离效果得到了有效的改善。因此,采用离子交换色谱分离肽溶质时需要考虑待分离溶液中是否有干扰离子及其浓度或含量。

表1 离子交换色谱柱在肽分离中的应用Table 1 Application of ion exchange chromatography in the isolation of peptide

续表1
一般而言,采用离子交换色谱分离肽时,常需用到Tris-HCl、HAc-NaAc、PBS和二乙醇胺等缓冲溶液进行预先平衡,缓冲液作用使得待分离的肽溶质带上一定的电荷并营造pH环境,使其与离子交换剂可以充分地结合。
洗脱方式常见有3种:第一种是改变缓冲液pH,从而改变肽的吸附状态为解吸附状态。例如,在阳离子交换色谱中,提高流动相pH使吸附在柱子上的带正电荷的肽带负电,从而达到解吸附;第二种是增加缓冲液的离子强度,将吸附强的分子从离子交换剂上替换下来,例如梯度不断增加的NaCl溶液;第三种即将前两者相互结合从而达到洗脱目的。已报道的文献中,常以NaCl进行洗脱居多,浓度范围在0~1.0 mol/L,流速一般控制在0.8~2.0 mL/min。需要注意的是,流速如果过快,电荷吸附作用差异不明显的肽溶质难以明显分离;但是流速过慢会消耗时间,降低分离效率。
肽的检测波长一般多在214~280 nm,常见的有214、220和280 nm,前两者是因为酰胺键的吸收波长与之接近,280 nm是用于检测含有苯环结构氨基酸,如L-色氨酸(Trp, W)和L-酪氨酸(Tyr, Y),这些氨基酸连接而成分子质量较高的肽。在具体的分离过程中,可以先扫描待测液的最大吸收波长,而后确定其检测波长。
由于离子交换色谱分离的依据主要是不同肽段所带电荷的不同,经先后分离不同电性肽段从而筛选和获取目标肽段。以常见的有降压作用的ACE-I抑制肽分离为例,大部分以DEAE作为阴离子固定相基团。NOORANI等[25]从沿海废弃的棘突猛虾蛄残肉中分离ACE-I抑制肽,分离过程中使用了DEAE 纤维素的离子交换色谱柱。将经过冻干获取的粗样品溶解于醋酸钠缓冲溶液,用1.0 mol/L NaCl为变化梯度以2.0 mL/min的流速进行洗脱,成功获得了3 000 Da的AC肽段和3 000~10 000 Da的TH肽段,经过后续的分离得到351 Da的MSN和388 Da的MTH两个肽段。而从植物提取的ACE抑制肽中,ZHANG等[26]从醋泡黑豆蛋白水解产物中提取ACE抑制肽,使用了DEAE琼脂糖凝胶的离子交换色谱柱,先用pH 8的10 mmol/L Tris-HCl缓冲液平衡后,用含0、0.05、0.1和0.2 mol/L NaCl的缓冲液以1.8 mL/min的流速逐步洗脱样品,最终分离出了IILLSF、SIKFGSF和RSPEDSIIF等3个肽段。CHEN等[27]从薏苡仁中也采用该类离子交换色谱柱,先用pH 8.8的二乙醇胺缓冲液平衡薏苡仁醇溶蛋白后,用0~0.5 mol/L的NaCl以2.0 mL/min流速进行洗脱,获得分子质量小于3 kDa的肽段。
2.2 分子排阻色谱
2.2.1 分子排阻色谱的原理及其特点
分子排阻色谱(size exclusion chromatography,SEC),亦称之为凝胶过滤层析,是一类分离不同分子质量肽的重要色谱技术,其分离原理类似于过滤,是基于具有网状结构的凝胶颗粒发挥分子筛作用,在流动相的带动下筛选并过滤出分子质量不同的肽,分子质量越小的肽越能够进入凝胶的内部孔径中而导致留出时间越慢,而无法进入凝胶颗粒的大分子则可直接穿过凝胶颗粒的颗粒间隙流出(图2)。

图2 体积排阻色谱原理Fig.2 Principle of size exclusion chromatography
与离子交换色谱不同的是,分子排阻色谱中待分离的肽不会跟色谱基质发生作用,适合分离对pH和金属离子敏感的生物分子,具有高选择性和高分辨率[6]。不足之处在于样品的检测收集消耗时间,分辨率会受到凝胶孔径和粒径的大小和均匀度的影响。
2.2.2 分子排阻色谱在肽分离中的应用
分子排阻色谱在肽的初步分离中发挥了重要作用。文献调查发现,交联葡聚糖凝胶(Sephadex)是分离肽最常见的分子排阻色谱填料,最为普遍使用的是Sephadex G-15 和 Sephadex G-25,分离的肽分子质量普遍在200~1 300 Da。在G-X中,X代表交联葡聚糖凝胶吸水值的10倍。即G-15为每克交联葡聚糖凝胶膨胀时能吸取1.5 g水,因此数值越大,其吸水膨胀越明显,分子交联程度越复杂,孔径越小,小分子肽越难以透过。分子排阻色谱的色谱柱长度、流动相和流速与离子交换色谱柱不一样。其中,分子排阻色谱的色谱柱长度一般是离子交换色谱柱的5~10倍。为了使得交联葡聚糖凝胶可以充分分离肽溶质,一般的流速控制在0.2~1.0 mL/min。同时,分离过程不需要和离子交换色谱柱一样附带高浓度离子进行洗脱,一般采用含有少量可以溶解肽的盐酸的超纯水或者缓冲溶液。分子排阻色谱在肽分离中的应用具体实例见表2。
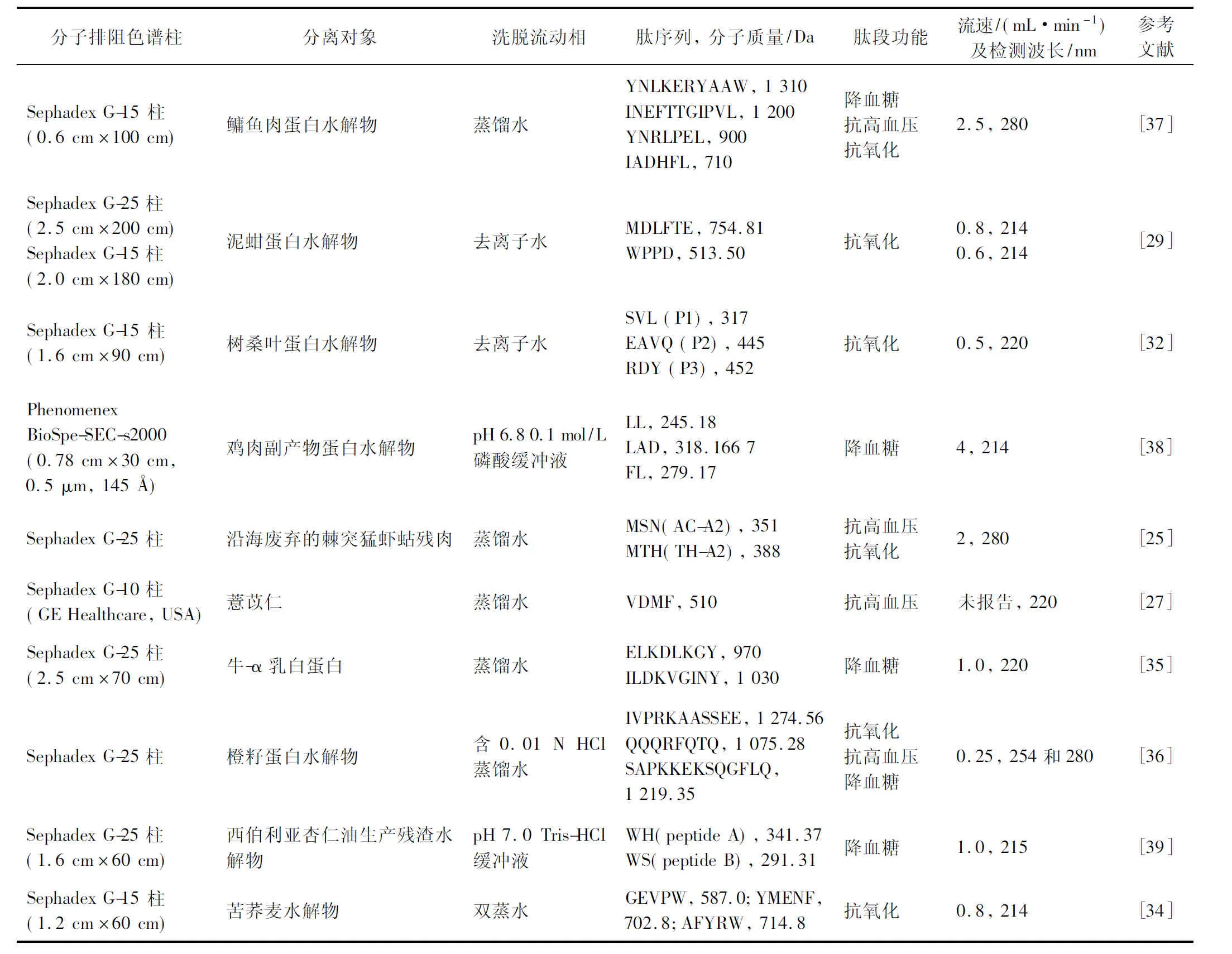
表2 分子排阻色谱在肽分离中的应用Table 2 Application of size exclusion chromatography in the isolation of peptide
一般而言,使用分子排阻色谱洗脱肽的步骤主要包括:填料溶胀、装柱排气、上样、洗脱和收集馏分。先将交联葡聚糖凝胶干粉在超纯水或缓冲溶液中浸泡4~5 h使其充分溶胀,多次洗涤和除气。分子排阻色谱柱使用前需要洗涤干净,垂直地固定在铁架台上。先将超纯水或缓冲溶液加入分子排阻色谱柱,适当调节恒流泵的流速将柱内的气泡排除。将超纯水或缓冲溶液液面降低至距离下端出水口1.0~2.0 cm时关闭恒流泵。将溶胀好混匀的交联葡聚糖凝胶缓慢加入分子排阻色谱柱,待其自然沉降后,再加入超纯水或缓冲溶液洗脱平衡1~2个柱床体积,直到紧密和均匀的凝胶色谱柱形成。接着,缓慢地加入不超过柱床体积10%的肽溶液,开启恒流泵,待其洗脱至液面与凝胶色谱柱顶端液面齐平时,关闭恒流泵再加入缓冲溶液,再开启恒流泵继续洗脱。在洗脱过程中,收集馏分。
由于分子排阻色谱主要以分子质量大小作为分离依据,因此肽的离子性和极性对其分离过程影响不大。以树桑叶蛋白水解物为例,分子排阻色谱柱的柱长选择90 cm,流速控制在0.5 mL/min,抗氧化肽组分F5在Sephadex G-15色谱柱中经去离子水洗脱后分离出69.74%的450~1 400 Da的肽段和22.56%的300~450 Da小分子肽段[32]。而同样采用Sephadex G-15色谱柱分离苦荞麦水解物肽分子的流速控制在0.8 mL/min,当其收集体积在20~30 mL时,·OH清除率最高的肽片段的分子质量在550~750 Da[34]。这两者都是植物提取的抗氧化肽,在Sephadex G-15色谱柱中均分离出了分子质量在500~800 Da的肽段。而利用Sephadex G-10色谱柱分离由离子交换色谱初分离获得的薏苡仁抗高血压肽馏分C,结果显示该组分虽然分离出了C1和C2两个主要馏分[27],但其分离度并不明显,虽然该文献中并未显示出具体的柱长和流速,但是这种情况下可以尝试增长柱长,减小流速以提高分离度。对于Sephadex G-25柱,牛-α乳白蛋白[35]和橙籽蛋白水解物[36]分离的降血糖肽段分子质量在900~1 300 Da。这也进一步应证了分子排阻色谱填料吸水值及其膨胀交联度跟分离的肽段分子质量存在紧密联系。一般而言,随着G-X的X数值增大,分子交联程度越紧密,小分子肽得以分离,大分子肽分离纯度更高。
2.3 反相高效液相色谱
2.3.1 反相高效液相色谱的原理及其特点
反相高效液相色谱(reversed-phase high performance liquid chromatography,RP-HPLC)是以表面非极性载体为固定相,以比固定相极性强的溶剂为流动相的一种液相色谱分离模式,基于样品中不同组分和分离基质疏水基团间疏水作用的强弱不同而进行分离,因具有分离效能高、选择性高、检测灵敏度高、分析速度快等优点,被广泛应用于肽的分离[40]。其工作原理是色谱柱内部填充的是表面经过酸化处理含有烷基(或苯环)的非极性微硅胶载体,流动相先在微硅胶表面形成一层溶剂膜,随着肽溶质分子的进入,肽的非极性基团与烷基(或苯环)作用而占据部分溶剂膜空间,而形成吸附的单分子吸附层。由于这种吸附是具有可逆性的,当流动相的极性发生变化时如非极性增强,肽溶质分子会发生解吸附而被洗脱下来。因此,流动相在由强极性流动相变为低极性流动相时,强到低极性肽溶质分子会先后被洗脱下来(图3)。
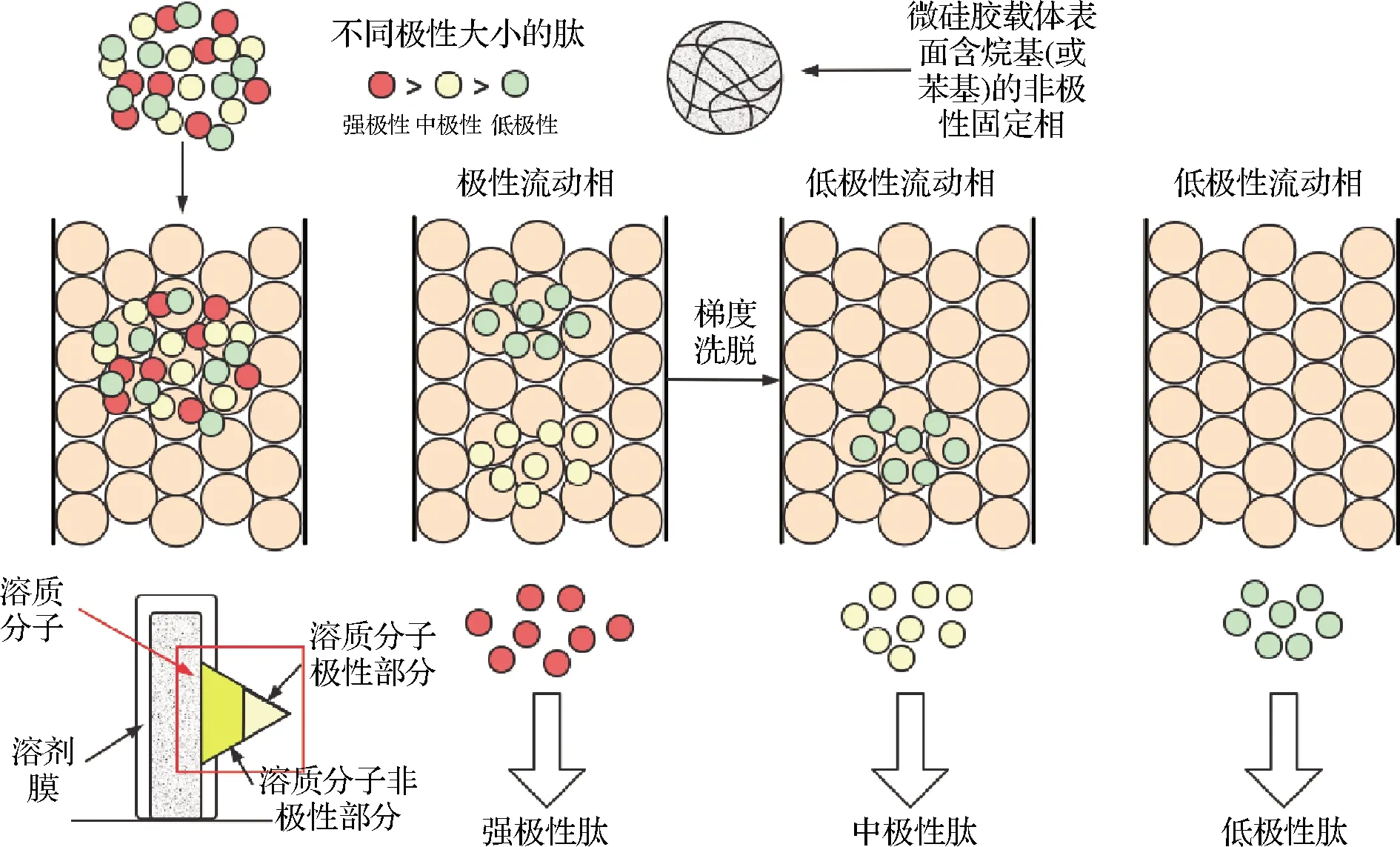
图3 反相高效液相色谱原理Fig.3 Principle of reversed-phase high performance liquid chromatography
微硅胶表面经烷烃C8和C18处理显示出非极性,随着碳链的增长非极性增大其疏水性增强,肽溶质的极性越弱,疏水性越强,保留值越大,出峰时间越久[41],因此色谱柱填料的选择需要根据待分离的肽溶质的性质进行衡量。反相色谱柱具有使用简便、高分辨性、高敏感性和分离时间快等优点,但是价格昂贵,洗脱剂通常为有机溶剂,容易污染环境。
2.3.2 反相色谱在肽分离中的应用
在选取反相柱色谱进行肽分离时,流动相一般选择超纯水和乙腈,有时添加体积分数为0.05%~0.1%二氟乙酸、三氟乙酸、蚂酸或磷酸。这类酸一方面可以调节洗脱体系中溶液的酸碱度,同时还能作为离子对试剂与肽上的正电荷和极性基团相互作用而减少极性保留问题,增强分离效果,进而改善出峰的峰型、峰宽和拖尾等问题。流速通常控制在0.2~1.0 mL/min,而洗脱方式一般采用梯度洗脱而不是等度洗脱,这主要是因为该方式不仅可以缩短分析周期,提高分离能力,还可以改善峰型,减少拖尾,提高灵敏度。柱温一般控制在室温至30 ℃。一般而言,色谱柱填料孔径的选择十分重要,主要根据分离肽的分子质量来进行选择。肽的分子质量一般在240~6 000 Da,而2~5 kDa分子质量肽的孔径范围一般选择130~300 Å(即13~30 nm),而低于2 kDa一般选择80~120 Å(即8~12 nm)。利用反相色谱分离肽的具体实例见表3。

表3 反相高效液相色谱柱在肽分离中的应用Table 3 Application of reversed-phase high performance liquid chromatography in the isolation of peptide
肽分子分离前需进行充分溶解,由于肽段同时含有疏水和亲水氨基酸,采用单一水相溶解难以达到完全溶解的目的, 需要添加有机相进行助溶如用含0.1%三氟乙酸(trifluoroacetic acid,TFA)的超纯水和乙腈等体积的流动相混合溶解样品。如果样品蛋白含量较高,溶解液会出现蛋白质的絮凝现象,此时需要采用0.22 μm针头滤膜过滤。
以沃特斯XSelect®Peptide CSH C18柱(4.6 mm×100 mm, 3.5 μm, 130Å)分析柱为例,该分析柱通常被用于分离纯化3 kDa以下的肽段。由于其柱长较短,相对于150~250 mm的分析柱的流速一般控制在1.0 mL/min,而该分析柱柱长较小,流速一般设置为0.2 mL/min,进样量设置为2 μL。此外,肽分析柱还有美国aapptec的TR-AA010119 Spirit Peptide C18(4.6 mm×100 mm, 5 μm),该柱子通常被用于分离合成多肽。以合成多肽为例子,当分离的肽多且峰靠拢,可尝试调节流动相的洗脱梯度,以提高分离度。但是,如果应用于制备型色谱柱,这将会消耗大量流动相并增加成本。此时,可考虑将样品进行二次分离纯化。
在大量分离多肽时,可以采用岛津制备型LC-20AP高效液相色谱系统。Spirit peptide 120 C18(21.2 mm×250 mm, 10 μm)制备型色谱柱可以用于分离5 kDa以下的合成肽分子。此时,流速可以设置到10~30 mL/min,进样量可以达到10~20 mL,同时通过在HPLC系统中设置流动相的洗脱斜率和水平高度可以实现不同肽馏分的自动收集。此外需要注意的是,采用乙腈作为流动相时,由于乙腈在190 nm存在较强的吸收,对于肽键214 nm的测定存在一定的干扰,可以尝试更换为其他吸收波长如220或254 nm,或者扫描214~280 nm的肽吸收峰确定较佳测定波长。
3 结语与展望
本文对离子交换色谱、分子排阻色谱和反相高效液相色谱等3种色谱技术在肽分离中的应用,从技术原理及其特点、应用实例进行了综述。总体而言,对于预分离样品肽的分析和鉴定,一般需要先对原料进行预处理如采用酶进行水解,水解产物可以通过超滤对分子质量不同的肽溶质进行截留分离,再采用色谱技术进一步分离。根据分离肽的类型不同,通常先经过离子交换色谱柱筛选出所需要的电性肽,或经过分子排阻色谱的分子筛的作用选择筛选不同分子质量的多肽,或根据肽分子极性的不同利用反相HPLC进一步分离。最后,再通过液质联用技术、超高效液相色谱-飞行时间质谱联用技术和核磁共振等等进一步确定肽的氨基酸序列和空间结构。
伴随仪器设计科学和人工智能的发展,色谱技术在肽的分离中的应用会不断朝“多位一体化”的步伐迈进,实现多种方法相结合。例如,有学者同时富集糖肽和磷酸肽中运用离子交换色谱和亲水作用色谱,并对2种色谱技术进行了优化和调整[45]。这不仅可以缩短操作程序实现一体化,而且极大地提高科研工作的效率。因此,这不仅为仪器设计者提供了设计灵感,也提出了更高的设计挑战,需要对设备不断地改善和优化其单一的技术效果,如灵敏快速的检测分析系统和定性定量分析能力以跟进实际科研和生产需求。此外,其他有关的肽分离色谱技术也在不断发展起来,如固相金属亲和色谱分离具有配体专一化的肽,超临界流体色谱[46]筛选和分离发挥药理作用的肽,用毛细管电色谱[47]定性和定量分析肽,以及一些环境友好的技术如高静水压力和脉冲电场[48]等。还有利用人工智能深度学习开发辅助肽数据库的检索和匹配任务,大大提高了肽段鉴定的灵敏度和可靠性[49]。色谱技术及其副产品的发展未来会带动肽分离取得更大进展,从而提高肽在食品、医疗和化妆品等领域的应用,更好地满足于市场需求。

