壳聚糖-核桃多肽脂质体的制备及表征
郝静,涂心怡,曹诗诺,汪涛,王丰俊
(北京林业大学 生物科学与技术学院,林业食品加工与安全北京市重点实验室,北京,100083)
我国核桃(JuglansregiaL.)资源丰富,2018年核桃干果产量达382万t[1]。榨油后的核桃粕中含有大量蛋白质,可用于制备核桃多肽,减少核桃蛋白资源的浪费,提高核桃粕的利用价值。核桃多肽具有多种生理活性,如抗氧化[2]、抗疲劳[3]、降血压[4-5]等,但核桃多肽消化稳定性和贮藏稳定性较差。脂质体主要是由卵磷脂制备的具有磷脂双分子层的囊泡状结构载体,具有无毒性、生物相容性等优良特性,脂质体包封生理活性物质的研究引起了诸多研究者的兴趣[6-7]。将生理活性物质如多肽类包封于脂质体可以起到缓释、提高其稳定性和生物利用度的作用[8],但常规脂质体在贮存过程中易被氧化,而对其进行表面修饰可以减少环境降解和磷脂双层渗透,并能保护脂质体系统中的负载物[9]。壳聚糖作为一种天然阳离子多糖,具有生物相容性,可用于修饰脂质体,提高其稳定性[10-12]。
本研究采用薄膜分散-水化法将核桃多肽包埋于脂质体(peptide liposome,P-L)中,再利用壳聚糖对其进行修饰,以提高其稳定性。通过研究多肽与卵磷脂、胆固醇与卵磷脂、吐温-80与卵磷脂的质量比,以及壳聚糖浓度、超声波处理时间对壳聚糖-脂质体包封效果的影响,得到壳聚糖-核桃多肽脂质体(peptide chitosan-coated liposome,P-CHL)制备的最佳工艺,并通过马尔文粒度仪、透射电镜对其进行表征。
1 材料与方法
1.1 材料与试剂
核桃多肽,实验室前期制备;NaOH、Na2CO3、酒石酸钾、CuSO4·5H2O均为分析纯,北京化工厂;CHCl3为分析纯,北京蓝弋科技有限公司;壳聚糖(脱乙酰度≥90%)、卵磷脂(90%)、胆固醇(95%),上海源叶生物科技有限公司;吐温-80(500 mL),广东光华科技股份有限公司。
核桃多肽的制备:由核桃脱脂粉经非蛋白复合酶(纤维素酶、果胶酶和淀粉酶质量比为5∶2∶3)于35 ℃酶解3 h,制得核桃粕破壁的悬浮液,再经3 g/L碱性蛋白酶于50 ℃酶解3 h,90 ℃灭酶8 min后,离心取上清液,冻干即得核桃多肽,用凯氏定氮法测得样品中的多肽含量为(52.36±0.34)%。
碱性铜试剂的配制:称取Na2CO350 g,NaOH 10 g溶解于400 mL蒸馏水中,作为甲液;称取CuSO40.25 g溶解于30 mL蒸馏水中,称取酒石酸钠0.5 g溶解于50 mL蒸馏水中,二者搅拌混匀,作为乙液。临用前,甲乙混匀并定容至500 mL。
1.2 仪器与设备
Millipore 15 mL/30 kDa超滤离心管,北京索莱宝科技有限公司;H/T16MM型台式离心机,湖南赫西仪器装备有限公司;HC-2518R型高速冷冻离心机,安徽中科中佳科学仪器有限公司;R-210型旋蒸仪,步琦实验设备贸易(上海)有限公司;Biosafer 650-92型超声细胞破碎仪,赛飞(中国)有限公司;H-7650型透射电镜,日本HITACHI有限公司;ZC90型激光粒度仪,英国马尔文仪器有限公司。
1.3 包封率的测定
1.3.1 核桃多肽含量的测定
采用福林酚法。称取标准牛血清白蛋白0.002 4 g,配成质量浓度为0.24 mg/mL的标准液。取牛血清蛋白标准液0、0.1、0.3、0.5、0.7、0.9 mL,分别用蒸馏水补足至1.0 mL后,加入1.0 mL碱性铜试剂混匀,快速加入4.0 mL福林酚试剂混匀后于55 ℃水浴5 min,冷水浴5 min后于650 nm下测吸光值。以牛血清白蛋白的浓度为横坐标,对应的吸光值为纵坐标绘制标准曲线。
取1.0 mL多肽溶液代替牛血清白蛋白标准液,其余步骤同以上操作,测得的吸光值代入标准曲线,计算得到多肽样品的浓度。
1.3.2 游离肽的分离
参照文献[11]的方法稍作改动。取样品3.0 mL于截留分子质量为30 kDa的超滤离心管,4 000 r/min离心30 min,记录滤液体积V1。壳聚糖-空脂质体操作同上述步骤,滤液(V0)作为空白。测得多肽质量浓度分别记为ρ1、ρ2。
1.3.3 包封率的计算
取2.0 mL的曲拉通100(0.06%,质量分数)于1.0 mL样品中,涡旋混匀,取混合液1.0 mL代替牛血清白蛋白标准液,后续步骤同标准曲线,总肽质量浓度为ρ2,包封率按公式(1)计算:

(1)
1.4 壳聚糖-核桃多肽脂质体的制备
参照文献[13]的方法稍作改动。取一定量的大豆卵磷脂、胆固醇溶于10 mL CHCl3后,于55 ℃旋蒸30 min成膜,然后将旋蒸瓶置于通风橱干燥至无CHCl3后,加入10 mL pH 7.4、含有一定量核桃多肽和吐温-80的PBS(0.01 mol/L)于相转变温度(60 ℃)振荡混匀,水浴1 h,得到的粗脂质体混悬液于4 ℃下超声波处理,得到纳米脂质体。
取一定量的壳聚糖溶于体积分数1%的乙酸溶液,磁力搅拌3 h,得到壳聚糖乙酸溶液。将壳聚糖乙酸溶液缓慢滴加到等量的脂质体溶液中,边滴加边搅拌,之后磁力搅拌1 h,将上述混悬液于4 ℃过夜,得到壳聚糖-核桃多肽脂质体,并于4 ℃保存。
其他因素不变,固定卵磷脂为0.09 g,超声波功率500 W,分别探究多肽质量浓度(2.0、4.0、6.0、8.0 mg/mL)、胆固醇与卵磷脂的质量比(1∶4、1∶6、1∶9、1∶10)、吐温-80与卵磷脂的质量比(1∶9、2∶9、3∶9、4∶9)、壳聚糖质量分数(0.2%、0.4%、0.6%、0.8%)、超声波处理时间(2、4、6、8、10 min)对壳聚糖修饰脂质体包封效果的影响。
1.5 Zeta电位及粒径分析
样品的Zeta电位与粒径采用动态光散射(dynamic light scattering,DLS)技术测定。将样品用pH 7.0的PBS(0.01 mmol/L)稀释50倍作为样液备用。设置激光粒度仪温度为(25±0.1) ℃。测3组平行,结果取平均值。
1.6 微观形貌
采用透射电镜分析样品微观形貌。吸取等量样品用磷钨酸进行负染,随后将负染后的样品滴加到覆盖碳膜的铜网上,自然晾干后上样,在80 kV加速电压下观察。
1.7 数据分析及处理
所有实验至少平行测定3次,采用Excel 2010、SPSS Statistics 22.0软件对数据进行分析。采用Duncan进行显著性分析,P<0.05表示差异显著。
2 结果与分析
2.1 多肽与卵磷脂的比例对壳聚糖修饰脂质体的影响
多肽与卵磷脂的比例是影响包封率的重要因素,直接反映脂质体的载药能力[14]。如图1所示,在一定范围内,随着多肽浓度的增加,包封率增大。当多肽质量浓度超过4.0 mg/mL时,包封率出现下降趋势,可能是由于脂质体内空间有限,对核桃多肽的包埋具有饱和性。故选择多肽质量浓度为4.0 mg/mL,此时包封率最大为76.13%,Zeta电位为(+5.92±0.43)mV,具有较强的静电斥力,能够防止脂质体的聚集或絮凝,粒径(80.30±0.35)nm,多分散系数(polydispersity index,PDI)为0.25,呈现均匀的分散性。

图1 多肽与卵磷脂的比例对壳聚糖修饰脂质体的影响Fig.1 Effect of the ratio of peptide to lecithin on chitosan-coated liposomes
2.2 胆固醇与卵磷脂的比例对壳聚糖修饰脂质体的影响
胆固醇可提高脂质体膜的致密度和柔韧性[15],常用作脂质体的稳定剂。不同浓度的胆固醇对脂质体的稳定性和载药能力影响不同。在适宜浓度的胆固醇存在下,多肽可以更有效地嵌入脂质体的磷脂双分子层中,提高脂质体包封率。较高水平的胆固醇会扰乱磷脂双分子层结构,还可能降低脂质体电荷之间的静电排斥[16],使囊泡不能承载其内核的所有肽,导致脂质体聚集絮凝。
如图2所示,随着胆固醇添加量的增加,包封率先增大后减小。当胆固醇与卵磷脂质量比达到1∶9时,包封率达到最高值为75.25%,Zeta电位为(+5.70±0.28)mV,此时粒径(80.30±0.35)nm,PDI为0.25±0.01,粒径分布均匀,脂质体溶液处于稳定状态。故选择胆固醇与卵磷脂的质量比为1∶9,制备脂质体。

a-包封率;b-Zeta电位;c-粒径、PDI图2 胆固醇与卵磷脂的比例对壳聚糖修饰脂质体的影响Fig.2 Effect of the ratio of cholesterol to lecithin on chitosan-coated liposomes
2.3 吐温-80与卵磷脂的比例对壳聚糖修饰脂质体的影响
吐温-80是一种聚氧乙烯衍生物[17],可通过物理吸附于脂双层表面,聚氧乙烯基结合磷脂胆碱基团,在脂质体表面形成具有一定厚度的亲水层,维持脂质体内核微环境稳定[18]。
如图3所示,随着吐温-80添加量的增加,脂质体尺寸逐渐减小。当吐温-80与卵磷脂的质量比超过2∶9时,包封率由74.1%逐渐下降,这可归因于乳化剂添加过量导致乳化程度过大,脂质体体积过小,脂质体内空间受限,不能对核桃多肽进行有效地包埋。因此,选择吐温-80的添加量为2 mg/mL时制备脂质体,此时电位为(+4.83±0.21)mV,粒径(80.30±0.01)nm,PDI为0.25±0.01,呈现良好的分散性。

a-包封率;b-Zeta电位;c-粒径、PDI图3 吐温-80与卵磷脂的比例对壳聚糖修饰脂质体的影响Fig.3 Effect of the ratio of Tween-80 to lecithin on chitosan-coated liposomes
2.4 壳聚糖含量对壳聚糖修饰脂质体的影响
适量的壳聚糖包覆在纳米脂质体表面,可提高纳米脂质体的物理稳定性,抵抗机械应力,降低负载物的释放速率[11]。当过量的壳聚糖存在时,脂质体表面长链的壳聚糖片段之间相互作用而发生桥联絮凝,导致多肽泄露;含量过低,壳聚糖不能对脂质体进行良好地包覆,导致脂质体发生聚集,粒子与液体介质间发生明显的相分离[12]。壳聚糖还可以防止脂质体在加工和储存过程中被氧化[11]。
如图4所示,当壳聚糖质量分数超过0.4%时,包封率降低,这可能与壳聚糖的电荷作用有关,过量的壳聚糖可能与多肽竞争脂质体中相同的结合位点,从而取代多肽[19]。随着壳聚糖含量的增加,壳聚糖-核桃多肽脂质体的平均粒径增大,这可能是由于壳聚糖含量较高,在脂质体表面形成的壳聚糖层较厚。Zeta电位也与壳聚糖浓度呈正相关,随壳聚糖层的增厚而增大。综合考虑壳聚糖浓度对脂质体的影响,选择壳聚糖质量分数为0.4%,此时包封率最高为68.67%,电位(+6.05±0.31)mV,粒径(80.30±0.35)nm,PDI为0.27±0.03,呈现均匀的分散性,溶液处于稳定状态。

a-包封率;b-Zeta电位;c-粒径、PDI图4 壳聚糖含量对脂质体的影响Fig.4 Effect of the concentration of chitosan on liposomes
2.5 超声波处理时间对壳聚糖修饰脂质体的影响
未经超声波处理的脂质体为乳白色乳状液,粒径较大,且粒度分布不均;处理后,粒径减小,因而具有减少沉淀的倾向。如图5所示,超声波处理时间短,脂质体数量多且分子质量大,容易絮凝;处理时间长则会对脂质体结构造成损害,导致多肽不能全部包埋于脂质体中。故选择超声波处理时间6 min,此时包封率最大为63.44%,粒径(83.30±0.35)nm,PDI为0.25±0.01,粒度分布均匀,Zeta电位为(+5.67±0.21)mV。

a-包封率;b-Zeta电位;c-粒径、PDI图5 超声波处理时间对壳聚糖修饰脂质体的影响Fig.5 Effect of the ultrasonic time on chitosan-coated liposomes
通过单因素试验,以包封率为指标,综合考虑粒径、PDI与Zeta电位,确定了制备壳聚糖修饰脂质体的最佳工艺:m(多肽)∶m(胆固醇) ∶m(吐温-80) ∶m(卵磷脂)=4∶1∶2∶9,壳聚糖质量分数0.4%,超声波处理时间6 min。
2.6 脂质体的表征
以最佳工艺参数制备的脂质体的粒径、Zeta电位及包封率的测定结果如表1所示。粒径和PDI是衡量脂质体体系稳定性、均匀性[6]和生物利用度[20]的重要物理参数。PDI在0.4以下是粒径分布均匀的标志[21]。DLS结果表明,0.4%壳聚糖修饰后纳米脂质体的尺寸有所增加,粒径由(70.67±0.17)nm增大至(80.30±0.35)nm,这可归因于壳聚糖与磷脂双分子层的相互作用。此外,多肽分解得到的一些疏水性氨基酸与脂质体脂双层的酰基链形成疏水作用,从而导致脂质体的柔韧性和粒径增大,提高载药能力[22]。脂质体体系的PDI也由0.20增大至0.25,保持在0.4以下,可看作为一个单分散的均匀体系。PDI的增加受脂质体中多肽的调控。多肽的电荷和各氨基酸残基之间的相互作用对脂质体的分散有一定的影响[16]。结果与RAMEZANZADE等[13]制备的虹鳟鱼皮抗氧化肽脂质体相似,添加0.4%壳聚糖修饰后,粒径由(163.4±5.9)nm增大至(197.0±2.1)nm,PDI由(0.33±0.1)增大至(0.43±0.01)。
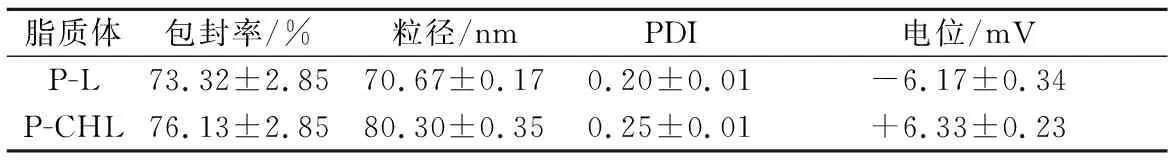
表1 P-L、P-CHL的包封率、粒径、PDI、电位Table 1 Encapsulation efficiency, size, PDI, Zeta potential of P-L and P-CHL
Zeta电位是预测和控制脂质体稳定性的重要指标[23]。壳聚糖修饰后,Zeta电位由(-6.17±0.34)mV增加到(+6.33±0.23)mV,这种电势的转变很可能是由于带正电荷的壳聚糖氨基与带负电荷的磷脂基团表面之间的离子吸引,表明壳聚糖成功地包覆在核桃多肽脂质体表面[24]。电势的增大也可以增强脂质体间的静电斥力,防止聚集或絮凝。PANYA等[25]指出壳聚糖通过静电作用沉积在纳米脂质体表面,增加电荷密度并形成有一定厚度的外部层,增强了系统的物理稳定性,从而降低了脂质体的聚结和聚集倾向。同时,壳聚糖修饰纳米脂质体的过程使亲水性增强,正电荷和亲水性都促进了小肠上皮细胞的更好吸收[26]。
包封率揭示了生物活性化合物在脂质体中的保留能力。壳聚糖对核桃多肽脂质体的包封率有明显影响,壳聚糖修饰后,P-L的包封率由(73.32±2.85)%增大至(76.13±2.85)%。很可能是壳聚糖包覆在脂质体表面或插入磷脂双分子层以填补空白,从而防止核桃多肽从脂质体中泄露。另外,壳聚糖带正电荷,多肽表面带负电荷,可能是壳聚糖与游离多肽因电荷中和而结合[10],减少了游离肽。LIU等[27]制备的牛血清白蛋白与脂双层表面均带负电荷,相同电荷间产生斥力,故制备的脂质体包封率仅为34%左右。这也说明P-L较P-CHL包封率低的原因之一可能是核桃多肽与脂质体均带有负电荷,表现出一定的静电斥力。
2.7 微观形貌
如图6-a所示,脂质体呈囊泡状[28],表面光滑;0.4%壳聚糖修饰后(图6-b),脂质体分布均匀,脂质体的大小明显大于P-L;如图6-b、6-c所示,包载多肽前后没有明显差异。透射电镜图像证实了DLS结果。囊泡大小不一,并且存在小囊泡向大囊泡融合的趋势。这是由于脂质体存在Oswald熟化行为[29],可使脂质体更加稳定。

a-P-L;b-壳聚糖-空脂质体;c-P-CHL图6 P-L、壳聚糖-空脂质体与P-CHL的TEM(×200 000)图Fig.6 The TEM(×200 000) images of samples P-L,CHL and P-CHL
3 结论
采用薄膜分散-水化法将核桃多肽包封于脂质体中,再利用壳聚糖对其进行修饰,通过单因素试验得到壳聚糖-核桃多肽脂质体制备的最佳工艺参数:m(多肽)∶m(胆固醇) ∶m(吐温-80) ∶m(卵磷脂)=4∶1∶2∶9,壳聚糖质量分数为0.4%,超声波处理时间6 min。此时,壳聚糖-核桃多肽脂质体的包封效果最佳,包封率为(76.13±0.84)%,粒径为(80.30±0.35)nm,PDI为(0.25±0.01),电位为(+6.33±0.23)mV。透射电镜结果表明,壳聚糖-核桃多肽脂质体呈现囊泡状结构,具备包载和控制释放的能力。
本研究成功地将核桃多肽包封于壳聚糖-脂质体中,可作为食品功能因子和营养强化因子,提高了核桃多肽的利用范围,为核桃粕深加工提供了一定的技术基础。

