滇黄精水提物联合间歇性禁食通过调节肠道菌群改善高脂饮食诱导的小鼠肥胖及肝损伤
卫钰成,杨敏敏,施琳,3,4*,刘天启,严淘,张妍,梁伊帆,周兰荠,邹家乐,张华峰,,3
1(陕西师范大学 食品工程与营养科学学院,陕西 西安,710119)2(陕西师范大学 西北濒危药材资源开发国家工程实验室,陕西 西安,710119)3(陕西师范大学 中俄食品与健康科学国际联合研究中心,陕西 西安,710119)4(陕西师范大学 西安市特色水果贮藏与保鲜重点实验室,陕西 西安,710119)
国际顶级期刊《柳叶刀》调查显示,我国有9 000万肥胖人群,其中1 200万属于重度肥胖,严重威胁健康。现代社会精细加工的高脂高糖饮食替代粗粮和粗加工食品是肥胖井喷式增长的主要诱因。高脂饮食诱导的肥胖常伴有血脂血糖异常、肝脏脂质堆积和氧化应激,显著增加2型糖尿病、心血管病以及多种癌症的患病率和死亡率[1]。如何有效预防高脂饮食诱导的肥胖及相关代谢紊乱问题是亟待解决的,关系民生的重要研究问题。
近年来,研究者针对多种食药同源植物开展了大量研究,发现一些可以通过其抗氧化、抗炎特性来降低高脂饮食诱导的肥胖及糖脂代谢紊乱等问题的天然资源[2]。黄精(Polygonatumsibiricum)被誉有“仙人余粮”、“救穷草”、“米脯”等美名,始载于《名医别录》,使用历史已有2 000多年,在古代被视为“长生不老和延年益寿”的植物资源,言其“久服轻身延年不饥”[3],具有抗氧化、降血脂血糖、调节免疫等多种有益作用[4]。滇黄精(PolygonatumkingianumColl.et Hemsl, PK)是我国著名的“气血双补之王”,产量大,经济价值高,富含多糖和皂苷,市场发展前景广阔。
古人在辟谷过程中通常服用黄精,但目前其健康养生功效机制未明。间歇性禁食是一种通过控制热量摄入或限制膳食摄入时间的断食模式,与辟谷理念不谋而合,可显著改善高血压[5]、糖尿病[6]、心血管疾病[7]和多种癌症等多种疾病,有益机体代谢健康,延缓衰老。研究证实了间歇性禁食对高脂诱导肥胖及肝脏脂质代谢异常[8-9],以及肠道菌群的有益调控作用[10-11]。饮食及其对肠道微生物群的影响与肥胖和代谢性疾病密切相关[12-13]。肠道微生物影响机体营养物质的获取、能量的调节以及脂肪的储存、生成和氧化,直接或间接地参与肥胖的发生,对维持人体健康至关重要。尽管已有研究表明黄精的有益作用,但其对高脂饮食诱导的肥胖和重要代谢器官/肝脏的损伤预防作用以及与肠道微生物关系鲜有报道,更缺乏对禁食期间服用黄精是否能够协同增效的探讨。
本研究首先采用植物广靶代谢组学技术分析滇黄精水提物化学物质基础,继而预防性给小鼠灌胃滇黄精水提物,创新协同间歇性禁食饮食模式,研究其对高脂饮食诱导的肥胖和肝脏损伤的改善作用以及对肠道菌群构成的影响,构建肥胖和肝脏损伤指标与肠道微生物构成改变的融合分析模型,筛选关键优势菌属作为调控靶点。对科学认知以黄精为代表的“食药同源”天然资源及间歇性禁食预防肥胖及其相关代谢问题的有益健康作用和机制提供理论依据。
1 材料与方法
1.1 实验动物
60只8周龄健康雄性C57BL/6 J小鼠,体重18~25 g,购自西安交通大学动物实验中心。
1.2 材料与试剂
云南产滇黄精,澜沧澎勃生物药业有限公司;饲养小鼠的高脂饲料(D12492, Research Diets, Inc.蛋白23.25%、脂肪34.55%、碳水化合物27.20%)、普通饲料(蛋白18.8%、脂肪5.2%、碳水化合物61.0%),江苏省协同医药生物工程有限责任公司;苏木精-伊红(hematoxylin-eosin,HE)染液、油红染液、苏木素染液、分化液、返蓝液、甘油明胶封片剂,Servicebio公司;4%多聚甲醛固定液、无水乙醇、异丙醇,均为分析纯,国药集团化学试剂有限公司;超氧化物歧化酶(superoxide dismutase, SOD)和丙二醛(malondialdehyde, MDA)检测试剂盒,南京建成生物工程研究所。
1.3 仪器与设备
JJ-12 J脱水机、JB-P5包埋机、JB-L5冻台,武汉俊杰电子有限公司;RM2016病理切片机,上海徕卡仪器有限公司;CRYOSTAR NX50冰冻切片机,美国Thermo公司;1290 Infinity LC,超高效液相色谱系统、Bioanalyzer 2100,安捷伦科技(中国)有限公司产品;Qubitt@ 2.0荧光仪,赛默飞世尔科技生命科学产品公司产品;KD-P组织摊片机,浙江省金华市科迪仪器设备有限公司;GFL-230烤箱,天津市莱玻瑞仪器设备有限公司;防脱载玻片,Servicebio公司;Nikon Eclipse E100正置光学显微镜、Nikon DS-U3成像系统,日本尼康公司;586型血糖仪,鱼跃医疗设备股份有限公司;MLX-208离心机,Eppendorf公司。
1.4 实验方法
1.4.1 小鼠分组及饲养
小鼠饲养在西安交通大学动物实验中心SPF级鼠房[温度(22±2) ℃,相对湿度60%],12 h明暗交替周期标准饲养,均自由饮用纯净水,且具有良好的通风和卫生条件。动物实验方案及操作均经陕西师范大学伦理委员会批准(2021-013)。
对所有小鼠先进行1周的动物实验室环境适应性喂养,随后将60只小鼠随机分为6组,3组以标准饲料喂养,另外3组以高脂饲料喂养2周后进行干预,连续干预8周。分组包括:正常对照组(normal-how, NC)、正常饮食+滇黄精干预组(NC+PK)、正常饮食+滇黄精联合间歇性禁食干预组(NC+PK+IF)、高脂对照组(HF)、高脂饮食+滇黄精干预组(HF+PK)、高脂饮食+滇黄精联合间歇性禁食干预组(HF+PK+IF)。每日进行灌胃干预,其中NC组、HF组使用0.1 mL生理盐水,其余组均使用0.1 mL风干滇黄精水提液(如1.4.2所示)。此外,NC+PK+IF组及HF+PK+IF组采用隔日禁食法。期间保持小鼠生活环境干净,并保证在非禁食期内各框饲料充足。
1.4.2 滇黄精水提液制备
将5 g风干滇黄精粉碎过筛,置于100 mL圆底烧瓶中,加入蒸馏水50 mL,浸泡1 h,回流水提3 h。水提液冷却后进行抽滤,滤液保存于冻存管中,置于-20 ℃冷冻备用。
1.4.3 滇黄精水提物多糖和总酚含量测定
配制0.1 g/L的标准葡萄糖溶液。精密移取0.2、0.4、0.6、0.8、1.0 mL至10 mL容量瓶中,补加蒸馏水至1 mL,再加入5%苯酚溶液1 mL,摇匀,再迅速加入5 mL浓硫酸,摇匀,于室温下静置5 min后于沸水浴中加热15 min,取出用自来水快速冲洗至冷却。以蒸馏水1 mL同法制备空白对照组,在490 nm处测定吸光度。以质量浓度(mg/L)和吸光度为横纵坐标绘制标准曲线,得线性回归方程y=3.312 8x+0.064 2,R2=0.994 8,同法测定供试品中多糖含量。
参照国标GB/T 8313—2018测定总酚含量。没食子酸标准品溶液质量浓度为1.760~7.040 μg/mL时线性关系良好,回归方程为:y=0.258 7x+0.061 6,R2=0.996 6。
1.4.4 滇黄精水提物代谢轮廓分析
用超高效液相串联四极杆飞行时间质谱(ultra performance liquid phase tandem quadrupole time of flight mass spectrometry,UHPLC-Q-TOFMS)技术,结合数据依赖采集方式对样本进行分析,获得一级质谱和二级质谱数据,采用XCMS软件对数据进行峰提取和代谢物鉴定。
取水提物冻干粉0.1 g溶于1 mL纯水中,加入1 mLV(甲醇)∶V(乙腈)∶V(水)=2∶2∶1溶液,涡旋60 s,低温超声30 min,重复2次,-20 ℃放置1 h沉淀蛋白,在14 000×g,4 ℃条件下离心20 min,取上清液分析。
具体仪器分析参数见表1。样品采用1 290 Infinity LC,超高效液相色谱系统HILIC色谱柱进行分离。梯度洗脱程序如下:0~0.5 min,95%B;0.5~7 min,B从95%线性变化至65%;7~8 min,B从65%线性变化至40%;8~9 min,B维持在40%;9~9.1 min,B从40%线性变化至95%;9.1~12 min,B维持在95%。分析时采用随机顺序进行样本的连续分析以避免仪器检测信号波动而造成的影响,并在检测队列中插入质控样品监测和评价系统的稳定性及实验数据的可靠性。

表1 代谢组学仪器分析参数Table 1 Instrument analysis parameters
分别采用电喷雾电离(ESI)正离子和负离子模式进行检测。样品经超高效液相色谱仪分离后用Agilent 6550质谱仪进行质谱分析。样本检测完毕后,采用AB Triple TOF 6600质谱仪对代谢物进行鉴定,采集样品的一级、二级谱图。二级质谱采用信息依赖获取获得,并且采用高灵敏度模式。IDA设置为排除4 Da之内的同位素,每个周期监测10个候选离子。为扩大二级谱图的采集率,数据采集按质量范围进行分段,50~300,290~600,590~900,890~1 200,每个方法每段采集4个重复。分别使用自建MetDDA和LipDDA方法对采集获得的数据进行代谢物的结构鉴定。
1.4.5 实验动物样品采集
实验期间各组小鼠每周固定时间记录其体重、饮食和饮水量,干预后观察小鼠精神活动状态,每14 d固定时间测量1次空腹血糖、收集1次小鼠粪便。干预8周后进行眼内眦空腹采血,立即离心(4 ℃、4 000 r/min,离心15 min)分离血清,保存于-80 ℃冰箱中待测。取肝脏、小肠组织置于4%多聚甲醛组织固定液中进行组织病理学观察。将采集保存的粪便送至上海中科新生命生物科技有限公司进行16S rDNA测序和生物信息学分析。
1.4.6 肠道微生物16S rDNA测序
试验末无菌采集小鼠粪便,于-80 ℃保存。采集的样品委托上海中科新生命生物科技有限公司进行粪便微生物16s rDNA测序。测序采用SDS法提取样本的基因组DNA,根据样品浓度,用无菌水将样品稀释至1 ng/μL,并在1%琼脂糖凝胶上对其DNA纯度和浓度进行检测。然后使用带有条形码的16S rRNA特定引物进行扩增,覆盖16S V3~V4区域:341F(5′-ACTCCTACGGGRSGCAGCAG-3′)-806R(5′-GGACTACVV GGGTATCTAATC-3′)。PCR扩增条件为 98 ℃初始变性1 min,30个循环扩增(98 ℃变性10 s,50 ℃退火30 s,72 ℃延伸60 s),72 ℃最终延伸5 min,反应在热循环PCR系统中进行。所有PCR产物均用AxyPrep DNA凝胶提取试剂盒纯化以及使用QuantiFluorTM-S进行定量。使用 NEB Next®UltraTMDNA Library Prep Kit 建库试剂盒构建文库,并通过Qubitt@ 2.0荧光仪和Bioanalyzer 2100进行评估,纯化和汇集扩增子文库在Illumina MiSeg平台上配对测序(2x300)。使用 UCHIME 软件去除嵌合体序列,抽平后运用UPARSE 软件RDP classifier 贝叶斯算法对97%相似水平的分类单元(operational taxonomic units,OTU)代表序列进行分类学分析,并在各个分类水平统计各样本的群落组成。
1.4.7 口服葡萄糖耐量测定
参照KO等[14]的方法进行口服葡萄糖耐量测定,即实验干预8周后,在小鼠禁食12 h后,口服葡萄糖(2 g/kg体重)。在葡萄糖负荷后0、30、60、90和120 min从小鼠尾部采集血样,并使用血糖仪测量血糖水平。计算随时间变化的曲线下面积(area under curve, AUC)。
1.4.8 血清生化指标的测定
采用高效液相色谱法测定血清中总胆固醇(total cholesterol, TC)、甘油三酯(triglyceride, TG)含量。色谱条件及实验方法参照文献[15]。
1.4.9 肝脏功能指标的测定
准确称取冻存的肝脏组织质量,加入9倍体积的生理盐水于冰水浴条件下匀浆机研磨,制成10%的肝脏匀浆,4 ℃、2 500 r/min离心10 min,取得的上清液再用生理盐水稀释成1%的肝脏匀浆。取上清液,严格按照试剂盒说明书分别测定SOD活力及MDA含量。
1.4.10 肝脏、小肠组织的HE染色
参考杨兴鑫等[16]的方法,分别取新鲜小鼠肝脏组织放入装有4%多聚甲醛的离心管中,充分固定24 h,用水冲洗后梯度乙醇脱水,二甲苯透明,进行石蜡包埋后,切成4 μm厚的薄片,HE染色。
1.4.11 肝脏组织的油红染色
参考文献[17],分别取小鼠肝脏组织的一小部分新鲜组织放入装有4%多聚甲醛的离心管中,新鲜冰冻切片充分固定后用自来水洗,切片入油红染液浸染8~10 min,60%异丙醇分化,浸入苏木素复染3~5 min,纯水浸洗,分化液分化2~8 s,返蓝液返蓝1 s,自来水中浸洗,甘油明胶封片剂封片,显微镜镜检。
1.5 统计分析
各组数据以平均值±标准差表示。采用R(V4.0.4)软件进行单因素方差分析,通过最小显著性差异事后检验比较样本差异,P<0.05表示差异显著,P<0.01表示差异极显著。对肠道菌群16S rRNA扩增原始数据进行去冗余处理,以97%相似度划分操作分类单元,并以此为基础进行物种组成及多样性分析。采用正则化典型相关分析方法分析高脂诱导肥胖小鼠体重、葡萄糖耐受量、血脂和氧化应激水平改善作用与肠道微生物改变之间的关联(运用R包“mixOmics”)。采用表达趋势聚类分析方法分析层次聚类PK和PK+IF干预方式对高脂饮食改变肠道菌群构成的不同变化趋势(运用R包“Mfuzz”)。
2 结果与分析
2.1 滇黄精水提物化学成分分析
滇黄精水提物多糖含量为69.71%,总酚含量为5.4%。基于LC-MS技术的代谢组学方法对样本进行了代谢轮廓变化分析,得到的典型总离子流色谱图(图1-a)。正离子模式下检测并鉴定出177种代谢物,负离子模式下鉴定出148种代谢物,主要包括糖类、酚类、脂肪酸类、氨基酸及其衍生物和有机酸类化合物。按照代谢物相对含量排序分别展示正负离子模式下含量较高的30种代谢物,结果如图1-b和图1-c所示。滇黄精水提物中富含半乳糖类非还原性功能性低聚糖,如棉子糖,水苏糖和异麦芽糖,是肠道双歧因子和多种益生菌的食物来源,有效促进乳酸杆菌和双歧杆菌增殖,抑制大肠杆菌和产气荚膜梭菌等有害菌的生长繁殖,改善肠道微生态平衡[18]。水苏糖通过调节肠道菌群改善肠道屏障完整性以及2型糖尿病糖代谢紊乱和肝脏炎症水平,具有益生元功能[19]。
滇黄精水提物中还富含氨基酸,如γ-氨基丁酸、苏氨酸、精氨酸、色氨酸、丝氨酸等。其中,γ-氨基丁酸在正离子检测模式中相对含量最高。γ-氨基丁酸是谷氨酸代谢的重要产物,广泛分布于如豆属、参属、中草药等的种子和根茎中,具有改善炎症、降血压、提高免疫力、增加脑部蛋白分泌等多种生理功能[20],机体内水平与宿主肠道内拟杆菌属丰度水平正相关。2009年我国批准γ-氨基丁酸为新资源食品。最新研究发现γ-氨基丁酸可通过刺激脂肪干细胞抑制肥胖者皮下脂肪炎症水平[21]。水提物中还富含具有多种生理功能且与肠道菌群关系密切的支链氨基酸[22]。尽管摄入的大部分蛋白质在小肠中被消化和吸收,根

a-总离子流图;b-正离子模式代谢物丰度;c-负离子模式代谢物丰度图1 滇黄精水提物总离子流图及正负离子模式检测丰度含量较高的30种代谢物Fig.1 TIC of Polygonatum kingianum water extract and top 30 metabolites identified with ESI+ and ESI- mode, respectively.Ranking was based on their relative intensities
据摄入量高低会有大量蛋白质和氨基酸(6~18 g/d)到达结肠部,并由一系列共生菌群降解。其中,色氨酸是人体必需氨基酸,其微生物代谢近年来受到广泛关注。肠道菌群代谢色氨酸产生一系列吲哚类代谢产物,可作为细胞间信号分子和芳烃受体配体,具有改善肠道免疫和代谢紊乱, 预防慢性代谢疾病等多种有益健康生物活性功能[23-25]。此外,滇黄精水提物中甜菜碱含量较高。最新研究发现,补充甜菜碱可以改善高脂饮食诱导的肠道菌群失调,促进艾克曼菌等具有益生活性的菌属增值,促产乙酸和丁酸通过调节宿主miR-378a-YY1通路,改善高脂饮食诱导的肥胖和代谢综合征[26]。综上,滇黄精水提物富含具有调节肠道菌群功效的益生活性物质,是滇黄精改善代谢有益健康的功效物质基础。
2.2 滇黄精水提物联合间歇性禁食对高脂小鼠体重、血糖、血脂和氧化应激水平的改善作用
如图2-a所示,IF与PK+IF对高脂饮食小鼠具有明显减重作用,且PK+IF更加显著。高脂饮食组小鼠空腹血糖普遍高于正常组(图2-c),但PK和PK+IF均未能显著降低空腹血糖水平。HF+PK组OGTT实验曲线下面积显著低于HF和HF+PK+IF组,表明PK与IF可显著增强高脂诱导肥胖小鼠葡萄糖耐受能力。

a-体重变化曲线;b-OGTT试验血糖变化曲线;c-干预后空腹血糖;d-OGTT试验曲线下面积图2 小鼠体重、葡萄糖耐量、空腹血糖值及曲线下面积变化Fig.2 Weight change、blood glucose change assessed by OGTT test、fasting blood glucose value after intervention area under OGTT test curve注:不同小写字母表示差异显著(下同)
各组小鼠TC、TG、MDA及SOD水平如图3所示。各组间血清TC含量无显著性差异(图3-a)。PK+IF与PK可降低高脂饮食带来的高血脂水平。与对照组相比,HF饮食显著升高肝脏MDA含量,说明体内代谢过程中产生的自由基引起了脂质过氧化反应。尽管PK和PK+IF未能显著降低HF引起的MDA升高(图3-c),但显著提升了肝脏中超氧歧化酶水平。

a-TC含量;b-TG含量;c-MDA含量;d-SOD含量图3 不同组别小鼠血清中TC、TG含量;肝脏中MDA及SOD含量Fig.3 Differences in serum levels of TC and TG, as well as MDA and SOD in livers between groups
2.3 滇黄精水提物联合间歇性禁食对小鼠肝脏组织形态学和功能指标的影响
2.3.1 肝脏HE染色、油红O染色结果
如图4-a所示,NC组肝细胞排列有序,大小相似,有少许空泡化,汇管区无变性或病变;NC+PK组与NC+PK+IF组相较于NC组肝脏病理形态接近正常组,无明显变化。HF组肝细胞变性,空泡化严重,肝细胞细胞核固缩变小且大量聚集,排列无序,有炎细胞浸润现象;滇黄精水提物干预后,肝细胞组织结构明显有所改善,但肝细胞大小不一,且仍有部分炎症细胞浸润;HF+PK+IF组肝细胞虽有部分炎症细胞浸润,但组织结构清晰,并且排列有序,改善效果最佳。由图4-b所示,NC 3组间脂滴未见明显变化。HF组脂滴大量堆积,出现微泡脂肪变性现象,饮食干预和联合干预后,脂滴均明显缩小和减少。以上结果表明,滇黄精水提物干预与其联合禁食干预对肝脏损伤具有修护作用,且滇黄精水提物联合禁食干预效果更好。

a-肝脏组织HE染色;b-肝脏组织油红O染色图4 小鼠肝脏组织HE染色及油红O染色结果Fig.4 HE staining and oil red O staining of liver tissues of mice
2.4 滇黄精水提物联合间歇性禁食对肠道菌群组成的影响
2.4.1 各组间肠道微生物多样性及组成分析
肠道菌群是居住在肠道中的微生物,与机体健康息息相关,不平衡的能量摄入如高脂肪摄入会导致肠道营养不良,从而引起胰岛素抵抗、2型糖尿病、非酒精性脂肪肝炎、肥胖和代谢紊乱等[27-28]。通过对粪便肠道菌群16S rRNA的V3~V4可变区进行双端测序,经DADA2方法去燥质控后,使用QIIME(version
1.8.0)软件中的UCLUST对Clean reads进行去嵌合体处理,再对去重复序列以97%的一致性将序列聚类成为OTUs,运用数据库Greengenes或SILVA对OTUs的代表序列进行物种注释,对所得OTUs进行生境多样性分析。结果表明,PK显著升高肠道菌群α多样性Shannon指数(图5-a,P<0.05),表明PK增加高脂喂养小鼠粪便微生物丰富度。
高脂饮食显著改变小鼠肠道菌群结构(图5)。在门水平上,与NC组相比,高脂饮食摄入增加小鼠肠道菌群中厚壁菌门(Firmicutes)相对丰度,降低拟杆菌门(Bacteroidetes)相对丰度,PK摄入显著升高高脂小鼠拟杆菌门和变形菌门(Proteobacteria),降低厚壁菌门与拟杆菌门丰度比值。厚壁菌门和拟杆菌门占据了整个肠道菌群的80%~90%,厚壁菌门和拟杆菌门的比值是反映肠菌紊乱的重要参数[29-30]。前期研究发现,与正常人群相比,肥胖患者肠道中厚壁菌门与拟杆菌门比值较高。在属水平上,与对照组相比,高脂饮食显著上调73个菌属,包括梭状芽胞杆菌

a-α多样性;b-Firmicutes丰度;c-Bacteroidates丰度;d-HF vs NC 差异肠道微生物火山图;e-典型相关分析热图图5 肠道菌群多样性,微生物相对丰度组间差异及其与生理指标典型相关关系Fig.5 Alpha diversity of gut microbiota community, differences in relative abundance of microorganisms between groups and their relationships with high-fat diet induced changes in biochemistry indexes
属(Clostridium_sensu_stricto_11, fold change=75.8),大肠杆菌志贺菌(Escherichia-Shigella, fold change=10.6),不动杆菌(Acinetobacter, fold change=8.4)和胃瘤球菌属(RuminococcaceaeUCG-004, fold change=5.4)等。已有研究发现,这些菌属与肥胖、炎症水平、糖脂代谢异常以及肝脏脂质异常积累和损伤正相关[29, 31];下调36个菌属的相对丰度,包括常见益生菌双歧杆菌属(Bifidobacterium, fold change=0.01),与宿主体内短链脂肪酸水平相关的拟普雷沃菌属(Alloprevotella, fold change=0.04)和普雷沃菌属(Prevotella, fold change=0.19)等[32-33]。
采用典型相关分析方法进一步建立高脂诱导肥胖小鼠体重、葡萄糖耐受量、血脂和氧化应激水平改善作用,与肠道微生物之间的紧密关联。结果显示,高脂饮食诱导的体重、TG、TC上调和SOD下调,与Escherichia-shigella、Acinetobacter、Clostridium_sensu_stricto_11、杜氏乳杆菌(Dubosiella)和Lachnoclostridium相对丰度的升高;Alloprevotella、Bifidobacterium、Ileibacterium、毛螺旋菌属(Parasutterella)、盐单胞菌属(Halomonas)和副拟杆菌属(Parabacteroides)的降低有关。这些结果进一步说明了滇黄精水提物联合间歇性禁食对高脂饮食引起的小鼠肥胖、糖脂代谢异常以及肝脏组织形态和功能的改善作用或可通过调控肠道菌群结构来实现。
采用模糊c均值聚类分析高脂喂养的3组小鼠粪便肠道菌属相对丰度,可得到3种不同趋势(图6)。
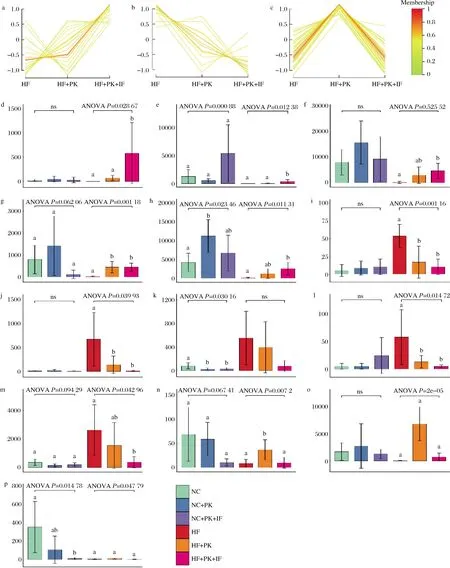
a-Cluster 1;b-Cluster 2;c-Cluster 3;d-g_Alloprevotella;e-g_Bifidobacterium;f-g_Ileibacterium;g-g_Parabacteroides;h-OTU_2;i-g_Acinetobacter;j-g _Clostridium.seneu.stricto.1;k-g_Dubosiella;l-g_Escherichia.Shigella;m-OTU_18;n-g_Butyricimonas;o-g_Desulfovibrio;p-OTU_51图6 高脂喂养小鼠肠道菌群丰度表达趋势聚类分析及属水平组间差异柱状图Fig.6 Clusters of gut microbiota compositions derived from the fuzzy c-means algorithm and histogram of differences between groups at the genus level
聚类1(cluster 1)包括相比于NC组,被HF显著降低丰度,却被PK+IF干预显著升高的菌属,例如Alloprevotella,Bifidobacterium,Ileibacterium和Parabacteroides。有趣的是,新近研究发现间歇性禁食模式显著改变小鼠肠道菌群结构,促进了肠内有益菌(如Alloprevotella,Bifidobacterium,和Parabacteroides)以及多种菌群代谢产物的生成,有效改善2型糖尿病小鼠的认知功能和糖脂代谢紊乱,首次揭示了肠道菌群及代谢产物在间歇性禁食模式改善糖尿病及认知损伤中的重要参与机制[34]。不仅如此,已有研究发现Alloprevotella相对丰度与心血管疾病风险显著负相关,在高心血管风险的患者体内基本不存在。大量研究表明Bifidobacterium和Parabacteroides对机体和肠道微生态具有有益作用。Bifidobacterium菌属的细菌是人和动物肠道菌群的重要组成成员之一,许多双歧杆菌的菌株,如青春双歧杆菌、乳双歧杆菌、动物双歧杆菌等可以作为益生菌用在食品和医药中,在改善代谢、减重、降脂降糖等方面有积极作用[35]。Parabacteroides等菌属丰度增加可提高结肠C18-3OH浓度从而产生抗炎功效[36]。相反,聚类2(cluster 2)包括相比于NC组,丰度被HF显著升高,却被PK和PK+IF干预显著降低的菌属,例如Acinetobacter,Clostridium_sensu_stricto_11,Dubosiella和Escherichia-shigella。文献研究表明,Acinetobacter菌属丰度在多发性硬化患者中显著增加,引发促炎症反应[37]。最新发表在Science Translational Medicine上的研究发现脂肪肝患者粪便中Clostridium_sensu_stricto_11菌属水平显著高于健康人群,采用甘氨酸干预可通过影响肠道微生物组成(包括显著降低Clostridium_sensu_stricto_11水平),调节脂肪酸氧化和谷胱甘肽合成,继而改善非酒精脂肪肝[38]。HUART等[39]在探究粪便短链脂肪酸水平与血压关系的研究中发现,未接受降压药治疗的33名受试者中,Clostridium_sensu_stricto_11菌属与血压成正相关。Escherichia-Shigella在二型糖尿病患者体内丰度增加[40],也是慢性腹泻的主要致病菌之一。聚类3(cluster 3)包括相比于NC组,被HF显著降低丰度,却仅被PK干预显著升高的菌属,例如肠道内参与丁酸产生的丁酸弧菌属(Butyricimonas)。表达趋势聚类分析结果表明,PK联合IF对有益菌增值和有害菌抑制有协同功效。此外,PK对肠道菌属的影响也可独立于间歇性禁食。
3 结论
本实验采用代谢组学技术分析滇黄精水提物化学成分,首次报道滇黄精水提物创新协同间歇性禁食模式通过改变肠道菌群构成改善高脂饮食诱导的肥胖和肝脏损伤健康作用。结果显示,滇黄精水提物(PK)富含棉子糖、水苏糖、异麦芽糖等功能性低聚糖,γ-氨基丁酸、精氨酸、色氨酸等氨基酸类,以及甜菜碱等具有调节肠道菌群功效的益生活性物质,是滇黄精改善代谢有益健康的功效物质基础。PK可预防高脂诱导小鼠肥胖,显著改善葡萄糖耐受力和肝脏中超氧化物歧化酶活力,降低血清甘油三酯,有效缓解由高脂诱发肝脏细胞变性和脂质积累异常。此外,PK摄入显著增加了高脂喂养小鼠肠道中的拟杆菌门,降低厚壁菌门与拟杆菌门丰度比值,同时降低梭状芽胞杆菌属,大肠杆菌志贺菌,不动杆菌和胃瘤球菌属等与肥胖、肝脏脂质异常积累和损伤相关的菌属;相反,升高促产短链脂肪酸的拟普雷沃菌属、普雷沃菌属、丁酸弧菌属,以及双歧杆菌,使肠道菌群结构向益生菌增殖的方向改变。不仅如此,PK和PK+IF对高脂诱导肥胖小鼠体重、葡萄糖耐受量、血脂和氧化应激水平具有改善作用,与其对肠道菌群的调节紧密关联。综上,滇黄精水提物富含多种益生营养物质,联合间歇性禁食可有效预防和改善高脂饮食引起的小鼠肥胖、糖脂代谢异常以及肝脏组织形态和功能,而这种改善效果与黄精和禁食模式对肠道菌群结构和功能的调控作用密切关联。研究揭示了滇黄精水提物的食用价值,为科学认知“辟谷养生”和以黄精为代表的“食药同源”天然资源预防肥胖及其相关代谢问题的有益健康作用提供科学参考。

