胃癌根治术后胃瘫的危险因素分析
张晨琛
·临床论著·
胃癌根治术后胃瘫的危险因素分析
张晨琛*
(河南科技大学第一附属医院胃肠外科,河南 洛阳 471000)
分析胃癌根治术后胃瘫的危险因素。回顾性分析2019年2月~2021年2月于我院实施胃癌根治术的98例胃癌患者的临床资料。所有患者根据接受胃癌根治术后是否发生胃瘫分为胃瘫组(n=12)和非胃瘫组(n=86)。对两组患者的临床资料进行单因素回归分析,将其中存在明显差异的指标进行非条件Logistic多元逐步回归分析。经单因素比较,两组患者性别、高血压、手术时间、术中出血量、肿瘤大小、病理分期、Borrmann分型、术后镇痛方式比较无明显差异(P>0.05);两组患者年龄、术前焦虑症、糖尿病、术前低蛋白、术前幽门梗阻、手术吻合方式比较存在明显差异(P<0.05)。经非条件Logistic多元逐步回归分析,年龄、糖尿病、术前低蛋白、术前幽门梗阻、手术吻合方式为影响胃癌根治术患者术后胃瘫的独立危险因素(P<0.05)。实施胃癌根治术患者发生术后胃瘫与年龄、糖尿病、术前低蛋白、术前幽门梗阻、手术吻合方式等因素密切相关,临床需针对以上因素进行合理干预,降低患者术后胃瘫发生风险。
胃癌根治术;胃瘫;危险因素;术前幽门梗阻
胃癌为临床常见消化道恶性肿瘤之一,发病率和病死率均较高,其5年相对生存期在20%左右,其发病原因受到多种因素影响,如不良饮食习惯、慢性胃炎等胃部疾病、幽门螺旋杆菌感染、遗传等,且疾病类型多样,临床常见胃癌类型如息肉样型、溃疡型等,胃癌根治术是目前临床治疗进展期且无全身转移胃癌的常用治疗方式,可全面清扫肿瘤组织,但由于胃部组织构造复杂,导致胃癌根治术手术难度大且术后胃瘫等并发症发生风险较高,影响患者预后[1]。
胃瘫是胃癌患者实施胃大部切除手术后继发非机械性梗阻等因素引起的胃动力紊乱疾病,其主要临床症状为胃蠕动减弱或消失、微盘控障碍、胃潴留、呕吐等,通常患者发病后其临床症状会持续数周甚至更长时间,严重影响患者术后消化道功能[2],因此对患者术后营养摄入造成障碍,影响术后恢复,并增加其他胃癌根治术后并发症发生风险。
患者发生术后胃瘫大多使用保守治疗,但由于部分患者临床症状为长时间呕吐、无法进食等,易误诊为胃出口机械性梗阻等疾病,导致治疗延误,且治疗效果并不理想,预后较差,因此需研究术后胃瘫发生的相关危险因素,并对应采取预防措施,降低胃瘫发生风险[3]。对此,本研究回顾性分析我院98例实施胃癌根治术患者的临床治疗,研究胃癌根治术后胃瘫的危险因素。
1 资料与方法
1.1 一般资料
回顾性分析2019年2月~2021年2月于我院实施胃癌根治术的98例胃癌患者的临床资料。所有患者根据接受胃癌根治术后是否发生胃瘫分为胃瘫组(n=12)和非胃瘫组(n=86)。
胃瘫组患者男6例,女6例;其中有高血压5例,无高血压7例;手术时间平均216.85±20.99 min;术中出血量平均269.74±23.71 mL;肿瘤大小≥5 cm 的6例,肿瘤大小<5 cm 的6例;病理分期:Ⅰ期4例,Ⅱ期6例,Ⅲ期2例;Borrmann分型:Ⅰ型3例,Ⅱ型2例,Ⅲ型4例,Ⅳ型3例;术后镇痛方式:阿片类药物4例,非甾体类药物8例。
非胃瘫组患者男42例,女44例;其中有高血压39例,无高血压47例;手术时间平均208.32±20.70 min;术中出血量平均258.66±24.05 mL;肿瘤大小≥5 cm 35例,肿瘤大小<5 cm 51例;病理分期:Ⅰ期27例,Ⅱ期41例,Ⅲ期18例;Borrmann分型:Ⅰ型21例,Ⅱ型20例,Ⅲ型22例,Ⅳ型23例;术后镇痛方式:阿片类药物31例,非甾体类药物55例。
两组患者一般资料差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准(伦理批号:2018审(031)号)。
纳入标准:确诊为胃癌并实施胃癌根治术;胃瘫组患者确诊为术后胃瘫[4];认知功能正常;临床资料完整;肿瘤无远端转移。排除标准:合并其他器官严重疾病者;合并其他原发性恶性肿瘤者;因出血等实施紧急手术者;联合其他组织切除术者。
1.2 资料收集
统计两组实施胃癌根治术胃癌患者性别、年龄、高血压、糖尿病、手术时间、术中出血量、肿瘤大小、病理分期、Borrmann分型、术前焦虑症、术前低蛋白、术前幽门梗阻、手术吻合方式、术后镇痛方式等临床资料。
1.3 观察指标
1.3.1 术后并发胃瘫的因素
将患者的年龄、糖尿病史、术前低蛋白、术前幽门梗阻、手术吻合方式情况信息与患者术后是否胃瘫进行单因素回归分析,其中P<0.05者被认为是术后并发胃瘫的因素。
1.3.2 术后胃瘫的独立危险因素
将单因素回归分析所得结果进行非条件Logistic多元逐步回归分析,存在显著性差异的指标即为术后胃瘫的独立危险因素。
1.4 统计学方法
2 结果
2.1 实施胃癌根治术患者术后并发胃瘫的单因素分析
经单因素比较,性别、高血压、手术时间、术中出血量、肿瘤大小、病理分期、Borrmann分型、术后镇痛方式不是影响胃癌根治术患者术后并发胃瘫的单因素(P>0.05)。年龄、糖尿病、术前焦虑症、术前低蛋白、术前幽门梗阻、手术吻合方式是影响胃癌根治术患者术后并发胃瘫的单因素(P<0.05)。见表1。
2.2 胃瘫的非条件Logistic多元逐步回归分析
经非条件Logistic多元逐步回归分析,年龄、糖尿病史、术前低蛋白、术前幽门梗阻、手术吻合方式为影响胃癌根治术患者术后胃瘫的独立危险因素(P<0.05)。见表2。
3 讨论
胃癌根治术是临床治疗胃癌的常用治疗手段,疗效确切,但患者术后胃瘫发生风险较高。术后胃瘫会引起患者呕吐、腹胀等症状,延长患者术后恢复时间,且暂无有效治疗手段,因此需研究胃癌根治术后胃瘫发生的相关危险因素[5],给予对应预防措施,降低胃瘫发生风险。
对于实施胃癌根治术的患者,术后胃瘫的相关临床症状会严重影响其术后进食、消化等,且会增加手术并发症发生风险,影响患者术后恢复时间,对于预防胃瘫形成,分析胃癌根治术患者术后胃瘫发生的危险因素至关重要[6]。本次研究结果中,经单因素比较,两组患者性别、高血压、手术时间、术中出血量、肿瘤大小、病理分期、Borrmann分型、术后镇痛方式比较无明显差异;两组患者年龄、糖尿病、术前焦虑症、术前低蛋白、术前幽门梗阻、手术吻合方式比较存在明显差异;经非条件Logistic多元逐步回归分析,年龄、糖尿病史、术前低蛋白、术前幽门梗阻、手术吻合方式为影响胃癌根治术患者术后胃瘫的独立危险因素。
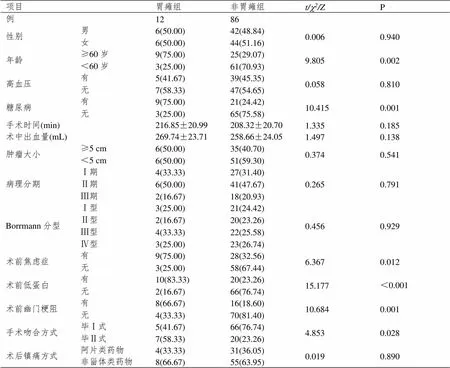
表1 实施胃癌根治术患者术后并发胃瘫的单因素分析
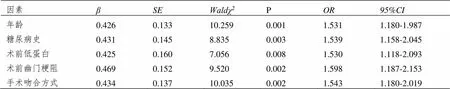
表2 胃瘫的非条件Logistic多元逐步回归分析
原因在于,高龄患者机体恢复能力和各项机能均显著下降,其肠胃蠕动功能、免疫能力等均显著下降,对于手术应激反应较严重,导致其胃癌根治术后发生胃瘫风险较高。高血糖可明显抑制胃动力,且血糖水平越高,抑制作用越明显[7]。白蛋白水平可反映患者机体营养状况,术前低蛋白说明胃癌根治术患者存在营养不良,影响其机体恢复能力,延缓胃部手术切口愈合,从而影响患者术后胃活动能力,引发胃瘫[8]。术前幽门梗阻患者术后更易发生胃肠壁水肿以及切口难以愈合,并阻碍胃蠕动,促使胃癌根治术患者发生术后胃瘫[9]。胃癌根治术患者常使用毕Ⅰ式、毕Ⅱ式实施手术吻合,而毕Ⅱ式的胃肠吻合方式破坏了机体消化道原有解剖结构,使胃蠕动失调,影响消化道激素分泌,从而降低患者胃排空功能,导致胃癌根治术后患者发生胃瘫[10]。
对于胃癌根治术后发生胃瘫,针对其相关危险因素给予预防措施比治疗更重要,对于年龄、糖尿病史、术前低蛋白、术前幽门梗阻、手术吻合方式等胃癌根治术后胃瘫发生的独立危险因素,临床需在术前监测患者血糖、蛋白水平,尽量改善患者营养不良状态,严格控制其血糖水平;对于术前幽门梗阻患者,术前即使用对应治疗手段,缓解幽门梗阻症状;在条件允许情况下,尽量使用毕Ⅰ式进行胃肠吻合,减少对其解剖结构的破坏,从而降低胃癌根治术患者术后胃瘫发生风险。
综上所述,年龄、糖尿病、术前低蛋白、术前幽门梗阻、手术吻合方式是胃癌根治术患者术后胃瘫发生的独立危险因素,临床可通过针对性干预以上危险因素有效降低患者术后胃瘫发生风险。
1 杨文艳,马艳梅,周立霞.老年胃癌根治术后患者发生胃瘫综合征的危险因素及预防研究[J].西北国防医学杂志,2019,40(11):672-676.
2 梁海,狄潘潘,贾淑云,等.胃癌患者术后胃瘫并发韦尼克脑病及糖代谢异常的药学监护1例[J].中国新药与临床杂志,2020,39(11):698-701.
3 曹李,田靖波,金露佳,等.远端胃癌行毕Ⅱ式+Braun式吻合术后胃瘫综合征的效果分析[J].中国普外基础与临床杂志,2020,27(6):747-750.
4 李峰,张霞,王波,等.胃手术后功能性胃排空障碍的诊断与处理[J].中华肿瘤防治杂志,2009,16(17):1359-1360.
5 江频,李栋梁,宋承鹏,等.根治性远端胃大部切除术后胃瘫发生的危险因素分析[J].安徽医学, 2019, 40(2): 144-147.
6 张昊龙,于镇滔,高子涵,等.胃癌术后胃瘫综合征患者相关危险因素及其临床治疗[J].吉林大学学报(医学版),2019,45(3):673-677.
7 张晶晶,徐钧,董永红.根治性远端胃切除术后发生胃瘫综合征危险因素的研究进展[J].肿瘤研究与临床,2018,30(5):351-354.
8 张鑫,王宝胜.胰十二指肠切除术后胃排空障碍的危险因素分析及治疗[J].中国医科大学学报, 2019, 48(6): 537-541.
9 王颖,牛丽霞,蒲春蕊.远端胃癌根治术后胃瘫危险因素分析[J].中华现代护理杂志,2018,24(23):2832-2834.
10 张强,侯栋升,姚立彬,等.胃癌患者根治性远端胃大部切除术后胃瘫综合征的相关因素及治疗方案[J].实用临床医药杂志,2018,22(7):53-56.
Analysis of risk factors of gastroparesis after radical gastrectomy
Zhang Chen-chen*
(Department of Gastrointestinal Surgery, The First Affiliated Hospital of Henan University of Science and Technology, Luoyang 471000, Henan, China)
To analyze the risk factors of gastroparesis after radical gastrectomy.The clinical data of 98 patients who underwent radical gastrectomy in the hospital were retrospectively analyzed between February 2019 and February 2021. Among the patients, 12 cases with gastroparesis after radical gastrectomy were included in gastroparesis group, and 86 cases without gastroparesis after radical gastrectomy were enrolled as non-gastroparesis group. The clinical data of the two groups were compared by univariate analysis, and unconditional Logistic multiple stepwise regression analysis was carried out for the indicators with significant differences.There were no significant differences in gender, hypertension, surgical time, intraoperative blood loss, tumor size, pathological stage, Borrmann classification and postoperative analgesia between the two groups of patients (P>0.05). There were significant differences in age, preoperative anxiety, diabetes mellitus, preoperative low protein, preoperative pyloric obstruction and surgical anastomosis method (P<0.05). Unconditional Logistic multiple stepwise regression analysis showed that age, diabetes mellitus, preoperative low protein, preoperative pyloric obstruction and surgical anastomosis were independent risk factors for postoperative gastroparesis in patients with radical gastrectomy (P<0.05).The occurrence of postoperative gastroparesis in patients undergoing radical gastrectomy is closely related to factors such as age, diabetes mellitus, preoperative low protein, preoperative pyloric obstruction and surgical anastomosis. It is necessary to perform rational intervention to the above factors so as to reduce the risk of postoperative gastroparesis.
Radical gastrectomy; Gastroparesis; Risk factors; Preoperative pyloric obstruction
张晨琛,女,住院医师,主要从事胃癌方面的临床工作,Email:Zhangcc06zcc@163.com。
(2022-2-11)

