吲哚菁绿荧光成像在腹腔镜肝脏肿瘤手术中的临床应用
奚士航,蒋亚琦,王小明
(皖南医学院第一附属医院弋矶山医院,安徽 芜湖 241001)
21世纪以来,吲哚菁绿荧光成像作为术中导航工具已经广泛应用于普外科手术中,如胃癌及乳腺癌患者前哨淋巴结的检查[1],然而,在肝胆外科中,很少有人注意到荧光成像在手术中的作用。随着肝切除技术的发展,尤其是腹腔镜下肝切除技术的广泛应用,其具有创伤小、术后恢复快等优点而逐渐成为主流术式,并且可行性及安全性已得到广泛认可[2]。但如何术中精准定位肿瘤位置及边界显得尤为重要,以往所采用的术中超声技术虽可定位肿瘤大概位置以保证行肝切除手术的切缘阴性,但不能做到实时监控肝肿瘤边界,每定位一次需要重复操作,较为费时费力,而吲哚菁绿荧光成像技术在手术过程中能够实时导航,并可能发现微小病灶,因此在肝切除术中指导肿瘤精准切除具有重要临床意义。
1 资料与方法
1.1 临床资料本研究纳入2019年1月至2020年12月我院肝胆外科收治的60例肝脏肿瘤患者,60例均优先在腹腔镜下使用吲哚菁绿荧光成像技术,其中男43例,女17例,平均年龄为(52.08±15.76)岁;术前存在肝炎病史者27例,肝硬化者14例;肝功能方面,术前平均AST(29.68±12.23)U·mL-1,ALT(27.21±7.24)U·mL-1,TB(14.62±6.39)μg·mL-1,DB(12.88±0.68)μg·mL-1,ALB(39.17±2.51)g·L-1,AFP(4.70±2.25)μg·mL-1;患者既往腹部手术史者7例;肝转移癌患者4例;ASA评级:Ⅰ级31例,Ⅱ级22例,Ⅲ级7例;肿瘤位置:S1 1例,S2 13例,S3 3例,S4 5例,S5 5例,S6 8例,S7 13例,S8 12例。
纳入标准:①年龄18~80岁;②原发性肝脏肿瘤,且无远处转移;③存在肝内转移或肝内多个病灶,术前评估为可切除且残肝体积足够;④全身一般条件可耐受手术。排除标准:年龄大于80岁、存在远处转移、残肝体积不足、肝肾功能差及对ICG过敏者等。
1.2 吲哚菁绿荧光成像方法术前:仔细评估患者肝功能状况,术前1~7天通过外周静脉注射吲哚菁绿,剂量为0.5 mg·kg-1,并记录下ICG注射总剂量及时间,同时完成ICG R15检测以评估患者肝功能;术中:根据术中荧光成像效果可适当追加ICG注射剂量,通过正显影法显示目标肝段,以指导完成肝肿瘤切除。
1.3 手术方法根据目标肿瘤荧光成像效果,结合肿瘤位置及大小,完成肝脏肿瘤切除,包括肝脏局部肿瘤切除、解剖性肝叶/肝段切除、规则性半肝切除等。
1.4 观察指标记录患者ICG注射时间及剂量、肿瘤位置及大小、手术方式、术后病理等信息。
1.5 统计学分析数据采用SPSS 20.0软件进行分析,计量资料以均数±标准差表示,采用独立样本t检验;计数资料以百分比表示,组间比较采用卡方检验或Fisher确切概率法检验。P<0.05为差异有统计学意义。
2 结 果
2.1 患者术后一般情况60例患者均成功施行手术切除,无围手术期死亡。其中局部切除者11例,规则性肝叶或肝段切除者35例,半肝切除者14例。因手术粘连、术中不可控制的出血及肿瘤侵犯等因素导致中转开腹者10例;患者平均手术时间(212.92±34.89)min,术中平均出血量为(351.08±87.26)mL,平均住院时间(9.80±2.38)天。术后病理统计,原发性肝细胞癌最常见,为33例,其次为肝胆管细胞癌14例,混合型2例,4例为肝转移癌患者,还有7例为其他类型,如肝血管瘤、FNH、肝错构瘤、弥漫大B淋巴瘤等。手术并发症:出血3例,胆漏10例,肝功能衰竭1例,切口感染2例。
2.2 术前ICG注射时间与显像效果60例患者术前全部常规行ICG R15检测以评估患者肝功能储备情况,由于肝硬化患者吲哚菁绿滞留率提高,因此我们按照有无肝硬化分别记录患者在术前1周内不同时间静脉注射ICG,并记录手术荧光效果,具体术前ICG注射时间与术中荧光效果见表1。
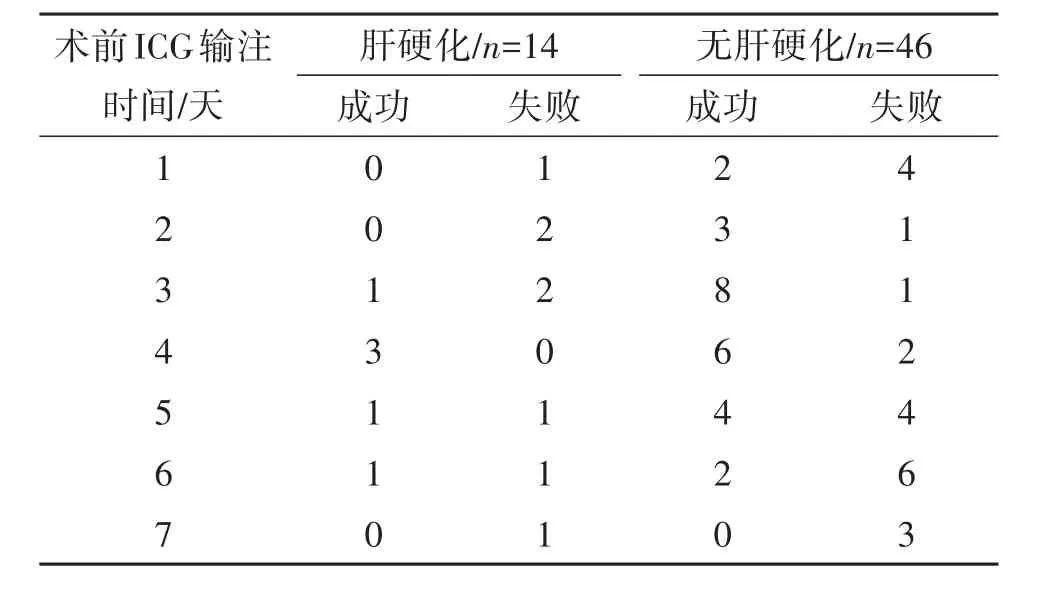
表1 术前ICG注射时间与荧光成像效果/例
2.3 术中ICG对肿瘤的识别作用及对肝切除的指导作用本研究60例患者,术前影像学检查接近肝表面的肿瘤43例,均能够在术中荧光腹腔镜下得到识别。同时,术中在普通白光下不能识别而切换至荧光染色模式发现的病灶结节共6枚,后经病理证实其中1枚病灶为癌结节(见图1)。另外,我们术中发现部分肝硬化结节病灶在荧光模式下也可成像。
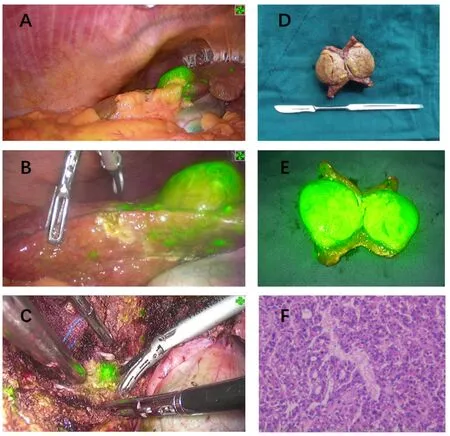
图1 肝肿瘤荧光成像效果
3 讨论
肝切除术已被公认为肝脏肿瘤的标准外科治疗方法,随着外科技术和医疗设备的进步,腹腔镜手术的适应证已扩展到大范围肝切除及更复杂的肝切除手术中[3]。然而,术前影像学检查,包括CT、MRI、超声等,对于肝脏微小病灶的检出率有限,即使结合术中超声检测,也很难检测出小于1 cm的病灶[4],而且术中无法实时动态监测肿瘤边界[5],达到实时引导切肝过程,因此存在一定的局限性。而吲哚菁绿荧光成像恰好能弥补上述缺点,因此在腹腔镜肝切除术中逐步应用。ICG静脉注射后可快速与血浆蛋白结合,可被波长750~810 nm的外来光激发,发射波长约为830 nm的近红外光,经特殊装置接收后可在显示屏上显示绿色或紫色荧光影像(根据使用设备决定),在肝切除手术中,可根据荧光成像实时确定肝切除线,并实时调整肝切除线。
ICG术前注射时间与术中成像效果密切相关,不同病理状态的肝脏亦与成像效果相关。ICG静脉注入体内后,立刻与血浆蛋白结合,并随血液循环迅速分布于全身血管内,然后高效率、选择性地被肝细胞摄取,又从肝细胞以游离形式排泄到胆汁中,经胆道入肠,随粪便排出体外。由于排泄快,一般正常人静脉注射20分钟后约有97%从血中排除,不参与体内化学反应,无肠肝循环(进入肠管的ICG不再吸收入血),无淋巴逆流,不从肾等其他肝外脏器排泄[6]。本次研究中,我们发现术前过早或过晚注射ICG均会对显像效果产生影响。如注射间隔时间过长,ICG在体内代谢过多而致肿瘤显影欠佳甚至不能显影成像;如注射间隔时间过短,因肝脏背景荧光颜色过深,与病灶间无法区分而导致术中荧光定位失败。另外,我们还要关注肝脏本身病理状态所产生的影响,最常见的是肝硬化带来的影响。从研究结果中不难发现,无肝硬化患者在注射后2~4天显影成功率较高;而肝硬化患者一般则需3天以后显影效果较佳,原因就是肝硬化病理状态下会延缓ICG的摄取和代谢速度,从而给显影效果带来影响。如术中显影效果不满意,可临时外周静脉追加注射ICG,一般数分钟后即可达到成像效果[7]。
在本研究中,我们发现在腹腔镜肝切除术中ICG荧光成像能够高度敏感地显示肝脏肿瘤、节段边界和胆汁泄漏[8]。腹腔镜肝切除术中,融合ICG荧光成像能够在白光彩色图像上实时显示假彩色荧光信号,可实时提供关于肿瘤位置、节段边界和胆管解剖位置[9],肿瘤组织由于较正常肝脏组织摄取ICG速度慢,使肿瘤组织与正常肝组织存在明暗界限而确定边界;另外,利用ICG经胆道排泄这一原理,对术中可疑胆漏处可以通过荧光染色敏感地发现,MARINO M V等[10]报道ICG荧光成像引导下的肝切除可降低术后胆漏发生率。结果表明,ICG荧光成像为外科医生提供了一种简单有效的导航工具,克服了腹腔镜肝切除术术中诊断的不足。当然,ICG荧光成像仍然存在不足之处,如对肝硬化结节、小囊肿等,尚不能明确区分,存在一定的假阳性率[11];同时,ICG荧光成像在识别深部肿瘤方面尚有局限性,国外有研究报道称,ICG荧光仅能探测到5~10 mm深度的肿瘤[12],国内亦有研究表明,ICG荧光确实能够良好地显示浅表肝脏肿瘤,而对大于9 mm深度的肝脏肿瘤无法探测[13],因此在肝脏手术中,我们应将ICG结合术中超声检查进行检测[14],充分发挥各自优势,最大化帮助指导手术进程。
总之,通过本研究并结合其他研究成果,我们不难发现吲哚菁绿荧光成像可以明确肿瘤位置与大小,尤其在术中定位肿瘤边界并保证合适切缘具有较高的临床应用价值;同时,吲哚菁绿荧光成像能够发现术前CT等影像学不易发现的微小病灶。因此,在腹腔镜肝切除手术中,我们应利用荧光成像的优势,并结合术中超声等其他手段,共同指导肝脏肿瘤切除。

