基于miR-34a/Notch 信号通路研究补肺益肾方对慢性阻塞性肺疾病大鼠模型免疫失衡和炎症反应的影响①
栾 英 李敬蕊 刘林林 高春燕 张菊香 王 晶 崔朝勃
(河北省衡水市哈励逊国际和平医院,衡水市人民医院,衡水 053000)
慢性阻塞性肺疾病(chronic obstructive pulmo⁃nary disease,COPD)是临床常见的呼吸及气流受限的一种气道及肺部慢性炎症性疾病[1]。COPD 因具有较高的发病率及病死率而受到世界公共卫生组织的重视[2]。目前研究发现机体免疫功能失衡及肺部和气道炎症反应是导致COPD 患者肺泡破坏、肺组织损伤甚至死亡的主要原因[3]。果蝇双翅边缘缺刻同源基因(drosophila double-wing margin nicked homologous gene,Notch)可调控细胞炎症、凋亡等生理活动而参与多种疾病的生理过程,且已有报道发现,COPD 过程中,巨噬细胞激活Notch 信号通路介导的炎症及免疫反应失衡与COPD 肺组织及气道炎症损伤关系密切[4-5]。大量研究证实Notch 是微小RNA-34a(microRNA-34a,miR-34a)的 靶 蛋 白,且miR-34a 可靶向抑制Notch 表达来调控细胞炎症及凋亡 过程[6-7]。但miR-34a 是否参与COPD 病理过程,研究较少。过往研究发现,补肺益肾方(Bufei Yishen Fang,BYF)可通过降低炎症反应、抗氧化应激、调节机体免疫等来缓解COPD 患者临床症状及炎症反应[8-9]。但BYF 的具体分子生物学机制还不甚明确。本研究建立大鼠COPD 模型,从miR-34a/Notch 轴探究BYF 改善COPD 大鼠炎症及免疫失衡的机制,以期阐明BYF 治疗COPD 的可能机制,为BYF的开发应用及国际化进程提供理论依据。
1 材料与方法
1.1 材料
1.1.1 动物 清洁级SD 雄性大鼠72 只,6~7 周龄,体质量200~220 g,购自河南襄城县隆瑞实验动物有限公司,生产许可证号为SYXK(豫)2020-0010;使用许可证号:SCXK(豫)2020-0001。所有大鼠于哈励逊国际和平医院动物房中常规饲养。本试验符合3R原则,且经哈励逊国际和平医院伦理委员会批准。
1.1.2 主要试剂及仪器 肺炎克雷伯杆菌(北京索莱宝科技有限公司,货号:LA9000);Notch 通路激活剂(Jagged1,美国Systems公司,货号:HY-P1846);Notch、IL-17、IL-6、辅助性T 细胞17(Th17)转录因子(RoRγt)、调节性T 细胞(Treg)转录因子(Foxp3)及β-actin抗体(美国Abcam公司,货号分别为:ab167441、ab193955、ab271270、ab113434、ab215206、ab8226);苏木素-伊红(HE)染色试剂盒(上海爱必信生物科技有限公司,货号:abs9217);RT-qPCR 试剂盒、Trizol 试剂盒(美国赛默飞公司,货号:AB4106A、12183555);RIPA 裂解液、BCA 试剂盒(北京索莱宝科技有限公司,货号R0010-20、PC0020);血液分析系统(德国西门子公司,型号:ADVIA 2120i);流式细胞仪(美国BD 公司,型号BD001);动物肺功能分析系统(加拿大SCIREQ公司,型号FLEXIVENT)等。
1.2 方法
1.2.1 大鼠COPD 模型的建立及分组给药 取SD大鼠参照文献[8]暴露于香烟[烟雾体积分数:(3 000±500)ml/m3]条件下12 周,2 次/d,6 d/周,并用肺炎克雷伯杆菌(0.1 ml)滴鼻8 周,5 d/次建立COPD 模型。参照文献[10]观察大鼠一般行为,若大鼠出现呼吸急促、喘息、腹式呼吸、鼻头发绀或分泌物增多现象,视为造模成功。将造模成功的60只大鼠分为模型组、BYF(3.7 g/kg)组、miR-34a低表达(miR-34a antagomir,4 nmol/kg)组、BYF+miR-34a antagomir(3.7 g/kg+4 nmol/kg)组、miR-34a低表达阴性对照(antagomir-NC)组,每组12只。另取12只SD大鼠不做任何处理,作为正常对照组。各组大鼠均于第9 周开始给药,BYF 组参照文献[8]设置剂量,用生理盐水稀释为浓度为0.37 g/ml 的混悬液并按10 ml/kg 的体积灌胃给药,2 次/d;miR-34a antagomir及antagomir-NC 参照文献[11]用生理盐水稀释成终浓度为1 nmol/50 µl 混悬液,按200 µl/kg 的体积经尾静脉注射给药,每周1 次;BYF+miR-34a antagomir组灌胃给予BYF 并经尾静脉注射给予miR-34a antagomir;正常对照组及模型组给予等量生理盐水。连续给药12周。
1.2.2 大鼠行为学观察 于给药期间观察各组大鼠行为学变化。
1.2.3 大鼠肺功能检测 末次给药12 h 后,用动物肺功能分析系统检测大鼠肺功能指标,包括用力肺活量(FVC)、第0.3 秒用力呼气容积(FEV0.3)、肺阻力(R)、肺顺应性(Cdyn)变化。
1.2.4 流式细胞仪检测外周血中T 淋巴细胞亚群(CD4+T、CD8+T、Th17/Treg)水平 各组大鼠在做完肺功能检测后,麻醉,取腹主动脉血6 ml,迅速放入抗凝管和促凝管中,12 h 内用流式细胞仪检测血CD4+、CD8+T 淋巴细胞数量,并计算CD4+/CD8+。制备含有1×106个/ml的单细胞悬液,用FITC+CD4 抗体染色后,固定,用0.1%非离子表面活性剂-聚乙二醇辛基苯基醚(Triton)渗透,并用PE+Foxp3和PE+IL-17抗体染色,检测CD4+IL-17、CD4+Foxp3 表达,并以CD4+IL-17/CD4+Foxp3比例代表Th17/Treg平衡状态。
1.2.5 血液分析系统检测肺泡灌洗液中白细胞、淋巴细胞和巨噬细胞数量 各组大鼠麻醉取血后,处死,结扎右肺,用冰生理盐水2 ml 对左肺叶进行灌洗,取灌洗液用血液分析系统检测白细胞、淋巴细胞和巨噬细胞数量。
1.2.6 HE 染色检测肺组织病理变化 取右肺组织,剪取部分组织置于-80 ℃冰箱保存,其余组织迅速置于4%多聚甲醛中固定24 h 后,进行常规透明、浸蜡、包埋后切成5 µm 切片,按HE 试剂盒说明书进行染色,封片后置于显微镜下观察肺组织病理变化。
1.2.7 qRT-PCR 检测大鼠肺组织miR-34a、Notch mRNA 相对表达水平 取1.2.6 中-80 ℃冰箱保存的组织在4 ℃冰箱中解冻后,用Trizol 抽提取总RNA,以总RNA为模板,反转录cDNA。取cDNA,按RT-qPCR 试剂盒(SYBR Green)说明书和PCR 仪进行扩增,共进行40 个循环:95℃120 s(1 个循环),95 ℃30 s、55~60 ℃30 s、72 ℃30 s(40 个循环),72 ℃300 s(1 个循环)后终止反应。miR-34a 以U6为内参,Notch mRNA 以β-actin 为内参基因,采用2-ΔΔCt算法计算miR-34a、Notch mRNA相对表达水平。引物由生工生物工程(上海)股份有限公司合成,引物设计见表1。

表1 RT-qPCR引物序列Tab.1 Primer sequence of RT-qPCR
1.2.8 Western blot 法 检 测 肺 组 织Notch、IL-17、IL-6、RoRγt、Foxp3 蛋白相对表达水平 取1.2.6 中-80 ℃冰箱保存的组织100 mg,在4 ℃冰箱中解冻后,加入RIPA 裂解液匀浆、离心分离后,取上清液用BCA 试剂盒测定蛋白浓度,取50 µg 蛋白进行电泳、转膜反应,5%牛血清蛋白于室温下封闭1 h 后,加入兔一抗[Notch、IL-17、IL-6、RoRγt、Foxp3(稀释倍数1∶2 000)、β-actin内参抗体(稀释倍数1∶1 000)],4 ℃摇床孵育过夜并加入羊抗兔二抗(稀释倍数1∶2 000)在37 ℃条件下孵育1 h 后,用增强化学发光法显色,以化学发光仪观察条带并拍照,并以Image J软件分析各组蛋白相对表达水平。
1.3 统计学分析 以SPSS22.0软件对实验数据进行统计分析,计量资料以±s表示,多组间比较进行单因素方差分析,进一步两组间比较行SNK-q检验,P<0.05表示差异有统计学意义。
2 结果
2.1 BYF 对大鼠行为变化的影响 正常对照组大鼠行为及饮食活动正常,无死亡。模型组大鼠毛发逐渐枯槁、饮水增加但活动减少,形体消瘦,由烦躁不安逐渐变为精神萎靡、呼吸急促、喘息、鼻头发绀且分泌物增多,且有2只死亡。BYF 组大鼠无死亡,呼吸喘促等上述症状最轻。miR-34a antagomir 组大鼠有4 只死亡,且上述行为症状进一步加重。antagomir-NC 组、BYF+miR-34a antagomir 组大鼠有2只死亡,行为变化与模型组相似。
2.2 BYF 对大鼠肺功能的影响 与正常对照组相比,模型组大鼠FVC、FEV0.3、Cdyn 降低(P<0.05),R 升高(P<0.05),预示肺功能降低。与模型组相比,BYF 组大鼠肺功能升高(P<0.05)。miR-34a antagomir 组大鼠肺功能进一步降低(P<0.05)。BYF+miR-34a antagomir 组上述指标与BYF 组相反(P<0.05)。antagomir-NC 组与模型组相比差异无统计学意义(P>0.05),见表2。
表2 各组大鼠肺功能指标比较(±s)Tab.2 Comparison of pulmonary function indexes of rats in each group(±s)

表2 各组大鼠肺功能指标比较(±s)Tab.2 Comparison of pulmonary function indexes of rats in each group(±s)
Note:Compared with normal control group,1)P<0.05;compared with model group,2)P<0.05;compared with BYF group,3)P<0.05.
R/(ml·cm H2O-1)0.22±0.02 0.49±0.041)0.33±0.051)2)0.61±0.051)2)0.48±0.041)3)0.47±0.041)3)Groups Normal control Model BYF miR-34a antagomir BYF+miR-34a antagomir antagomir-NC n 12 10 12 8 10 10 FVC/ml 7.38±0.50 5.19±0.441)6.71±0.491)2)4.11±0.321)2)5.12±0.431)3)5.16±0.401)3)FEV0.3/ml 5.78±0.40 3.19±0.221)4.53±0.391)2)2.26±0.121)2)3.16±0.221)3)3.17±0.201)3)Cdyn/(ml·cm H2O-1)0.78±0.04 0.39±0.021)0.53±0.051)2)0.21±0.021)2)0.36±0.021)3)0.38±0.031)3)
2.3 BYF 对大鼠肺组织病理变化的影响 正常对照组肺泡结构正常,模型组大鼠肺泡壁断裂、融合、气管壁增厚及管壁周围结缔组织增生、炎症细胞浸润严重;BYF 组大鼠肺泡壁几乎未见融合断裂现象,管壁炎症细胞浸润较少;miR-34a antagomir 组大鼠肺泡断裂融合及炎症细胞浸润最严重;BYF+miR-34a antagomir 组及antagomir-NC 组肺组织上述病理损伤程度与模型组相近,见图1。
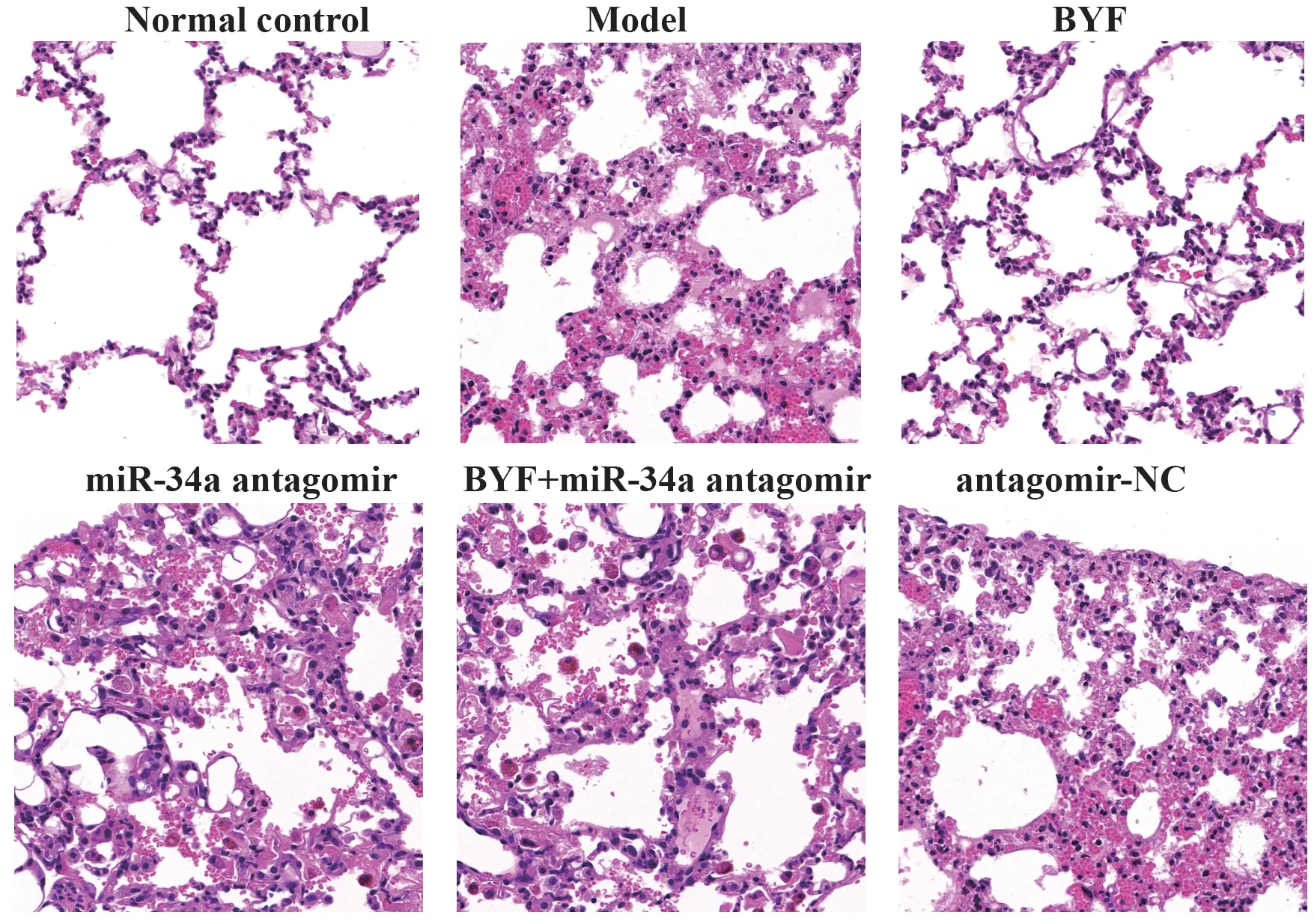
图1 大鼠肺组织HE染色图(×400)Fig.1 HE staining of rat lung tissue(×400)
2.4 BYF 对大鼠肺组织miR-34a、Notch mRNA 表达的影响 与正常对照组相比,模型组大鼠肺组织Notch mRNA 表达升高(P<0.05),miR-34a 表达降低(P<0.05)。与 模 型 组 相 比,BYF 组 大 鼠Notch mRNA 表达降低(P<0.05),miR-34a 表达升高(P<0.05);miR-34a antagomir 组上述指标变化趋势与模型组一致(P<0.05)。BYF+miR-34a antagomir 组上述指标变化与BYF 组相反(P<0.05)。antagomir-NC组与模型组相比差异无统计学意义(P>0.05),见表3。
表3 各组大鼠肺组织miR-34a、Notch mRNA 表达水平比较(±s)Tab.3 Expression levels of miR-34a and Notch mRNA in lung tissue of rats in each group(±s)
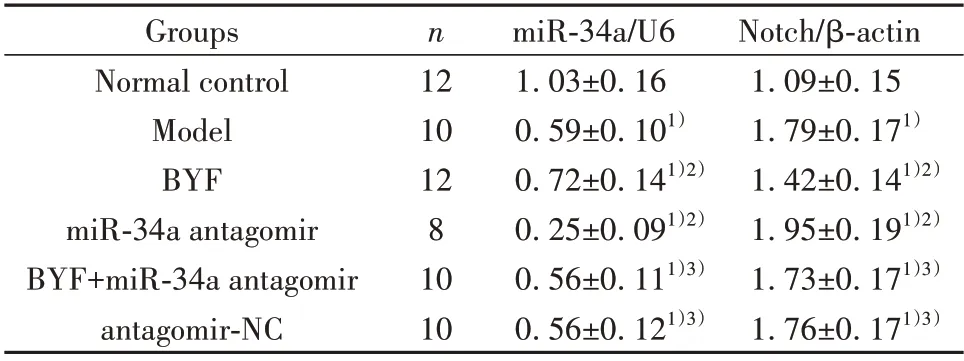
表3 各组大鼠肺组织miR-34a、Notch mRNA 表达水平比较(±s)Tab.3 Expression levels of miR-34a and Notch mRNA in lung tissue of rats in each group(±s)
Note:Compared with normal control group,1)P<0.05;compared with model group,2)P<0.05;compared with BYF group,3)P<0.05.
Notch/β-actin 1.09±0.15 1.79±0.171)1.42±0.141)2)1.95±0.191)2)1.73±0.171)3)1.76±0.171)3)Groups Normal control Model BYF miR-34a antagomir BYF+miR-34a antagomir antagomir-NC n 12 10 12 8 10 10 miR-34a/U6 1.03±0.16 0.59±0.101)0.72±0.141)2)0.25±0.091)2)0.56±0.111)3)0.56±0.121)3)
2.5 BYF 对大鼠肺泡灌洗液炎症细胞的影响 与正常对照组相比,模型组大鼠肺泡灌洗液白细胞、淋巴细胞和巨噬细胞等炎症细胞数量升高(P<0.05)。与模型组相比,BYF 组大鼠炎症细胞数量降低(P<0.05);miR-34a antagomir 组大鼠炎症细胞数量进一步升高(P<0.05)。BYF+miR-34a antagomir 组上述指标变化与BYF 组相反(P<0.05),antagomir-NC 组与模型组相比差异无统计学意义(P>0.05),见表4。
表4 各组大鼠肺泡灌洗液炎症细胞数量比较(±s,1×106 个/L)Tab.4 Comparison of inflammatory cells in BALF of rats in each group(±s,1×106 cells/L)
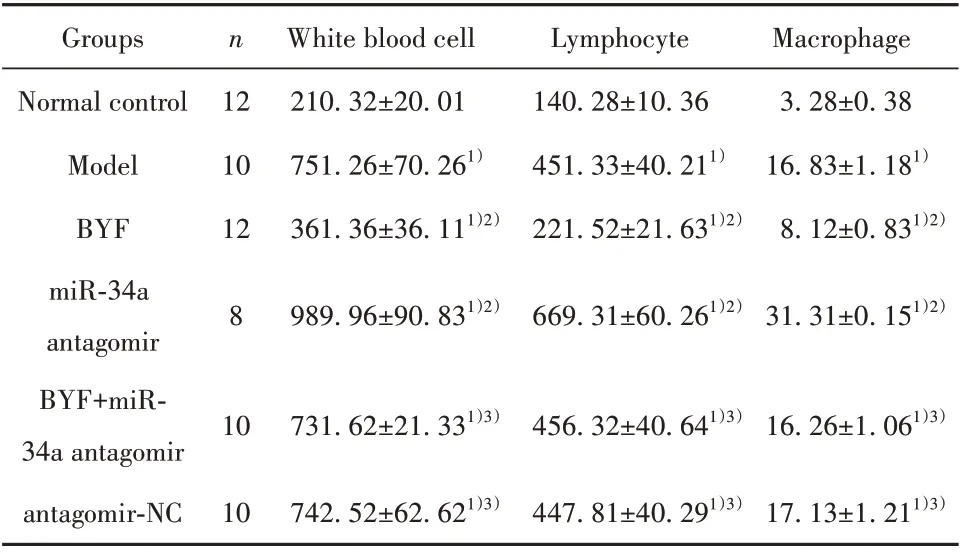
表4 各组大鼠肺泡灌洗液炎症细胞数量比较(±s,1×106 个/L)Tab.4 Comparison of inflammatory cells in BALF of rats in each group(±s,1×106 cells/L)
Note:Compared with normal control group,1)P<0.05;compared withmodel group,2)P<0.05;compared with BYF group,3)P<0.05.
Groups Normal control Model BYF miR-34a antagomir BYF+miR-34a antagomir antagomir-NC n 12 10 12 White blood cell 210.32±20.01 751.26±70.261)361.36±36.111)2)Lymphocyte 140.28±10.36 451.33±40.211)221.52±21.631)2)Macrophage 3.28±0.38 16.83±1.181)8.12±0.831)2)8 989.96±90.831)2)669.31±60.261)2)31.31±0.151)2)10 731.62±21.331)3)456.32±40.641)3)16.26±1.061)3)17.13±1.211)3)10 742.52±62.621)3)447.81±40.291)3)
2.6 BYF 对大鼠免疫功能的影响 与正常对照组相比,模型组大鼠CD8+/CD4+、Th17/Treg 升高(P<0.05),预示免疫功能失衡。与模型组相比,BYF组大鼠免疫功能趋于正常(P<0.05);miR-34a antagomir组大鼠免疫功能进一步失衡(P<0.05)。BYF+miR-34a antagomir 组上述指标变化与BYF 组相反(P<0.05),antagomir-NC 组与模型组相比差异无统计学意义(P>0.05),见表5。
表5 各组大鼠免疫功能比较(±s)Tab.5 Comparison of immune function of rats in each group(±s)
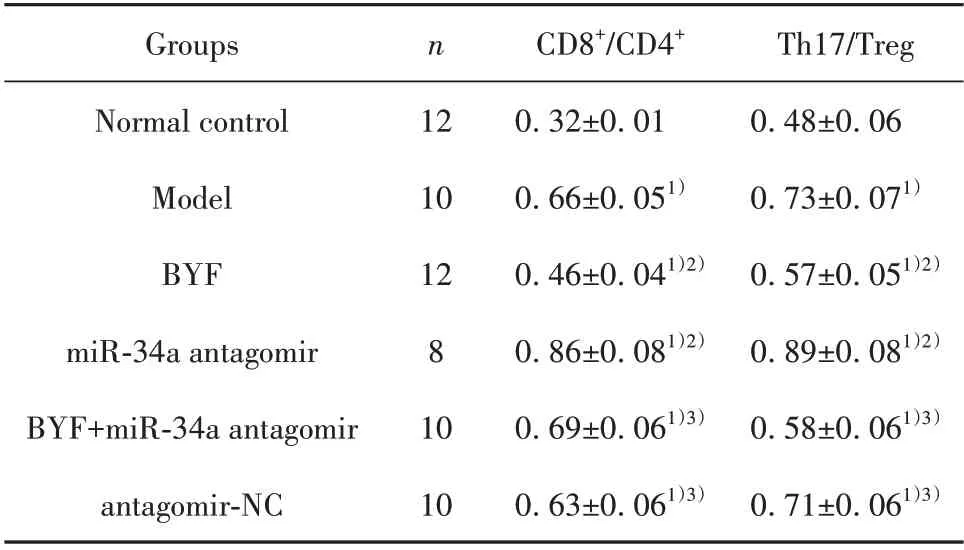
表5 各组大鼠免疫功能比较(±s)Tab.5 Comparison of immune function of rats in each group(±s)
Note:Compared with normal control group,1)P<0.05;compared with model group,2)P<0.05;compared with BYF group,3)P<0.05.
CD8+/CD4+0.32±0.01 0.66±0.051)0.46±0.041)2)0.86±0.081)2)0.69±0.061)3)0.63±0.061)3)Th17/Treg 0.48±0.06 0.73±0.071)0.57±0.051)2)0.89±0.081)2)0.58±0.061)3)0.71±0.061)3)Groups Normal control Model BYF miR-34a antagomir BYF+miR-34a antagomir antagomir-NC n 12 10 12 8 10 10
2.7 BYF 对大鼠肺组织Notch、IL-17、IL-6、RoRγt、Foxp3 蛋白表达的影响 与正常对照组相比,模型组 大 鼠 肺 组 织Notch、IL-17、IL-6、RoRγt、Foxp3、RoRγt/Foxp3 蛋白表达升高(P<0.05)。与模型组相比,BYF 组大鼠肺组织Notch、IL-17、IL-6、RoRγt、Foxp3、RoRγt/Foxp3 蛋白表达降低(P<0.05);miR-34a antagomir 组大鼠上述蛋白表达进一步升高(P<0.05)。BYF+miR-34a antagomir 组上述指标变化与BYF 组相反(P<0.05),antagomir-NC 组与模型组相比差异无统计学意义(P>0.05),见表6,图2。

图2 各组大鼠肺组织Notch、IL-17、IL-6、RoRγt、Foxp3蛋白表达免疫印迹图Fig.2 Western blot of Notch,IL-17,IL-6,RoRγt and Foxp3 protein expressions in lung tissue of rats in each group
表6 各组大鼠肺组织Notch、IL-17、IL-6、RoRγt、Foxp3蛋白表达比较(±s)Tab.6 Comparison of Notch,IL-17,IL-6,RoRγt and Foxp3 protein expressions in lung tissue of rats in each group(±s)
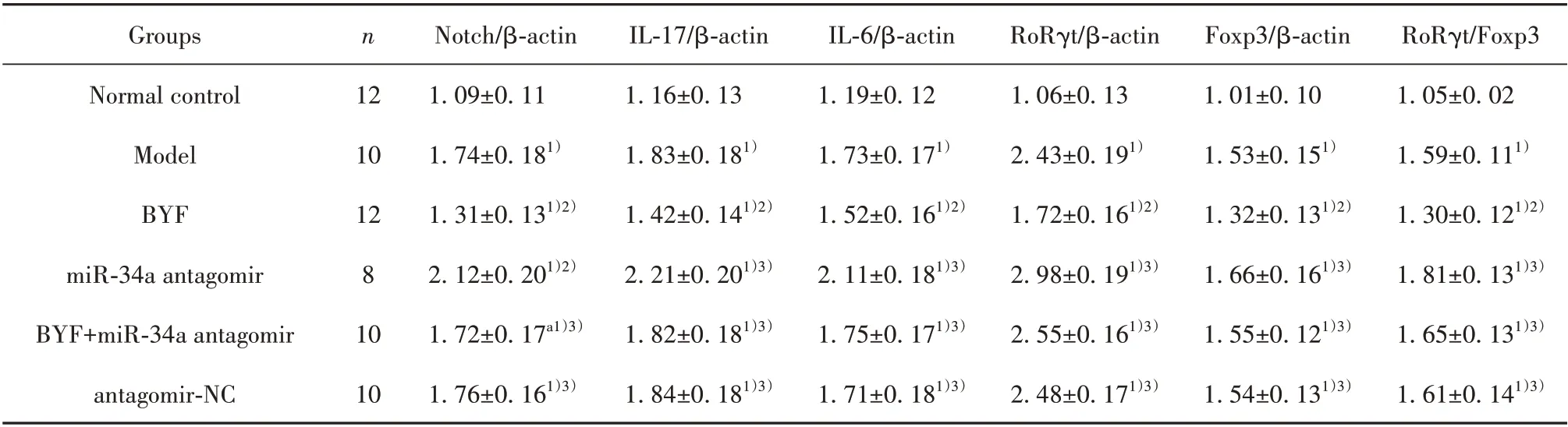
表6 各组大鼠肺组织Notch、IL-17、IL-6、RoRγt、Foxp3蛋白表达比较(±s)Tab.6 Comparison of Notch,IL-17,IL-6,RoRγt and Foxp3 protein expressions in lung tissue of rats in each group(±s)
Note:Compared with normal control group,1)P<0.05;compared with model group,2)P<0.05;compared with BYF group,3)P<0.05.
RoRγt/Foxp3 1.05±0.02 1.59±0.111)1.30±0.121)2)1.81±0.131)3)1.65±0.131)3)1.61±0.141)3)Groups Normal control Model BYF miR-34a antagomir BYF+miR-34a antagomir antagomir-NC n 12 10 12 8 10 10 Notch/β-actin 1.09±0.11 1.74±0.181)1.31±0.131)2)2.12±0.201)2)1.72±0.17a1)3)1.76±0.161)3)IL-17/β-actin 1.16±0.13 1.83±0.181)1.42±0.141)2)2.21±0.201)3)1.82±0.181)3)1.84±0.181)3)IL-6/β-actin 1.19±0.12 1.73±0.171)1.52±0.161)2)2.11±0.181)3)1.75±0.171)3)1.71±0.181)3)RoRγt/β-actin 1.06±0.13 2.43±0.191)1.72±0.161)2)2.98±0.191)3)2.55±0.161)3)2.48±0.171)3)Foxp3/β-actin 1.01±0.10 1.53±0.151)1.32±0.131)2)1.66±0.161)3)1.55±0.121)3)1.54±0.131)3)
3 讨论
据世界流行病学分析,COPD 病死率已位于世界第4 位,中国COPD 患者已达1 亿,且40 岁以上COPD 患者高达13.7%[12]。COPD 发病机制复杂且不明确,目前认为吸烟、环境污染、气道感染等是造成COPD 肺不可逆损伤的主要因素[13]。大鼠暴露于烟熏下2 个月,可模拟人类COPD 病理生理特征[14]。本研究用烟熏+细菌感染的方法刺激大鼠2个月后,发现大鼠出现死亡、呼吸急促、喘息及饮食活动量减少等症状,肺部解剖发现肺泡融合、间隔断裂及破坏等与文献[14]相似的病理症状,提示造模成功。中医药治疗COPD 治则丰富、疗效确切、毒副作用少[15]。田燕歌等[8]发现中医药经典方—BYF 可改善COPD 肺泡结构损伤。本研究发现BYF干预治疗COPD 大鼠后,大鼠死亡、呼吸急促等症状及肺泡结构损伤显著缓解,证实BYF 可能为治疗COPD 的潜在药物。但其分子及基因调控机制还不甚明确,本研究对此进行继续探究。
免疫功能失衡及炎症反应,是引起COPD 患者呼吸气流受限、肺功能下降、肺组织炎症损伤的重要因素[16]。曹玉雪等[17]发现COPD 患者外周血及小气道中T淋巴细胞数量与气流受限及炎症反应的严重程度成正比,且T 淋巴细胞中的CD8+T 亚型可使肺组织中巨噬及中性粒等细胞聚集,导致肺泡破裂及肺部弹力组织破坏。WANG 等[18]在COPD 患者外周血中,检测到可引起炎症细胞迁移而发挥促炎效应的Th17 细胞增多,而具有抑制炎症反应、维持免疫平衡的Treg细胞减少,并认为Treg与Th17细胞比例失衡,可能与COPD 患者肺功能降低及恶化关系密切。本研究也检测到COPD 大鼠肺功能降低,肺泡灌洗液炎症细胞数量及肺组织IL-6、TNF-α 分泌显著高于正常对照组,能反映免疫功能的CD8+/CD4+、Th17/Treg、RORγt/FOXP3也显著升高,提示模型组大鼠出现肺功能下降、免疫功能下降、肺组织炎症损伤现象。ZHAO 等[9]发现BYF 可通过调节Th17/Treg 比例,改善免疫功能紊乱现象。本研究发现COPD 大鼠经BYF 治疗后,肺功能和免疫功能得以改善,肺组织炎症损伤得到缓解,提示BYF 治疗COPD作用,可能与调节免疫、降低炎症反应有关。
Notch 通路可介导炎症及免疫反应,参与COPD疾病发展进程。林德华等[19]认为抑制Notch信号通路表达,可改善COPD 免疫紊乱和炎症损伤;QIU 等[20]发现抑制COPD 患者Notch 途径,可减缓COPD 炎症损伤、阻断肺泡细胞凋亡。本研究也检测到COPD大鼠肺组织中Notch mRNA 及蛋白表达均显著高于正常对照组,提示Notch 通路激活可能是引起COPD大鼠免疫失衡及肺组织炎症损伤的关键通路。VALCOURT 等[6]用双荧光素酶实验证实miR-34a 可靶 向 负 调 控Notch。VELASCO-TORRES 等[21]在COPD 女性患者血清中检测到miR-34a 表达下调及Notch 浓度升高,提示miR-34a 下调可能参与COPD病理过程。本研究发现COPD 大鼠肺组织miR-34a表达降低,进一步抑制miR-34a 后,大鼠Notch 介导的炎症损伤及免疫反应途径也进一步加重,提示miR-34a缺失,Notch 表达上调,可能是引起COPD 大鼠炎症反应及免疫功能失衡的重要原因。BYF 作用后可上调miR-34a 表达,下调Notch 表达,且上述作用可被miR-34a antagomir 逆转,提示BYF 改善大鼠炎症反应及免疫功能失衡作用,可能是通过调控miR-34a/Notch轴来实现。
综上所述,BYF 可能通过上调miR-34a 表达,抑制Notch通路激活,改善COPD 大鼠炎症反应及免疫功能失衡。但COPD 炎症反应及免疫功能失衡机制复杂,BYF 也可能通过其他通路发挥作用,有待后续研究。

