山新杨PdPapHSF-A4b基因在胁迫条件下的组织表达模式1)
茶新有 李嘉哲 杨建坤 殷缘 张荣沭
(东北林业大学,哈尔滨,150040)
热激转录因子(Hsfs)是热胁迫下可以激活热基因表达的一类转录调节基因,是高等植物转录水平上热胁迫响应基因的中心调控因子,在植物热胁迫信号转导和耐热性的生产过程中起着重要的作用[1]。Hsf结构一般包括4个部分:N端DNA结合域(DNA bindingdomain,DBD)、寡聚化结构域(OD或HR-A/B)、核定位信号(NLS)和核输出信号(NES)。此外,少数Hsf还有1个最不保守的从C端激活域(CTD)。DBD结合于靶基因上游启动子区域的保守热激元件(GAAnnTTC)并募集其他转录因子形成寡聚体激活靶基因的表达[2]。在植物体内HSF最早是在番茄(Solanumlycopersicum)中克隆到[3]。随着全基因组的测序和研究的进一步完善,在水稻(OryzasativaL.)和拟南芥(Arabidopsisthaliana)等模式植物中克隆到了相应的转录因子基因。近些年来,植物Hsfs功能的研究主要集中在其响应逆境胁迫上,发现Hsfs基因在植物中不仅通过自身表达来抵抗逆境胁迫,而且能通过结合其互作蛋白或调控下游基因的表达来参与植物对逆境胁迫的抵抗,如参与调控冷、热、重金属、高盐等胁迫相关基因的表达来提高植物的抗逆性[4-5]。Hsf通过与基因启动子区域内保守的热激元件(HSE)序列的相互作用来调节基因表达,以实现植物对非生物胁迫的应激响应。
杨树(Populus)是木本植物研究的模式种[6-7]。山新杨(Populusdavidiana×P.albavar.Pyramidalis)是以山杨为母本、新疆杨为父本杂交得到的优良树种。山新杨具有树冠狭窄,树干通直,叶形优美,生长快、抗逆性较强等特点,是我国北方首选的最耐寒的园林绿化和防护用的树种。由于品质优良,很受人们重视。迄今为止,山新杨热激转绿因的生物信息学分析、组织表达模式和生物胁迫应答的相关研究未见报道。本研究团队已建立良好的山新杨遗传转化体系[8-9]。基于构建的山新杨与植物益生菌棘孢木霉和致病菌链格孢菌互作的转录组数据库,获得一条特异表达基因Potri.014G141400.1的cDNA全长序列,该基因含有典型的HSF-DNA-binding功能域。在Genbank数据库进行BLASTx比对,与已命名的银白杨HSF基因一致性最高,将其命名为PdPapHSF-A4b。在这基础上拟对该基因进行生物信息学分析。利用RT-qPCR(Real-time Quantitative polymerase chain reaction)技术揭示PdPapHSF-A4b在茎尖、叶、茎和根中的表达模式,以此基础上进一步研究山新杨根部进行盐、碱和高渗透压胁迫、接种5种植物土传病害病原菌或植物激素诱导48 h后,PdPapHSF-A4b的不同组织表达变化,为进一步揭示该基因的调控功能和进行山新杨基因工程育种获得高抗山新杨新品种提供依据,具有重要的研究意义。
1 材料与方法
供试植物为山新杨组培苗,由本实验室保存。继代培养基:WPM(木本植物培养基)+NAA 0.1 mg/L+6-BA 0.5 mg/L;生根培养基为:WPM+IBA 0.4 mg/L。在人工气候箱培养和完成各种处理。
供试微生物:核盘菌NECC20005(SclerotiniasclerotiorumNECC20005)、立枯丝核菌NECC20006(RhizoctoniasolaniNECC20006)、尖孢镰刀菌NECC20007(FusariumoxysporumNECC20007)、金黄壳囊孢菌C29(CytosporachrysospermaC29)、链格孢菌NECCFP002(AlternariaalternateNECCFP002)。
1.1 PdPapHSF-A4b基因的PCR扩增及测序
基于本实验室构建的山新杨与棘孢木霉菌和链格孢菌互作的转录组数据库(北京,百迈客公司)[10],采用Gang et al.[11]的方法进行有参转录组差异基因表达分析。经筛选获得特异表达基因Potri.004G109200.1的cDNA全长序列。依据此序列信息,利用Primer Premier 6.0软件设计克隆该基因的全长引物(表1),采用CTAB裂解法提取山新杨叶片总RNA。并用反转录试剂盒(PrimeScriptTMRT reagent Kit with gDNA Eraser,TaKaRa)合成cDNA。以cDNA为模板,TaKaRa Primer STAR®Max DNA Polymerase为反应试剂,使用表1中“HSF_A4bF”和“HSF_A4bR”引物进行RT-PCR扩增,条件为:98 ℃预变性3 min,98 ℃ 10 s,60 ℃ 8 s,72 ℃ 5 s,共35个循环;72 ℃延伸2 min。将扩增片段进行纯化并按照说明书将其连接到pMD18-T载体上,送交哈尔滨市擎科嘉美生物科技有限公司进行测序。

表1 PCR引物序列
1.2 PdPapHSF-A4b基因的生物信息学分析
利用NCBI数据库的ORFFinder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)分析PdPapHSF-A4b的开放读框长度;利用NCBI的BLASTx程序(https://blast.ncbi.nlm.nih.gov/)比对获得PdPapHSF-A4b同源蛋白序列;运用PsortII prediction(http://psort.hgc.jp/form2.html)进行亚细胞定位预测;利用TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/)预测PdPapHSF-A4b蛋白跨膜结构域;利用ExPASy网站中ProtParam(http://web.expasy.org/protparam/)分析PdPapHSF-A4b的氨基酸组分及理化性质;利用Prot Scale(http://web.expasy.org/protscale/)进行PdPapHSF-A4b蛋白疏水性分析;利用MEME软件(https://meme-suite.org/meme/)对PdPapHSF-A4b同源序列进行结构域预测;利用NCBI的Conserve Domains(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)预测蛋白保守区;应用SWISS-MODEL(https://swissmodel.expasy.org/)在线预测PdPapHSF-A4b蛋白的三级结构,并用Mega6.0软件采用邻接法(Neighbor-Joining,NJ)构建进化树(Bootstrap=1000)。
1.3 PdPapHSF-A4b基因在组织中的差异表达量
将40 d的山新杨组培苗接到生根液体培养基的玻璃试管中培养15 d,培养条件为23 ℃,相对湿度75%,16 h光照/8 h黑暗。
分别取组培生根苗茎尖(顶芽未展开叶及茎(S))、幼茎即带第1和第2完全展开叶片的两个节间(J1)、木质化的茎即茎中部的两个节间(J2)、发育中的茎即茎最下面两个节间(J3)、嫩叶即J1上的两片叶(L1)、成熟叶即茎中部的两个节间为S2、S2上的两片叶(L2)、相对老的叶片即J3的两片叶(L3)、根(R)等8个部位的样品,进行磨样并提取总RNA,分析PdPapHSF-A4b基因在不同组织中的差异表达量。
1.4 PdPapHSF-A4b基因在非生物、生物胁迫及激素诱导下组织表达量
无菌条件下将6周龄山新杨组培苗(不定根长度在10~20 cm)分别置于含有NaCl(200 mmol/L)、Na2CO3溶液(pH=10)和含有聚乙二醇6000(PEG6000)30%的液体WPM培养基中,进行盐、碱和高渗透压3种非生物胁迫试验。处理48 h后,分别收集茎尖(S)、成熟叶(L2)和根部(R)样品。
无菌条件下将活化后的5种植物土传致病真菌接种到PDA培养基中,在26 ℃条件下培养10 d获得大量分生孢子或菌丝体。细致刮取立枯丝核菌PDA培养基(1 cm×4 cm×3块)上的菌丝溶于WPM液体培养基中制备菌丝体悬浮液。其他4种真菌用血球计数器计算分生孢子悬浮液体积,备用。再将6周龄组培苗的根部分别接种尖孢镰刀菌、核盘菌、金黄壳囊孢菌和链格孢菌分生孢子,使其终体积为1×105CFU/mL,或接种已配制的立枯丝核菌的菌丝体。接种48 h后,分别收集茎尖(S)、成熟叶(L2)和根部(R)样品。
无菌条件下将6周龄山新杨组培苗分别置于含有100 μmol/L ABA(脱落酸)、JA(茉莉酸)或SA(水杨酸)的液体WPM培养基中,处理48 h后,分别收集茎尖(S)、成熟叶(L2)和根部(R)样品。
上述样品以同龄非处理山新杨组培苗为对照,分别分析PdPapHSF-A4b基因在3种非生物胁迫、5种生物胁迫和3种激素诱导下的组织差异表达量。每个试验组设3株苗,每处理3次重复。
1.5 RT-qPCR分析
收集的山新杨各个样品采用CTAB法提取总RNA,使用反转录试剂盒(PrimeScriptTMRT reagent Kit with gDNA Eraser,TaKaRa)参照说明书合成cDNA。以cDNA为模板,利用北京全式金生物公司(TransGen Biotech)的TransStart Top Green qPCR SuperMix酶和罗氏公司的荧光定量RT-qPCR仪器(LightCycler 96;Roche)进行荧光定量RT-qPCR反应。3个内参基因及其GenBank登录号分别为:PdPapACT2(MN196665)、PdPapEF1-α(MN196666)和PdPapTub(MN196667)。基因的引物序列见表1。实时定量qPCR的反应体系为:20 μL(2×Taq Master Mix 10 μL;10 μmol/L双向引物各0.8 μL;模板2 μL;DEPC处理水6.4 μL)。为了确保试验结果的重现性,对3个生物学重复的样品进行了3个技术重复。反应程序为95 ℃ 10 min,94 ℃ 5 s,59 ℃ 15 s进行45个循环,72 ℃ 10 s。熔解曲线按照95 ℃ 10 s,65 ℃ 60 s,97 ℃ 1 s进行。
1.6 数据分析
采用2-ΔCt方法[12]对无诱导条件下山新杨PdPapHSF-A4b基因在不同组织部位的组成型表达和不同诱导条件下不同组织部位的表达进行计算,Ct代表每个反应管内的荧光信号达到设定域值时所经历的循环数,该方法计算所得的结果为PdPapHSF-A4b基因相对于3个内参基因的平均表达水平的相对表达量。使用Microsoft Office Excel 2010软件包和SPSS25统计软件包对测量数据进行统计、作图和分析。对同一时间点的试验组之间的差异显著性进行ANOVA分析,在P<0.05下比较差异性。
2 结果与分析
2.1 PdPapHSF-A4b基因序列分析
山新杨PdPapHSF-A4b基因测序结果获得1 359 bp的片段(图1a)。其ORF的起始密码子在第1个氨基酸处,终止密码子位于第452个氨基酸处,编码451个氨基酸。HSF-A4b结构保守域(smart00415)含有31个氨基酸(编码序列在12~104 bp处),含有典型的HSF-DNA-binding域(图1b)。

(a)核酸和对应氨基酸序列;(b)预测的保守域。
PdPapHSF-A4b编码蛋白的分子式为C2261H3480N647O717S19,分子质量为51 808 u,理论等电点为5.44,脂肪系数61.06,不稳定系数61.63(不稳定系数>40为不稳定蛋白),预测为不稳定蛋白。不具有跨膜结构,亚细胞定位预测分析表明其在细胞核、细胞质中的分布情况分别占65.2%,21.7%。由此可以初步推测PdPapHSF-A4b在核内发挥作用。
2.2 PdPapHSF-A4b蛋白结构特性分析
在Genbank数据库中利用BLASTx进行序列搜索,获得8条(来源于4个杨树品种、1个柳树品种)与PdPapHSF-A4b一致性最高的同源基因编码氨基酸序列(总分值>792;序列覆盖率>75%;E值=0;统一性>84.73%)。MEME在线分析结果显示:这8条蛋白序列均具有位置靠近C端高度保守的3个基序(图2a)其中第2个基序与第3个基序距离很近。
对PdPapHSF-A4b基因编码蛋白的二级结构预测结果表明,基因编码的蛋白质由α-螺旋、延伸链、β-转角和无规则卷曲构成,其中α-螺旋占比39.82%;延伸链占比5.09%;β-转角占比2.88%,无规则卷曲占比52.21%。其中,无规则卷曲结构占比最高。对PdPapHSF-A4b蛋白的三级结构预测结果可见(图2c),共比对上50个模板,在模型GMQE值最大为0.13的条件下,该蛋白与模型5d5u.1.B的一致性较高,为51.52%;覆盖值为0.22,范围在第10~105个氨基酸处,此模型为人类Hsf1与HSE DNA的晶体结构蛋白。
进化树分析结果显示(图2d):可分为两大组。第I组包括PdPapHSF、银白杨(Populusalba)XP_034905225、小叶杨(Populussimonii)AKV56389.1、胡杨(Populuseuphratica)XP_011033721.1、毛果杨(Populustrichocarpa)XP_002321069.1、毛果杨(Populustrichocarpa)PNT04784.1;第Ⅱ组包括小垫柳(Salixbrachista)KAB5527533.1、银白杨XP_034905226.1和毛果杨XP_024441462.1。其中,银白杨(XP_034905225)HSF基因与山新杨HSF基因亲缘关系最近。

(a)PdPapHSF-A4b蛋白结构域及高度保守基序;(b)三级结构模板;(c)三级结构预测;(d)系统进化树。
2.3 山新杨PdPapHSF-A4b在茎尖、茎、叶和根组织中的表达
基因表达量分析发现,山新杨PdPapHSF-A4b在茎尖、茎、叶和根中均有表达(表2)。其在成熟叶中的表达量最高,分别是嫩叶的1.36倍和相对老的叶片的3.17倍(P<0.05);在茎组织的表达量由大到小为木质化的茎、发育中的茎、幼茎,木质化的茎分别是发育中茎的1.33和幼茎的4倍。根中的组织表达量是茎尖的2.5倍。

表2 山新杨PdPapHSF-A4b在不同组织中的表达量
2.4 胁迫处理对PdPapHSF-A4b的组织表达变化
在茎尖部位,盐胁迫和高渗透压胁迫使PdPapHSF-A4b显著上调为对照的2.16和1.83倍(P<0.05),而碱胁迫下显著下调表达(P<0.05)。在成熟叶中,PdPapHSF-A4b的表达量仅在碱胁迫下显著上调表达(P<0.05),而在盐胁迫和高渗透压胁迫下显著下调为对照的5.29和3.10倍(P<0.05);在根组织中,3种胁迫条件下PdPapHSF-A4b表达量均为上调,分别为对照的18.25、12.00、3.75倍(表3)。

表3 非生物胁迫下PdPapHSF-A4b在茎尖、叶和根中的表达量
山新杨组培苗根部接种5种植物土传致病真菌48 h后,PdPapHSF-A4b的表达量与对照相比均显著上调(P<0.05),分别是对照的1.82、38.00、1.48、11.04和3.26倍(表4)。
在茎尖组织中,PdPapHSF-A4b的表达量与对照相比显著上调(P<0.05),分别是对照的7.80、2.10、2.05和3.10倍。仅有接种金黄壳囊孢菌48 h时,PdPapHSF-A4b的表达量与对照相比均显著下调,是对照的2.63倍(表4)。
在成熟叶中,PdPapHSF-A4b的表达量与对照相比均显著下调(P<0.05),分别是对照的1.06、3.75、3.10和2.12倍。
在3种植物激素诱导48 h后,山新杨PdPapHSF-A4b基因的组织表达量发生不同的变化。只有叶部位的PdPapHSF-A4b基因表达量下调至对照的0.5倍,而顶尖和根中PdPapHSF-A4b基因表达量均显著上调至对照的1.04和1.69倍。
受JA诱导48 h,只有根部位的PdPapHSF-A4b基因表达量上调至对照的4.58倍,而茎尖和叶部位中PdPapHSF-A4b基因表达量均显著下调至对照的1.11和3.72倍(P<0.05)。而受ABA诱导48 h,茎尖、叶和根中的PdPapHSF-A4b基因受ABA诱导均显著上调表达,分别是对照的4.48、3.41和9.96倍(P<0.05)(表5)。
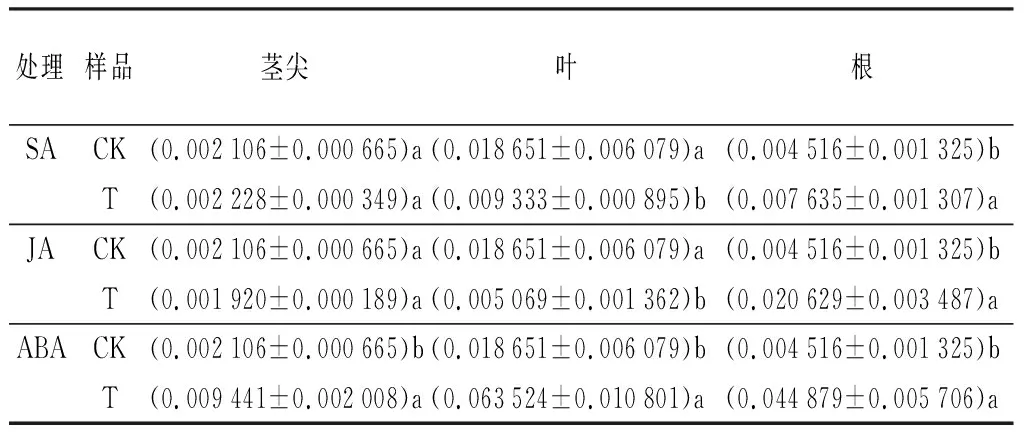
表5 激素处理下PdPapHSF-A4b在茎尖、叶和根中的差异表达
3 讨论与结论
植物热激转录因子(Hsf)作为网络调控中一类重要的调节因子,能够响应多种生物和非生物胁迫,并赋予植物多种胁迫抗性[13]。目前,对植物Hsfs基因的抗逆功能研究主要集中在拟南芥、水稻、番茄、玉米(Zeamays)等草本植物上[14],对木本植物的研究很少。木本植物在生长发育、生理及形态结构等诸多方面与草本植物不同,其抗逆机理与草本植物也会有所区别。因此,在山新杨中克隆PdPapHSF-A4b新基因并研究其组织表达特异性和在多种逆境胁迫下的调控规律具有创新性。
采用PCR技术克隆到山新杨PdPapHSF-A4b基因序列,此序列含有1 359个核酸。基因编码451个氨基酸,在N端含有1个最保守的DNA结构域(DBD),由3个螺旋结构(H1,H2,H3)和4个反相平行的β折叠(β1、β2、β3、β4)[15]。DBD结构是植物HSF的DNA结合活性必需的区域结构,能够特异识别并结合到DNA中的顺式作用元件[16]。生物信息学分析认为PdPapHSF-A4b为非跨膜亲水性蛋白,预测主要位于细胞核中。同源基因进化树分析表明该基因与银白杨(XP_034905225)亲缘关系最近。
以山新杨6周龄组培苗为材料,采用qRT-PCR研究PdPapHSF-A4b的空间表达特性分析,发现其在茎尖、叶、茎和根中均有表达,并且PdPapHSF-A4b的表达模式从幼嫩到老化的组织表达量逐渐升高,在成熟叶中的表达量最高,为幼嫩茎的10.28倍。说明PdPapHSF-A4b随山新杨发育梯度而表达提升,其生物功能可能仅在成熟叶组织中特异性发挥。植物在生长发育过程中会遇到各种非生物胁迫,例如干旱、高盐碱、极端温度等。此时,植物常常通过调节自身基因的表达来响应非生物逆境的胁迫[15-20]。本研究发现山新杨dPapHSF-A4b受到盐、碱和高渗透压胁迫,在根组织中的转录水平均受诱导而上调,说明dPapHSF-A4b可能是杨树响应和抵御胁迫过程中一个重要的蛋白,并且具有正向调控抗盐、碱和高渗透压胁迫的能力。有研究发现,拟南芥中HSFA1与HSFA2也能增强植株苗期对盐胁迫的抵抗能力[21]。植物在受到非生物胁迫下,激活的Hsfs能够识别并结合热激元件HSE(GAAnnTTC),激活下游HSP基因,从而提高植物的抗逆性[22]。综合比较发现,PdPapHSF-A4b的表达在3种非生物胁迫下均有改变,特别是盐胁迫下,该基因表达变化明显,表明其可能参与了盐胁迫应答。
链格孢菌、尖孢镰刀菌、核盘菌、立枯丝核菌和金黄壳囊孢菌为常见的5种土传植物病害致病菌,在同一环境条件下,有可能引起植物不同程度发生茎腐、茎基腐、根腐、花腐病、菌核病、褐斑病、叶枯病等多种病害症状,并且寄主较广。本研究发现,山新杨根际接种不同致病真菌后,不同组织部位中PdPapHSF-A4b的响应不同。在茎尖部位,尖孢镰刀菌、立枯丝核菌和细链格孢菌使其显著上调表达,在成熟叶中,只有根部接种立枯丝核菌时,其显著上调表达,说明植物根系侵染病原菌48 h,茎尖和成熟叶中细胞壁的降解相对较少。可能根部感染的尖孢镰刀菌对杨树苗的叶片会产生影响,PdPapHSF-A4b表达量上调可能与降解叶中细胞壁被分解而产生的寡聚糖相关[23]。在根中,接种链格孢菌、尖孢镰刀菌、核盘菌、立枯丝核菌和金黄壳囊孢菌,PdPapHSF-A4b的表达量均显著上调,其中,接种尖孢镰刀菌显著上调最高。由于尖孢镰刀菌是营半活体病原,其他致病菌是完全营腐生病原,而PdPapHSF-A4b被具有营活体营养的病原直接接触诱导表达提升最剧烈,故推测PdPapHSF-A4b可能是直接响应这类病原的一个重要基因。
植物遭受逆境胁迫后,体内的激素会发生一系列的变化来适应环境。水杨酸、茉莉酸和脱落酸是重要的植物激素,在植物响应非生物胁迫(如干旱,低温等)中起着重要作用。本研究发现PdPapHSF-A4b受脱落酸诱导各组织的表达量均显著上调;受茉莉酸和脱落酸诱导叶部位的表达量均下调,根部的表达量均上调。有研究表明,小麦(Triticumaestivum)、水稻和拟南芥中的Hsfs受脱落酸的诱导显著上调表达[24-26],这些基因参与了脱落酸信号途径介导的抗逆反应。因此,研究探索PdPapHSF-A4b对脱落酸、水杨酸和茉莉酸等激素调控对非生物胁迫的响应,为阐述山新杨响应非生物胁迫的分子机理提供初步的依据。
综合上述,本研究表明了山新杨PdPapHSF-A4b对基因组织表达模式随杨树发育梯度而表达提升,其生物功能可能仅在成熟叶组织中特异性发挥。PdPapHSF-A4b是特异性地响应盐、碱和高渗透压胁迫的重要蛋白。PdPapHSF-A4b能对根部5种致病真菌侵染产生不同程度的应答,尤其是对尖孢镰刀菌侵染表达高度上调,说明PdPapHSF-A4b可能是直接响应具有营活体营养的病原的一个重要基因,并且可能在对内生真菌的识别和响应中也扮演重要角色。因此,推测PdPapHSF-A4b参与了植物激素水杨酸、茉莉酸和脱落酸诱导的信号途径。本研究结果将为进一步揭示PdPapHSF-A4b基因的功能和通过分子植物育种构建高抗速生杨树品种提供依据。

