野生动物种间体细胞核移植研究进展
顾士钢 翟岩辉 徐超 余大为 韩志强 赵全民 代相鹏*
(1吉林农业大学中药材学院,长春 130118)(2吉林大学第一医院人类疾病动物模型国家地方联合工程实验室,长春 130021)(3中国农业科学院特产研究所,长春 130112)(4中国科学院动物研究所干细胞与再生医学创新研究院,北京 100101)
野生动物作为生态系统的重要组成部分,在生态、物质资源、遗传基因和文化等方面具有不可或缺的地位。保护野生动物有助于生物多样性的维持、区域生态平衡的稳定和人类可持续发展的促进(Huanget al.,2021;Teitelbaumet al.,2022)。近年来,由于世界人口的迅速增长、森林资源的不断破坏、生物资源的过度开发和环境污染的日渐增重等诸多问题不断地干扰破坏野生动物栖息地,致使野生动物的生存环境不断恶化,呈现栖息地碎片化,导致野生动物的繁殖性能日渐弱化、繁育障碍持续增加、物种数量不断减少、珍稀物种濒临灭绝(Gigeret al.,2021;Zubairet al.,2021;Soniet al.,2021)。
虽然原始自然交配方式是野生动物增进种群数量的主要方法(Lueders and Allen,2020),但由于部分野生动物的数量稀少、雄性攻击性强、地域性生殖隔离、行为不亲和性功能障碍等因素的存在致使多数濒危野生动物无法得到良好繁育(Thongphakdeeet al.,2020)。人工授精(Artificial insemination,AI)(Luederset al.,2014)、体外受精(In vitro fertilization,IVF)(Crosieret al.,2020)、卵胞浆内单精子显微注射(Intracytoplasmic sperm injection,ICSI)(Toru and Tony,2018)和体细胞核移植(Somatic cell nuclear transfer,SCNT)(Sunet al.,2021)等辅助生殖技术(Assisted reproductive technology,ARTs)经过近百年的研究发展,在家畜(猫、狗、牛、羊、猪)上的应用也日趋成熟(表1),因此,将ARTs应用于野生动物,能够对野生动物进行集中化和科学化圈养繁殖,从而扩大其种群数量(Herrick,2019)。除此之外,干细胞研究在动物医学领域发展具有重要的应用价值,其中诱导多能干细胞(Induced pluripotent stem cells,iPSCs)的研究在猪、牛、马等动物中还处于初步建立与应用尝试阶段(Kumaret al.,2015)。
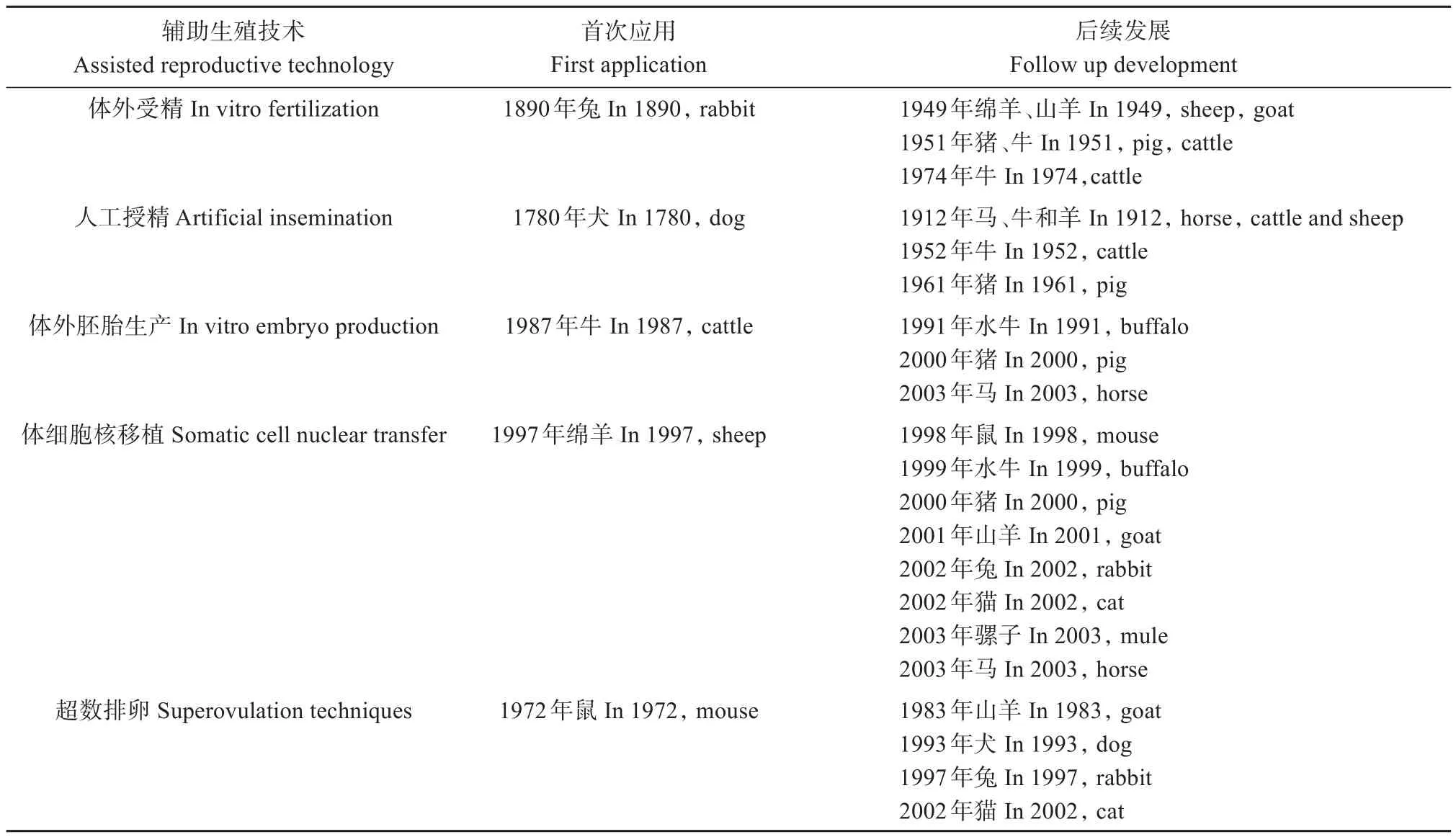
表1 辅助生殖技术的历史发展汇总.数据引自Gordon(2004)Table 1 Summary of historical development of assisted reproduction technology.The data is referenced from Gordon(2004)
由于多种野生动物的个体和种群数量稀少,而且呈持续下降趋势,采集精子或卵子开展常规辅助生殖较为困难,甚至无法完成,而种间体细胞核移植(Interspecies somatic cell nuclear transfer,iSCNT)技术仅需从活体或死后不久的野生动物体内采集体细胞,利用细胞培养技术和细胞冻存技术将细胞资源进行长期储存,动物体细胞核移植可直接将复苏细胞进行克隆,在总体上对野生动物资源进行优质的储存和利用(Borges and Pereira,2019)。iSCNT技术的优势就是可以将野生动物的供体细胞与来自不同种、科、目或纲的家畜(驯养动物)的卵母细胞融合并激活来获得较多的重构胚胎(Shogo and Zhang,2018)。现阶段,iSCNT技术已成功克隆出非洲野猫(Felis lybica)、沙丘猫(Felis margarita)、灰狼(Canis lupus)和郊狼(Canis latrans)等野生食肉动物和印度野牛(Bos gaurus)、欧洲盘羊(Ovis aries musimon)等反刍动物,证明iSCNT技术在野生动物辅助繁殖上的应用是可行和有效的 (Mastromonaco and Songsasen,2020)。同时,iSCNT技术在野生动物遗传资源的保护中也发挥重要的作用。本文介绍了近20年来iSCNT技术在野生动物(猫科、犬科、牛科、猪科和西貒科)体细胞核移植中的应用状况以及面临的问题,旨在为iSCNT技术在野生动物克隆和遗传资源保护中的应用提供理论基础和技术参考。
1 猫科野生动物的iSCNT研究
猫科动物为生态系统中不可或缺的类群,其在改善自然环境、维持生态平衡和调节动物群落等方面发挥着重要作用。近年来,随着人类活动对动物栖息地的破坏,造成多种猫科野生动物出现生存危机(Jewgenow and Zahmel,2020),38种猫科野生动物中大多数已列为受威胁、易危或濒危物种(Thongphakdeeet al.,2020)。因此,世界各国加强了自然栖息地的保护和建立濒危动物繁殖中心等措施,以维持和促进猫科野生动物的长久生存。近20年来,虽然精液冷冻、AI和SCNT等繁殖技术在猫科野生动物中得到了不断应用与发展,但因对特定物种的卵巢功能、精液特征和激素水平等基础生殖生物学知识的缺乏,物种间甚至同一分类单元内生殖机制的多样性,动物保护机构有限的容纳空间和极少的可供研究个体等多重因素的限制,使得ARTs在妊娠率和出生率方面显著低于家畜的标准水平,因此,ARTs在物种保护方面的应用仍然具有挑战性(Gonzaleset al.,2019;Thongphakdeeet al.,2020)。尽管ARTs在东北虎 (Panther tiger altaica)(Lamboet al.,2014)、云豹 (Neofelis nebulosa)(Tipkanthaet al.,2017)和金猫(Catopuma temminckii)(Swanson,2012)等猫科野生动物中得以成功实施,但ARTs(AI、IVF和胚胎移植)仅成为少数濒危物种的繁育方法。
自2002年起,SCNT技术在家猫上成功应用并得以发展,这为濒临灭绝的猫科野生动物提供了新的人工繁衍后代的机会。利用iSCNT技术克隆的非洲野猫(Gómezet al.,2003)和沙丘猫(Gómezet al.,2008)以及通过利用种内SCNT克隆的狞猫(Caracal caracal)(Pope,2014)均证明了iSCNT技术在猫科野生动物应用上存在巨大的潜力,并且证实了猫科动物种间克隆是可行的。利用不同种属间的iSCNT技术,将虎(Panthera tigris)(Moro and Jarazo,2015)、豹猫(Prionailurus bengalensis)(Gómezet al.,2003)、猎豹 (Acinonyx jubatus)(Moro and Hiriart,2015)、扁头豹猫(Prionailurus planiceps)(Pope,2014)和石纹猫(Pardofelis marmorata)(Thongphakdeeet al.,2010)的体细胞与家猫卵母细胞进行融合和激活后均能成功发育到桑椹胚阶段。2010年,从亚洲猎豹(Acinonyx jubatus venaticus)尸体上采集的跖骨处皮肤组织经过细胞培养后与去核的家猫卵母细胞融合重新激活,然而由于基因组的不完整性导致猎豹iSCNT胚胎出现卵裂和染色体分离异常,在桑椹胚阶段出现胚胎碎裂,停止发育 (图1)(Moulaviet al.,2017)。2016年,采集死亡后花豹 (Panthera pardus)、狮子 (Panthera leo)和虎的耳缘组织,获得成纤维细胞与兔去核卵母细胞融合激活后,重构胚能够发育到囊胚阶段(Yelisettiet al.,2016)。虽然iSCNT技术在
猫科野生动物上获得了一些成功(表2),但仍存在线粒体DNA(mtDNA)或基因组DNA不相容、mtDNA异质性、受体卵母细胞对供体核的胚胎基因组激活以及iSCNT胚胎无合适的移植受体等诸多限制因素的影响(Borgeset al.,2020;Mrowiecet al.,2021)。2021年,美洲狮(Puma concolor)的耳缘组织经过改良的低温保存方法保存后组织完整性好,解冻后组织变化较小,且从非冷冻保存和冷冻保存组织获得的细胞的生存力、细胞增殖活性、代谢活性和凋亡水平等方面均无显著差异,这对猫科野生动物体细胞样本保存质量的提高具有重要意义(Liraet al.,2021)。虽然克隆技术在不断发展和进步,但是其在猫科野生动物的保护和繁殖上的应用仍有待深入研究。通过对猫科动物生殖生物学的研究,可提高iSNCT的克隆效率,最终推动iSCNT技术在濒危猫科野生动物保护和繁育领域的应用。
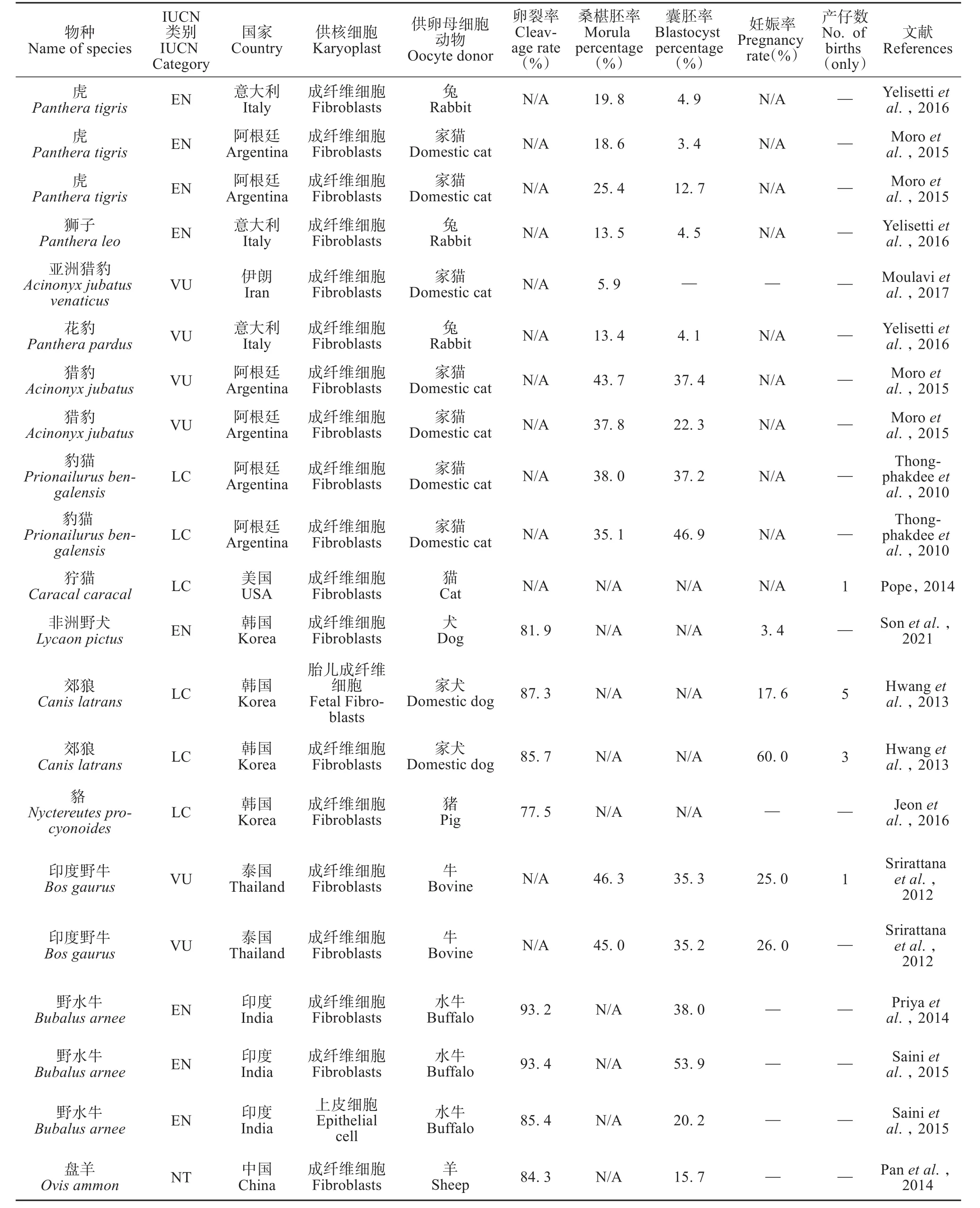
表2 野生动物种间体细胞核移植技术近十年研究汇总Table 2 Summary of interspecies somatic cell nuclear transfer studies on wild animals in recent ten years
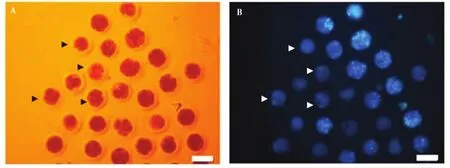
图1 猎豹iSCNT胚胎的体外发育(Moulavi et al.,2017).A:猎豹iSCNT胚胎的代表性图像;B:用Hoechst33342染色并用外荧光显微镜观察后的相同胚胎.图A和B中的箭头显示了具有不同破碎度的胚胎Fig.1 In vitro development of cheetah iSCNT embryos(Moulavi et al.,2017).A:Representative images of cheetah iSCNT embryos;B:The same embryos after staining with Hoechst33342 and observation using epifluorescent microscope.Arrows in figures A and B show embryos with different degrees of fragmentation
2 犬科野生动物的iSCNT研究
人类活动导致的栖息地片段化和过量的捕杀使多种犬科野生动物的分布范围和数量均大幅度下降(Zubairet al.,2021;Soniet al.,2021),因此犬科野生动物的研究和保护引起诸多研究学者的广泛关注。与其它野生动物不同,由于缺乏物种生殖生物学知识、无法预测排卵时间点和有效控制雌性生殖周期导致ARTs仅在灰狼、赤狐(Vulpes vulpes)和蓝狐(Alopex lagopus)等少数犬科野生动物中应用(Gonzaleset al.,2019;Nagashima and Songsasen,2021)。这严重限制了ARTs在犬科野生动物保护方面的应用与发展,而iSCNT技术可以极大限度地规避这些限制。
2005年,采集健康的阿富汗犬耳缘组织经细胞培养,获得的成纤维细胞与混合品种母犬(家犬)的去核卵母细胞融合,经连续两次电刺激融合与化学激活,最后将重构胚移植入拉布拉多母犬体内,使用SCNT技术成功诞生第一只克隆犬(Snuppy),这为克隆犬科野生动物研究奠定了坚实基础(Kimet al.,2017)。2008年,采集死去灰狼的腹部皮肤组织经细胞培养后获得的体细胞与混合品种母犬(家犬)的去核卵母细胞融合后,成功产下3只健康的后代(图2),标志着iSCNT技术可以“复活”死后濒危犬科野生动物(Ohet al.,2008)。2013年,利用iSCNT技术成功将郊狼体细胞注入家犬的卵母细胞,将320个种间重构胚胎移植到22只家犬体内获得6只怀孕犬,最终诞生了8只健康的后代,并且iSCNT技术的融合率和克隆效率与家犬种内克隆无显著差异(Hwanget al.,2013)。2016年,在第一次使用猪卵母细胞进行貉(Nyctereutes procyonoides)的iSCNT研究中发现,猪去核卵母细胞有效地支持了貉iSCNT胚胎发育至4细胞阶段(胚胎基因组激活阶段),但这些胚胎未能发育至囊胚,均表现出核仁形成方面的缺陷(Jeonet al.,2016)。2021年,从成体的非洲野犬(Lycaon pictus)采集的皮肤成纤维细胞与混合品种母犬(家犬)的卵母细胞融合,移植到犬体内30 d后成功受孕,但在46 d时未能检测到心脏活动和妊娠指征(Sonet al.,2021)。通过iSCNT技术可以成功繁殖部分种类的犬科野生动物(表2),尽管iSCNT技术存在重构胚发育率低、子代形态异常和mtDNA遗传等方面的问题,但通过对iSCNT技术的优化和犬科野生动物生殖特性的深入研究,该技术仍可成为保护和繁殖濒危犬科野生动物的有效手段之一。

图2 出生7个月的3只雄性克隆灰狼.图片来自Oh等(2008)Fig.2 Three male gray wolf clones at seven months after birth.Image from Oh et al.(2008)
3 牛科野生动物的iSCNT研究
牛科动物素来是人类狩猎活动的主要对象之一,也是大型食肉动物的主要食物,分布于除了南极洲以外的每一块大陆,物种数量十分丰富,对于维持生态环境稳定具有不可或缺的地位。然而牛科野生动物资源一经破坏,仅依靠种群自然恢复极其困难,可以通过ARTs人为增强野生种群增殖能力。尽管获取待研究的动物以及获取样本材料方面存在困难,但AI、IVF、ICSI和SCNT等辅助生殖技术仍被广泛应用于培育美洲草原野牛(Bison bison bison)、西班牙羱羊(Capra pyrenaica)和白犀(Ceratotherium simum)等濒危牛科野生动物。由于缺乏足够数量的雌性个体来获得生产胚胎所需的大量卵母细胞,导致ARTs在牛科野生动物上的应用极为有限(Iqbalet al.,2021)。1998年,首例利用胎儿成纤维细胞核生产的转基因牛诞生(Cibelliet al.,1998),为濒危牛科野生动物保护性克隆奠定基础。2000年,美国依阿华州一头普通母牛产下一头名叫“Noah”的印度野牛克隆后代,它是世界上第一只种间克隆的珍稀野生动物(Lanzaet al.,2000)。2001年,一头种间体细胞核移植的欧洲盘羊在绵羊体内妊娠并成功生产(Loiet al.,2001)。这两项研究均证明珍稀野生动物可以通过iSCNT产生,虽然克隆的胎儿是真正的细胞核克隆,但它们实际上是来自卵母细胞mtDNA的基因嵌合体(Loiet al.,2001)。印度野牛和欧洲盘羊克隆成功充分证明了利用iSCNT技术保护牛科野生动物的可行性。二十多年以来,对利用转基因克隆技术生产同种、异种转基因克隆的牛科野生动物的研究从未停止,将珍稀的牛科野生动物的成纤维细胞移植到去核的牛卵母细胞中构建异种重构胚,再将发育到2~4细胞期异种重构胚移植到同期处理的家牛受体内,进而生产珍稀的牛科野生动物。在对印度野牛—牛(Srirattanaet al.,2012)、爪哇野牛—牛(Sansinenaet al.,2005)、野水牛—水牛(Priyaet al.,2014;Sainiet al.,2015)、羱羊—山羊(Lianget al.,2007)、盘羊—绵羊(Panet al.,2014)、山地紫羚—牛(Leeet al.,2003)等异种重构胚的研究中,虽呈现出不同的囊胚发育率,但均无克隆活体出生。研究认为,不正确的体细胞核重编程以及线粒体基因组激活异常所导致的线粒体功能障碍是导致iSCNT重构胚发育异常的主要原因(Czerniket al.,2019)。应用iSCNT技术生产的亚洲野牛、欧洲盘羊和印度野牛等牛科野生克隆动物后代均为同亚科物种间的克隆,这为野生动物资源的保护、阻止生物多样性的丧失和应对未来物种大规模灭绝的挑战开辟了新的战略道路。这一新兴技术也强调了保存和扩展濒临灭绝物种正常细胞系库的必要性。
4 猪科和西貒科野生动物的iSCNT研究
在构建人类疾病动物模型中,猪在解剖、生理、营养代谢以及伦理等方面更有优势,是人类理想的疾病动物模型(Nelsonet al.,2022)。2000年,第一批体细胞克隆猪的出生,预示着克隆技术可以用来生产与现存优质育种猪供体细胞基因相同的后代(Onishiet al.,2000),除此之外,SCNT联合转基因技术可以获得许多有价值的生物医学动物模型(Yang and Wu,2018)。这些研究为猪科野生动物保护性克隆研究奠定了理论基础。
西貒科(Tayassuidae)和猪科在分支分类学上归类于猪形亚目,并且整体形态学和DNA研究表明猪科和西貒科是姐妹群且具有极高的亲缘性。2016年在首次培养领西貒(Pecari tajacu)体细胞的研究中发现,20%浓度的胎牛血清培养基体系能够优化领西貒耳组织体细胞培养和提高体细胞复苏率(Santoset al.,2016)。2020年,在领西貒成纤维细胞系的分离和冷冻保存中,通过免疫荧光鉴定了成纤维细胞,并评估了其形态、生长和粘附能力。此外,还监测了成纤维细胞的活力和代谢活性,以确定传代数和冷冻保存对细胞系建立的影响(Borgeset al.,2020)。在进一步优化领西貒ARTs的研究中发现,利用离子霉素和6-二甲氨基嘌呤可以激活卵丘—卵母细胞复合体获得领西貒胚胎 (Borgeset al.,2020)。
猪具有重要的经济价值,同时也是医学研究的关键模型和生物技术的重要载体,猪克隆技术主要用来产生与优质育种猪供体细胞基因相同的后代,并且应用在猪的克隆技术可能同样适用于其他猪科的种质资源和猪科野生动物保护性研究,但对于野生猪科和西貒科动物的iSCNT技术的应用仍待深入探究。
5 展望
野生动物的生存范围和物种多样性将持续受到人为压力的挑战。应用iSCNT技术成功生产非洲野猫、狞猫、灰狼、非洲盘羊和印度野牛等野生动物的克隆后代,表明野生动物的克隆技术具有巨大应用潜能。它有助于最大限度地保持物种的遗传多样性和降低濒危物种的灭绝威胁,为野生动物资源保护和避免物种生物多样性丧失开辟新的道路。iSCNT技术也强调了保存和扩展濒临灭绝物种的正常细胞系库的必要性。但iSCNT技术仍然存在mtDNA或基因组DNA不相容、mtDNA异质性、克隆效率低、克隆动物胚胎与胎儿发育异常、早期和晚期流产及克隆动物发育缺陷等问题。因此,只有不断探究影响iSCNT成功率的因素,完善野生动物生殖生物学知识,从而进一步优化iSCNT技术才是科研工作者不断追求的目标和努力的方向,才能有效促进野生动物物种多样性的保护和实现濒危或灭绝物种的“复活”。

