Ti-MOFs基复合材料的制备及其光电催化性能研究
郭芳颖,王 群,贾伟科,苏 骑,王际平
(1.上海工程技术大学 纺织服装学院,上海 201620; 2. 上海纺织化学清洁生产工程技术研究中心,上海 201620)
随着现代工业化发展和人口的快速增长,环境污染问题日益严重,已成为迫切需要解决的世界性问题[1-3]。各大行业每年都要产生大量废水,特别是纺织品行业,其废水排放量每年都呈翻倍趋势增长,已在世界范围内引起高度关注[4-6]。废水成分复杂,其中有机染料在大多数情况下具有较稳定的化学性质、高色度值和高化学需氧量(COD)和生物降解性差等特点,从而难以处理[7-8]。若工业废水未经适当处理即排放,可能导致水体富营养化,给生态系统和人类健康带来极大危害[9-11]。
目前,人们关于环境污染问题已提出众多解决方法,包括膜过滤法[12-13]、生物处理[14-15]、电化学法[16-17]、催化氧化及吸附法[18-20]等,但是这些方法的处理效果都不尽如人意。光电催化技术是一种操作简单、无二次污染、低能耗且高效的催化降解污染物的方法。在光电的条件下,催化剂表面能够产生电子-空穴对(e--h+),电子-空穴对在合适的带隙宽度条件下即可转移和分离,从而催化剂表面形成的活性氧簇(ROS)可将有机污染物氧化降解为二氧化碳和水[21-22]。
光电催化材料种类丰富,包括金属有机框架[23-24]、金属氧化物半导体[25-26]、硫化物半导体[27-28]等。金属有机骨架(MOFs)是一种新型纳米级多孔聚合材料,这类材料是以金属(簇)为节点,有机配体为连接体,通过强配位键桥连形成开放式的具有永久孔道的晶型骨架[29-30],它具有比表面积大、孔隙率高、稳定性优异等特有的物理化学性。MoS2是一种二维分层纳米半导体材料,每个单元中都有S-Mo-S的结构,各层之间通过微弱的范德华力连接在一起[31-32]。此外,与纳米颗粒状的MoS2相比,花状多级结构的MoS2具有更大的比表面积和独特的缺陷富集晶体结构,能够暴露更多的活性边缘位点,从而在光照条件下,其表面产生的载流子能够有效转移和分离[33-34]。
本文借助简单易行的水热反应,将花状多级结构的MoS2成功负载至Ti-MOFs表面,构建了MoS2/Ti-MOFs复合结构,并对样品的形貌、结构、组分、光电化学及光电催化性能做了系统研究。
1 实 验
1.1 MoS2/Ti-MOFs的制备
1.1.1 Ti-MOFs的制备
将2-氨基对苯二甲酸(NH2-BDC,0.181 g)缓缓加入到N,N-二甲基甲酰胺/甲醇(体积比9∶1)的混合溶剂中,待完全溶解后加入钛酸异丙酯(0.194 mL),并在室温下温和搅拌30 min,然后将其转移至50 mL的聚四氟乙烯内衬中,置于150 ℃的烘箱中保持24 h[35];反应结束后,反应釜自然冷却,将得到的黄色产物分别用N,N-二甲基甲酰胺、甲醇洗涤3次;最后,将洗净后的样品置于60 ℃的真空烘箱中干燥12 h,获得黄色粉末产物。
1.1.2 MoS2/Ti-MOFs的制备
MoS2/Ti-MOFs的制备过程示意图如图1所示。将硫脲(1.066 g,14 mmol)和四水合钼酸铵(1.236 g,1 mmol)溶解在去离子水中,然后将一定量的Ti-MOFs添加到上述溶液中形成悬浮液,将悬浮液转移至50 mL的聚四氟乙烯内衬中,并将反应釜置于180 ℃的烘箱中保持12 h;反应结束后,待冷却至室温,将悬浮液离心,并取其沉淀,再对所得沉淀分别用水、乙醇洗涤3次;最后,将产物置于60 ℃的真空烘箱内干燥12 h,收集黑色粉末产物。改变Ti-MOFs含量,即MoS2质量分数分别为60%、20%、10%、5%时,所得产物记为MoS2/Ti-MOF-40、MoS2/Ti-MOF-80、MoS2/Ti-MOF-90、MoS2/Ti-MOF-95。

图1 MoS2/Ti-MOFs制备过程示意图Fig.1 Schematic diagram of preparation process for MoS2/Ti-MOFs
1.2 材料表征
红外光谱仪(FTIR,Thermo Scientific,Nicolet 6700)用于分析样品所含的官能团;X射线衍射仪(XRD,PANalytical,X’pert-Pro MRD)、冷场发射电子显微镜(SEM,Hitachi,SU8010)和透射电子显微镜(TEM,FEI Tecnai F-20)分别用于表征样品的晶体结构和微观形貌;配置有单色的Al Kα X射线源的光电子能谱分析仪(XPS,KRATOS,Axis Ultra HAS)用于分析样品所含化合态;紫外-可见分光光度计(UV-vis DRS,Shimadzu,UV-2600)用于测试样品的紫外-可见吸收光谱(UV-vis DRS)和Tauc plot图,探究催化剂的光响应性和带隙宽度;电化学工作站(Metrohm Autolab,M204)用于分析样品的光电化学性能。
1.3 光电化学性能测试
使用配置有传统三电极电解池的电化学工作站为光电极施加一定的电压,涂覆有制备的催化剂的导电玻璃(FTO)为工作电极,铂箔和Ag/AgCl(3.0 mmol的KCl溶液)分别作为对电极和参比电极。在光电化学测试之前,将N2流鼓入Na2SO4溶液(0.2 mmol,pH=6.8)中30 min以去除溶解于电解质溶液中的氧气。配置有紫外滤光片(λ>420 nm)的300 W氙灯(Trusttech,PLS-SXE 300)作为可见光光源,光源与电极之间的距离设置为15 cm,光照射到电极表面的光强为100 mW/cm2。在0.30 V(vs. Ag/AgCl)的偏压条件下记录光电流-时间曲线(I-t),光源的开/关循环时间设置为30 s。在0.1~105Hz的频率范围内获取电化学阻抗谱(EIS),交流电压振幅为5 mV,偏压设置为0 V (vs.Ag/AgCl)。线性扫描伏安曲线(LSV)测试时,扫描速率为20 mV/s,电压范围设置为-0.5~1.0 V (vs.Ag/AgCl)。
1.4 有机污染物催化降解实验
光电催化降解有机污染物实验装置与光电化学性能测试相同,装置示意图如图2所示。将10 mg样品分散在含全氟磺酸(Nafion)的乙醇溶液中,并取分散液涂覆至FTO的导电面制备光电极,以50 mL的2,4,6-TCP(10 mg/L,初始pH值为4.2)作为电解质,进行光电催化降解实验。利用紫外分光光度计测试光电催化过程中2,4,6-TCP的吸光度,并将其换算为浓度,计算得到模拟有机污染物的降解速率。
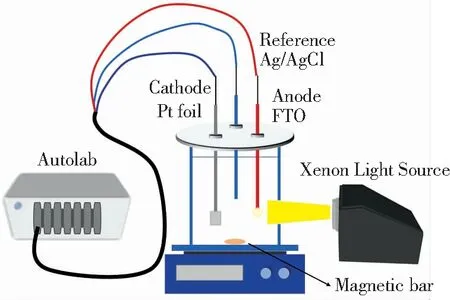
图2 光电催化降解有机物示意图Fig.2 Schematic diagram of photoelectrocatalytic degradation of organic pollutants
2 结果与讨论
2.1 傅里叶红外变换光谱
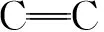
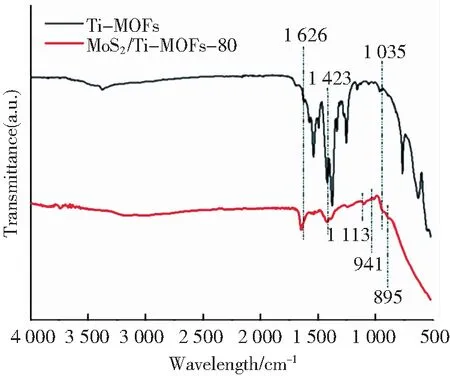
图3 Ti-MOFs与MoS2/Ti-MOFs-80的FTIRFig.3 FTIR of Ti-MOFs and MoS2/Ti-MOFs-80
2.2 X射线衍射分析
图4给出了Ti-MOFs和MoS2/Ti-MOFs的XRD谱图,位于6.7°、9.8°、11.9°、17.7°、19.5°和25°的特征峰分别归因于Ti-MOFs的(101)、(002)、(211)、(301)、(004)和(101)晶面[22]。MoS2/Ti-MOF的XRD谱图中不仅可以观察到Ti-MOFs的所有特征峰,还可以观察到位于11.1°、33.4°和54.4°的特征峰,分别归因于MoS2的(001)、(100)和(110)晶面结构(JCPDS 37-1492)[33,39]。XRD测试结果进一步证实MoS2/Ti-MOFs复合材料的成功制备,且水热反应过程引入MoS2不会破坏Ti-MOFs的化学结构。

图4 Ti-MOFs和MoS2/Ti-MOFs的XRD谱图Fig.4 XRD patterns of Ti-MOFs and MoS2/Ti-MOFs
2.3 材料的表面形貌
图5(a)给出了材料的微观形貌图,由图中可见,制备的Ti-MOFs为多面体,粒径约200~500 nm。MoS2/Ti-MOFs-80的SEM表明花状多级结构的MoS2均匀包覆在Ti-MOFs表面(图5(b)),MoS2/Ti-MOFs的TEM图(图5(c))进一步证实了MoS2在Ti-MOFs表面的均匀分布。MoS2/Ti-MOFs的HRTEM图(图5(d))表明,晶格条纹间距0.13 nm对应于Ti-MOFs的(101)晶面[40],晶格条纹间距0.273、0.624 nm分别对应于MoS2的(100)及(002)晶面[41],该结果进一步证实了MoS2/Ti-MOFs的成功制备,MoS2与Ti-MOFs的不同元素之间能够充分接触且深入杂化。

图5 Ti-MOFs的SEM(a)以及MoS2/Ti-MOFs-80的SEM(b)、TEM(c)、HRTEM(d)Fig.5 SEM image of Ti-MOFs (a) and SEM (b),TEM (c), and HRTEM (d) images of MoS2/Ti-MOFs-80
2.4 X射线光电子能谱分析
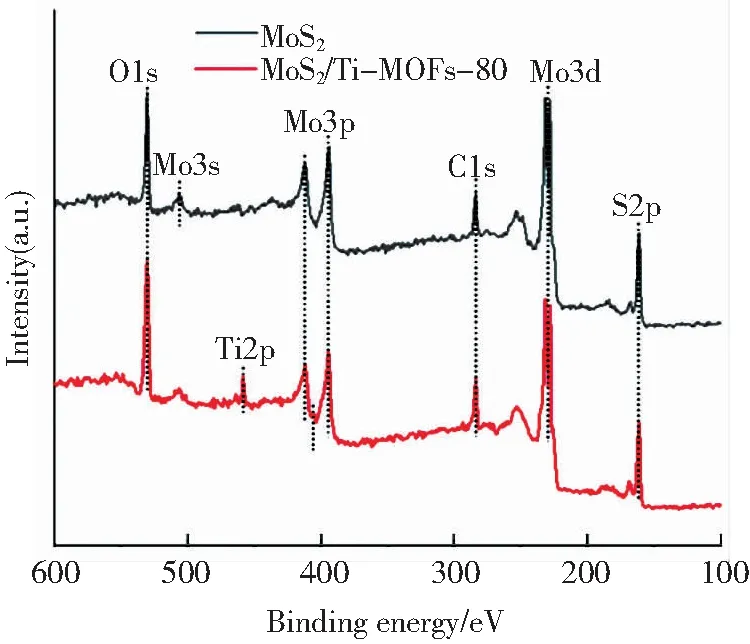
图6 MoS2与MoS2/Ti-MOFs-80的XPS全谱图Fig.6 XPS spectra of MoS2 and MoS2/Ti-MOF-80
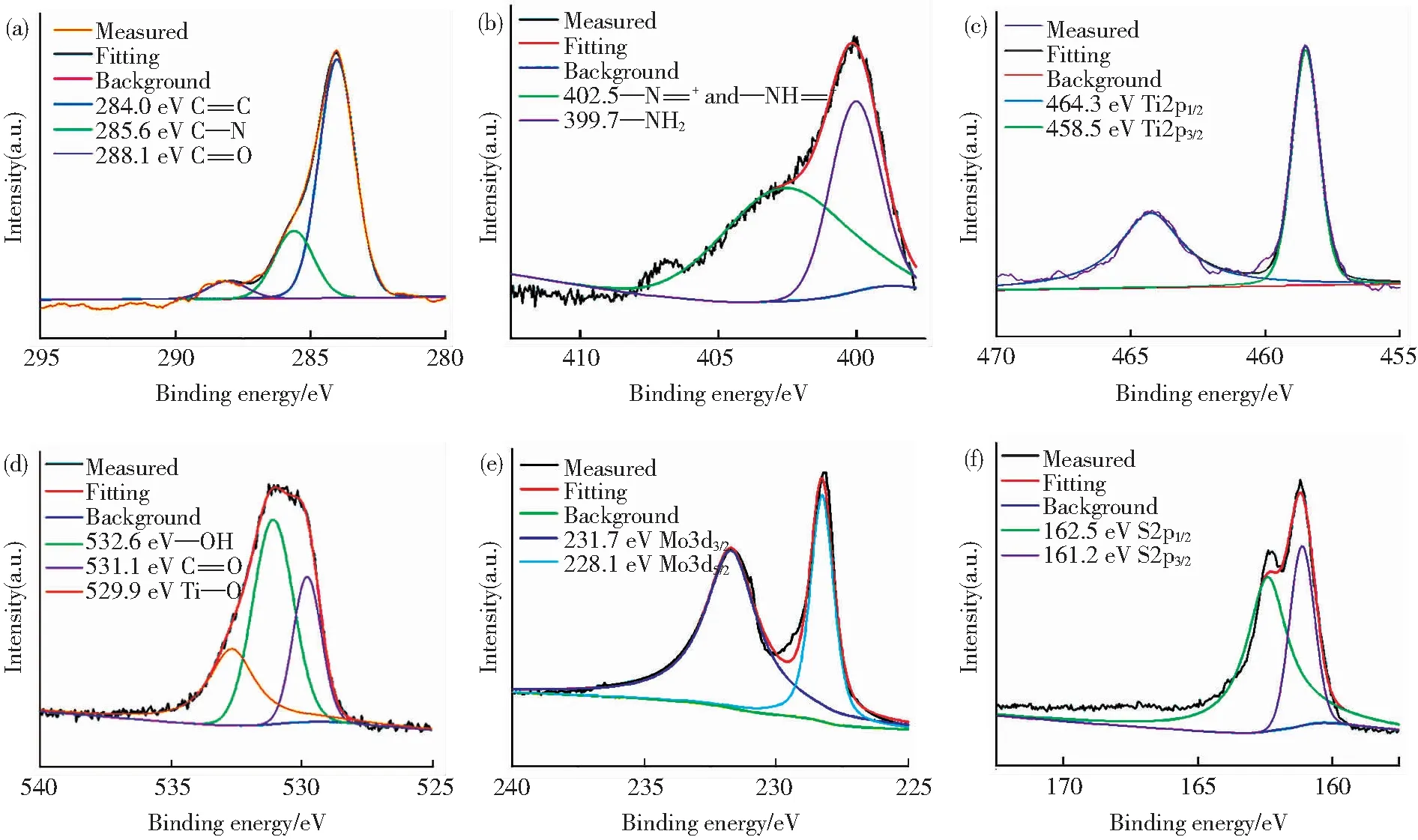
图7 不同元素高分辨率峰拟合的XPS谱图Fig.7 High-resolution peak-fitting XPS spectra of different elements: (a) C1s; (b) N1s; (c) Ti2p; (d) O1s; (e) Mo3d; (f) S2p
2.5 紫外-可见漫反射光谱分析
Ti-MOFs和MoS2/Ti-MOFs在紫外光区域均表现出优异光吸收能力,在可见光区域,MoS2/Ti-MOFs仍然表现较强的光吸收性,而Ti-MOFs对可见光的吸收极其微弱(图8(a))。此外,Ti-MOFs在290和390 nm处的吸收特征峰可能归因于有机金属框架的Ti-O转变[43]。MoS2/Ti-MOFs表现出显著增强的可见光响应性,表明花状多级结构的MoS2作为光敏化剂,可有效促进Ti-MOFs对可见光的吸收。

图8 Ti-MOFs与MoS2/Ti-MOFs-80的紫外-可见漫反射光谱(a)和光学带隙宽度(b)Fig.8 UV-vis DRS (a) andoptical band gap(b)of Ti-MOFs and MoS2/Ti-MOFs-80
MoS2/Ti-MOFs优异的可见光响应性可能归因于复合材料的窄带隙宽度。半导体材料的带隙能根据Tauc plot法进行测算,计算公式如下[44]
[(αhν)]n=A(hν-Eg)
(1)
式中:α为光吸收指数;h为普朗克常量;v为频率;A是常数;Eg为半导体材料带隙宽度。
指数n与半导体类型有关,即半导体为直接带隙半导体,n=1/2;半导体为间接带隙半导体,n=2。如图8(b)所示,MoS2/Ti-MOFs-80的带隙宽度为1.99 eV,明显小于Ti-MOFs带隙宽度(2.28 eV)。较窄的带隙宽度有利于半导体材料对可见光的吸收,因此带隙能测试结果进一步证实了MoS2的修饰可有效增强Ti-MOFs的可见光响应性。
2.6 光电化学性能分析
图9所示的线性扫描伏安曲线、电化学阻抗谱(EIS)、I-t曲线测试用于研究催化剂的光电化学性能。如图9(a)所示,在可见光照射下,MoS2/Ti-MOFs的饱和光电流密度较Ti-MOFs明显增大,且MoS2/Ti-MOFs-80的饱和光电流密度高达0.290 mA/cm2(0.3 V (vs.Ag/AgCl)),几乎是Ti-MOFs(0.033 mA/cm2)的9倍,表明MoS2的负载可有效增强Ti-MOFs对可见光的响应性,并且通过调控MoS2在Ti-MOFs表明的负载量及分布可有效优化样品的光电响应性。

图9 Ti-MOFs与MoS2/Ti-MOFs在可见光照射下的LSV曲线(a),EIS Nyquist谱图(b)和I-t曲线(c)Fig.9 LSV curves (a), EIS Nyquist plots (b),and I-t curves (c) of Ti-MOFs and MoS2/Ti-MOFs under visible light irradiation
EIS测试用于进一步探究电极/电解质界面处的电荷转移动力学。如图9(b)所示,在可见光照射下,MoS2/Ti-MOFs的EIS谱图较Ti-MOFs表现更小的弧半径,表明MoS2的引入可有效增加载流子的转移通道,促进电子-空穴对的分离和转移。此外,在所有样品中,MoS2/Ti-MOFs-80的EIS谱图显示的弧半径最小,意味着MoS2负载量为20%时,制备的催化剂表界面产生的光生电荷的转移和分离效率最高。
此外,从I-t曲线(图9(c))可以看出,在施加0.30 V (vs. Ag/AgCl)的偏压条件下,MoS2/Ti-MOFs的光电流密度较Ti-MOFs明显增大,且光电流密度随MoS2沉积量的不同表现出明显差异,其中MoS2/Ti-MOFs-80表现最大的光电流密度。此外,经过450 s的循环测试,合成的催化剂的光电流密度略有下降。以上结果进一步证实,MoS2用于修饰Ti-MOFs可有效增强其可见光响应性;光电流密度与时间关系的循环测试表明,合成的催化剂具有较好的光电化学稳定性。
2.7 光电催化降解模拟有机污染物分析
在进行光电催化降解实验之前,先将初始质量浓度为10 mg/mL的2,4,6-TCP溶液置于黑暗中搅拌30 min,以达到吸附平衡。在之后的可见光照射下进行光电催化降解过程中,每隔1 h取3 mL悬浮液进行离心分离,得到的上层清液用于测试有机物的吸光度。有机物的降解效率可根据式(2)计算得到[22]
η%= 1-Ct/C0×100%
(2)
式中:C0为有机物初始浓度;Ct为光电催化实验进行到tmin时的有机物浓度。
如图10(a)所示,经过6 h的光照后,MoS2/Ti-MOFs-80光电极对2,4,6-TCP的去除效率达到82.59%,为Ti-MOFs(32.15%)的2.6倍,且高于其他成分的MoS2/Ti-MOFs对2,4,6-TCP的去除效率;在相同条件下,MoS2对2,4,6-TCP的去除效率为52.52%,低于合成的MoS2/Ti-MOFs对2,4,6-TCP的去除效率。结果表明,MoS2具有明显的光电催化活性,将其用做助催化剂可有效增强Ti-MOFs的光电催化能力。
为进一步探究催化剂对有机物污染物的去除效果,我们对2,4,6-TCP降解的动力学曲线进行了拟合,所根据的一级动力学方程如下[32]
k=-t/ln(C0/Ct)
(3)
其中k为催化反应动力学常数。计算得到相关的线性拟合系数R2,几种材料的R2值均大于0.98,说明其线性拟合关系较好,符合一级动力学方程。如图10(b)所示,MoS2/Ti-MOFs-80作为光电极时,有机物催化降解的动力学常数达到1.77 h-1,为Ti-MOFs(0.39 h-1)的4.5倍,且高于MoS2(0.74 h-1)、MoS2/Ti-MOFs-40(1.13 h-1)、MoS2/Ti-MOFs-90(1.19 h-1)及MoS2/Ti-MOFs-95(1.44 h-1)作为光电极对应的有机物催化降解动力学常数。上述结果表明,MoS2作为助催化剂能够有效增强Ti-MOFs的光电催化活性,且MoS2负载量为20%时,即MoS2/Ti-MOFs-80光电催化活性最强。MoS2负载量过大或者过小,合成的催化剂的催化活性均减弱,原因可能在于MoS2负载量过低时,不能够为载流子的转移和分离提供足够的通道及带隙宽度,而过量的MoS2则会堆积在Ti-MOFs表面,抑制了载流子的转移和分离。

图10 在可见光照射下,Ti-MOFs与MoS2/Ti-MOFs分别对2,4,6-TCP光电催化降解的速率-时间曲线(a)及对应的动力学线性模型(b)Fig.10 Photoelectrocatalytic degradation rate curves of 2, 4, 6-TCP by Ti-MOFs and MoS2/Ti-MOFs under visible light irradiation (a)and corresponding kinetic models (b)
为了验证光电催化的优越性,我们以MoS2/Ti-MOFs-80作为催化剂,分别在黑暗、电催化(0.30 V(vs. Ag/AgCl))、光催化条件下对2,4,6-TCP进行降解,并将降解速率与光电催化降解速率进行对比(图11(a))。MoS2/Ti-MOFs-80在黑暗、电催化(0.30 V(vs. Ag/AgCl))、光催化条件下对2,4,6-TCP的降解速率分别为5.80%、50.23%和72.51%,对应的催化降解速率常数分别为0.060、0.698和1.291 h-1(图11(b))。上述结果表明,MoS2/Ti-MOFs-80作为催化剂,光电催化降解有机物的效率明显优于电催化、光催化降解有机物的效率。光电催化过程优于电催化、光催化过程可归因于施加电压和提供光照的协同效应。

图11 MoS2/Ti-MOFs-80在不同条件下对应的2,4,6-TCP降解速率-时间曲线(a)及对应的动力学线性模型(b)Fig.11 Degradation rate curves of 2, 4, 6-TCP by MoS2/Ti-MOFs-80 under different conditions (a)and corresponding kinetic models (b)
为了进一步证实合成的催化剂的光电催化稳定性,我们进行了5次循环(每个循环周期为6 h)的光电催化降解模拟有机污染物实验。研究结果表明,在经过5次循环的光电催化降解实验后,2,4,6-TCP的降解速率仍保持在80%以上(图12(a)),说明制备的MoS2/Ti-MOFs-80具有较好的光电催化稳定性。此外,经过5次循环光电催化降解实验后,MoS2/Ti-MOFs-80的微观形貌(图12(b))几乎无改变,进一步证实光电催化过程对合成的催化剂的结构、活性几乎无影响。
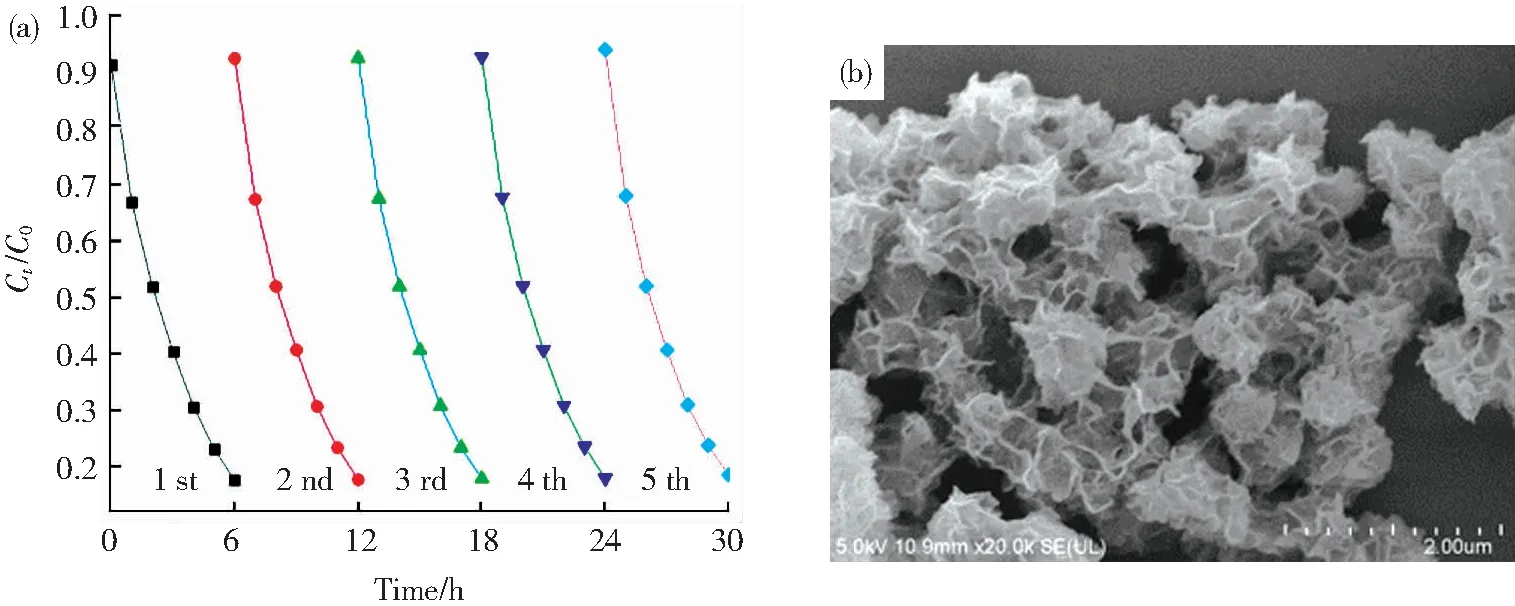
图12 MoS2/Ti-MOFs-80在可见光照射下连续5次循环时2,4,6-TCP光电催化降解的速率-时间曲线(a)和SEM图(b)Fig.12 Photoelectrocatalytic degradation rate curves of 2,4,6-TCP by MoS2/Ti-MOFs-80 for five consecutive cycling runs (a) and SEM image (b)
3 结 论
1) 借助简单易行的水热反应,将花状多级结构的MoS2成功负载至Ti-MOFs表面,制备了MoS2/Ti-MOFs复合材料。
2) 在可见光照射下,MoS2/Ti-MOFs-80的光电流密度达到0.290 mA/cm2,MoS2/Ti-MOFs较Ti-MOFs表现出显著增强的光电化学性能。
3) MoS2/Ti-MOFs-80对有机污染物的光电催化降解效率较Ti-MOFs显著提高;模拟有机污染物降解循环实验证实合成的催化剂具有较好的光电催化稳定性。
4)MoS2/Ti-MOFs的成功制备为开发基于钛金属有机框架的催化剂提供了新思路,促进了废水处理技术的发展,具有潜在的应用前景。

