饲粮中维生素D3含量对绵羊组织的抗氧化性能及细胞凋亡的影响
崔宇帆,陈昱筱,杨 裕,王栋梁,韩红宇,庞全海* (.山西农业大学 动物医学学院,山西 太谷 0080;2.山西省阳曲县动物疫病预防控制中心,山西 阳曲 0000;山西省朔州职业技术学院,山西 朔州 06002)
微贮豆秸指的是在豆秸中加入微生物菌剂,在厌氧环境下利用有机物的发酵繁殖从而获得的优质饲粮,由此方法获得的饲粮相对于豆秸来说,饲粮成本下降,减少了浪费,减少了环境污染,粗纤维含量有所下降,已被证实是一种优质饲粮[1]。研究表明维生素D3(VD3)具有免疫调节作用[2],适量的VD3可抑制氧化应激损伤和细胞凋亡[3],若可以在微贮豆秸饲粮的基础上添加适量维生素D(VD),将两者优势相结合,在畜牧养殖中将会是一大突破,然而,目前的研究主要集中于饲料中VD3对于水产动物[4-5]及禽类[6-8]抗氧化和免疫功能的影响,鲜有关于微贮豆秸中VD3添加量对绵羊各组织抗氧化和细胞凋亡影响的报道。基于此,本试验研究微贮豆秸中添加VD3对绵羊各组织的抗氧化性能及细胞凋亡的影响,从而为更好地利用微贮和VD3提高养殖效益和动物健康水平提供理论依据。
1 材料与方法
1.1 实验动物及分组随机选取购自山西柳林汇源新盛养殖专业合作社的健康杜泊羊(♂)×小尾寒羊(♀)杂交子代公绵羊25只,体质量20~25 kg,随机分为5组,每组5只,对照组饲粮不添加VD3,试验组饲粮中分别添加300,600,900,1 200 IU/kg VD3,连续饲喂80 d。
1.2 日粮及饲养管理各组均饲喂基础日粮+微贮豆秸,微贮豆秸参考陈昱筱等[1]的方法制作。对照组饲粮不添加VD3,试验组饲粮中分别添加300,600,900,1 200 IU/kg VD3。日粮成分及含量见表1。
1.3 主要试剂抗氧化试剂盒(南京建成生物工程有限公司);RNA反转录试剂盒(Abcam公司)。
1.4 主要设备PCR仪(Bio-Rad);实时荧光定量PCR仪(Bio-Rad);核酸测定仪(Eppendorf公司);全波长多功能酶标仪(Thermo Forma公司);自动血液分析仪(普康医疗器械有限公司)。
1.5 抗氧化性能的测定血液的采集与处理:在饲喂第80 天时,在羊空腹状态时颈静脉采血,分离血清并分装于离心管中,-20℃密闭保存备用。组织样品的采集与处理:在饲喂第80 天时,每组随机挑选4只绵羊,采集肝脏、脾脏、肾脏、胸腺及肠系膜淋巴结样品,加生理盐水制成10%的匀浆,离心后取上清备检。
1.6 细胞凋亡相关基因表达量的测定引物信息、序列及合成方式同文献[1]。按常规方法提取绵羊各组织总RNA,严格按照反转录试剂盒说明书将其反转录为cDNA,按照TaKaRa荧光定量试剂盒说明书进行实时荧光定量 PCR反应。
1.7 病理组织学检查按常规方法制作组织切片,TUNEL法染色,镜检。
1.8 统计分析选用SPSS 25.0对所得数据进行单因素方差分析,多重比较选用Duncan法。
2 结果
2.1 VD3对绵羊各组织抗氧化性能的影响由图1可知,饲粮中添加600 IU/kg VD3时,绵羊血清过氧化氢酶(CAT)活性显著升高(P<0.05);添加900,1 200 IU/kg VD3时,CAT活性极显著升高(P<0.01);添加300,600,900 IU/kg VD3时,谷胱甘肽过氧化物酶(GSH-Px)活性显著升高(P<0.05);而添加300,600,900,1 200 IU/kg VD3时,T-SOD的活性极显著升高(P<0.01);MDA的含量则显著降低(P<0.05)。
由图2可知,绵羊饲粮中添加900 IU/kg VD3时,肝脏CAT活性显著升高(P<0.05);添加600,900,1 200 IU/kgVD3时,GSH-Px活性显著降低(P<0.05);添加300,600,900,1 200 IU/kg VD3时,T-SOD活性均显著升高(P<0.05),MDA含量显著降低(P<0.05)。
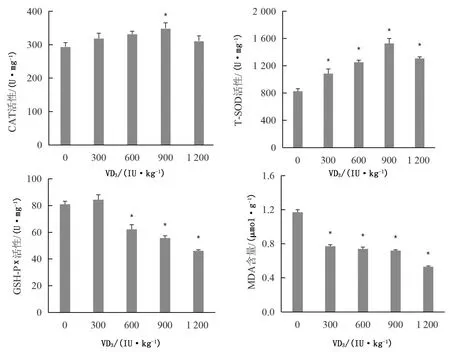
图2 VD3对绵羊肝脏抗氧化性能的影响
由图3可知,添加300,900,1 200 IU/kg VD3时,肾脏中T-SOD的活性显著升高(P<0.05);添加300 IU/kg VD3时,GSH-Px活性显著升高(P<0.05);添加300,600 IU/kg VD3时,MDA含量显著降低(P<0.05)。
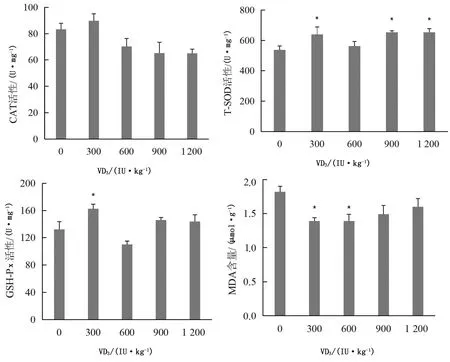
图3 VD3对绵羊肾脏抗氧化性能的影响
由图4可知,绵羊饲粮中添加900 IU/kg VD3时,脾脏CAT活性显著降低(P<0.05);添加300,600,900,1 200 IU/kg VD3时,T-SOD活性显著升高(P<0.05),MDA含量显著降低(P<0.05);添加300,600 IU/kg VD3时,GSH-Px活性显著升高(P<0.05);添加900,1 200 IU/kg VD3时,GSH-Px活性显著降低(P<0.05)。

图4 VD3对绵羊脾脏抗氧化性能的影响
由图5可知,绵羊饲粮中添加900 IU/kg VD3时,胸腺CAT活性显著降低(P<0.05);添加600,900,1 200 IU/kg VD3时,T-SOD活性极显著降低(P<0.01);添加300,600,900,1 200 IU/kg VD3时,GSH-Px活性极显著升高(P<0.01),MDA含量极显著降低(P<0.01)。

图5 VD3对绵羊胸腺抗氧化性能的影响
由图6可知,饲粮中添加300 IU/kg VD3时,肠系膜淋巴结CAT和GSH-Px活性显著升高(P<0.05),T-SOD活性极显著升高(P<0.01);添加900 IU/kg VD3时,T-SOD活性显著升高(P<0.05);添加300,600,900,1 200 IU/kg VD3时,MDA含量显著降低(P<0.01)。
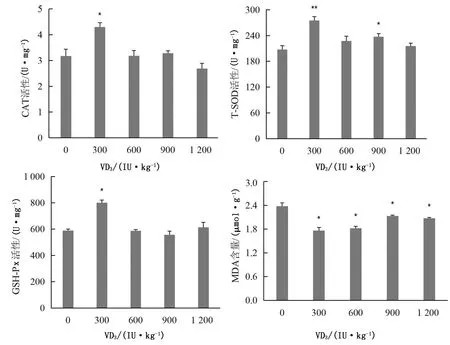
图6 VD3对绵羊肠系膜淋巴结抗氧化性能的影响
2.2 VD3对绵羊各组织细胞凋亡的相关基因及VDR表达的影响由图7可知,绵羊饲粮中添加300 IU/kg VD3时,肝脏VDR表达量显著降低(P<0.05),Bcl-2表达量显著升高(P<0.05);添加600 IU/kg VD3时,肝脏Caspase-9、VDR、Bcl-2和BAX表达量显著(P<0.05)或极显著(P<0.01)升高;添加900,1 200 IU/kg VD3时,Caspase-3、Caspase-9、VDR、Bcl-2和BAX表达量显著或极显著升高(P<0.05或P<0.01)。

图7 VD3对绵羊肝脏凋亡相关基因及VDR表达的影响
由图8可知,绵羊饲粮中添加300 IU/kg VD3,肾脏Caspase-9、VDR和BAX表达量显著降低(P<0.05);添加600 IU/kg VD3时,Caspase-3、Caspase-9、VDR和BAX表达量显著(P<0.05)或极显著(P<0.01)升高;添加900,1 200 IU/kg VD3时,Caspase-9和BAX表达量显著(P<0.05)或极显著(P<0.01)升高,Bcl-2表达量极显著降低(P<0.01);添加900 IU/kg VD3时,VDR表达量显著(P<0.05)升高。
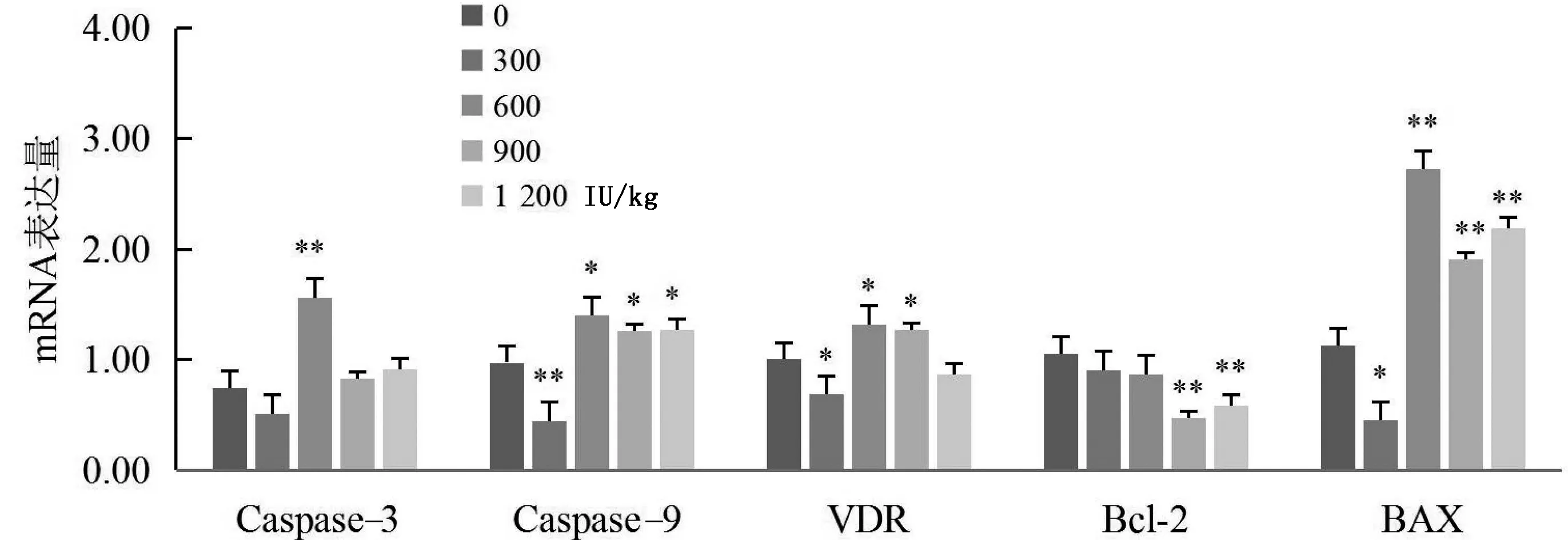
图8 VD3对绵羊肾脏凋亡相关基因及VDR表达的影响
由图9可知,绵羊饲粮中添加300 IU/kg VD3,脾脏Caspase-9和VDR表达量显著(P<0.05)或极显著(P<0.01)降低,Bcl-2表达量极显著(P<0.01)升高;添加600,900 IU/kg VD3,Caspase-3、Caspase-9和BAX表达量极显著(P<0.01)升高;添加1 200 IU/kg VD3,Caspase-9、Bcl-2和BAX含量显著(P<0.05)或极显著(P<0.01)升高。

图9 VD3对绵羊脾脏凋亡相关基因及VDR表达的影响
由图10可知,绵羊饲粮中添加300 IU/kg VD3时,胸腺VDR表达量极显著降低(P<0.01),Bcl-2表达量显著升高(P<0.05);添加600 IU/kg VD3,Caspase-3、Bcl-2和BAX表达量极显著升高(P<0.01);添加900,1 200 IU/kg VD3,Caspase-3、VDR、Bcl-2表达量显著(P<0.05)或极显著(P<0.01)升高;添加900 IU/kg VD3,BAX的表达量显著(P<0.05)升高。

图10 VD3对绵羊胸腺凋亡相关基因及VDR表达的影响
由图11可知,绵羊饲粮中添加300 IU/kg VD3,肠系膜淋巴结Bcl-2的表达量极显著升高(P<0.01);添加600,900,1 200 IU/kg VD3,Caspase-3、Caspase-9、VDR、Bcl-2和BAX的表达量均极显著(P<0.01)升高。
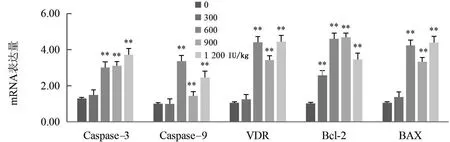
图11 VD3对绵羊肠系膜淋巴结凋亡相关基因及VDR表达的影响
2.3 VD3对绵羊各组织TUNEL染色的影响由图12可知,饲粮中添加600 IU/kg VD3,肝脏汇管区可见较多的凋亡细胞,且MOD值显著升高(P<0.05)。
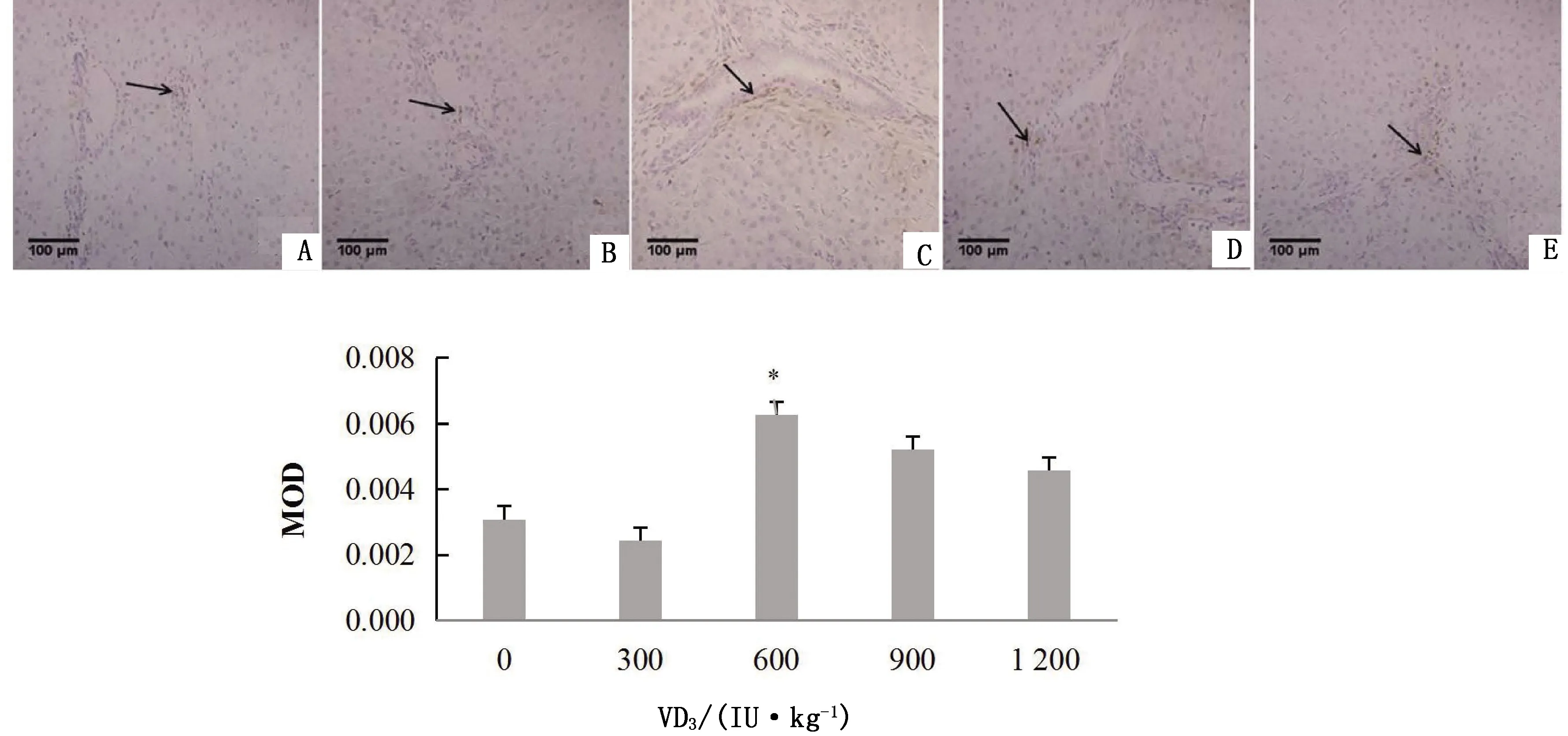
A.对照组; B~E.试验组,VD3添加水平分别为300,600,900,1 200 IU/kg。注:MOD即为mean optical density的缩写,代表平均光密度。下同图12 VD3对绵羊肝脏细胞凋亡的影响以及MOD值分析(400×)
由图13可知,饲粮中添加900,1 200 IU/kg VD3,肾小球周围可见较多的凋亡细胞,添加600和1 200 IU/kg VD3,MOD值相对于对照组显著(P<0.05)升高。
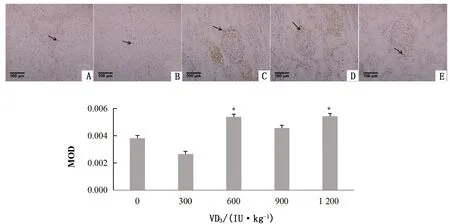
A.对照组; B~E.试验组,VD3添加水平分别为300,600,900,1 200 IU/kg图13 VD3对绵羊肾脏细胞的凋亡影响以MOD值分析(400×)
由图14可知,饲粮中添加600,900,1 200 IU/kg VD3,绵羊脾脏可见有较多的凋亡细胞,MOD值显著升高(P<0.05)。
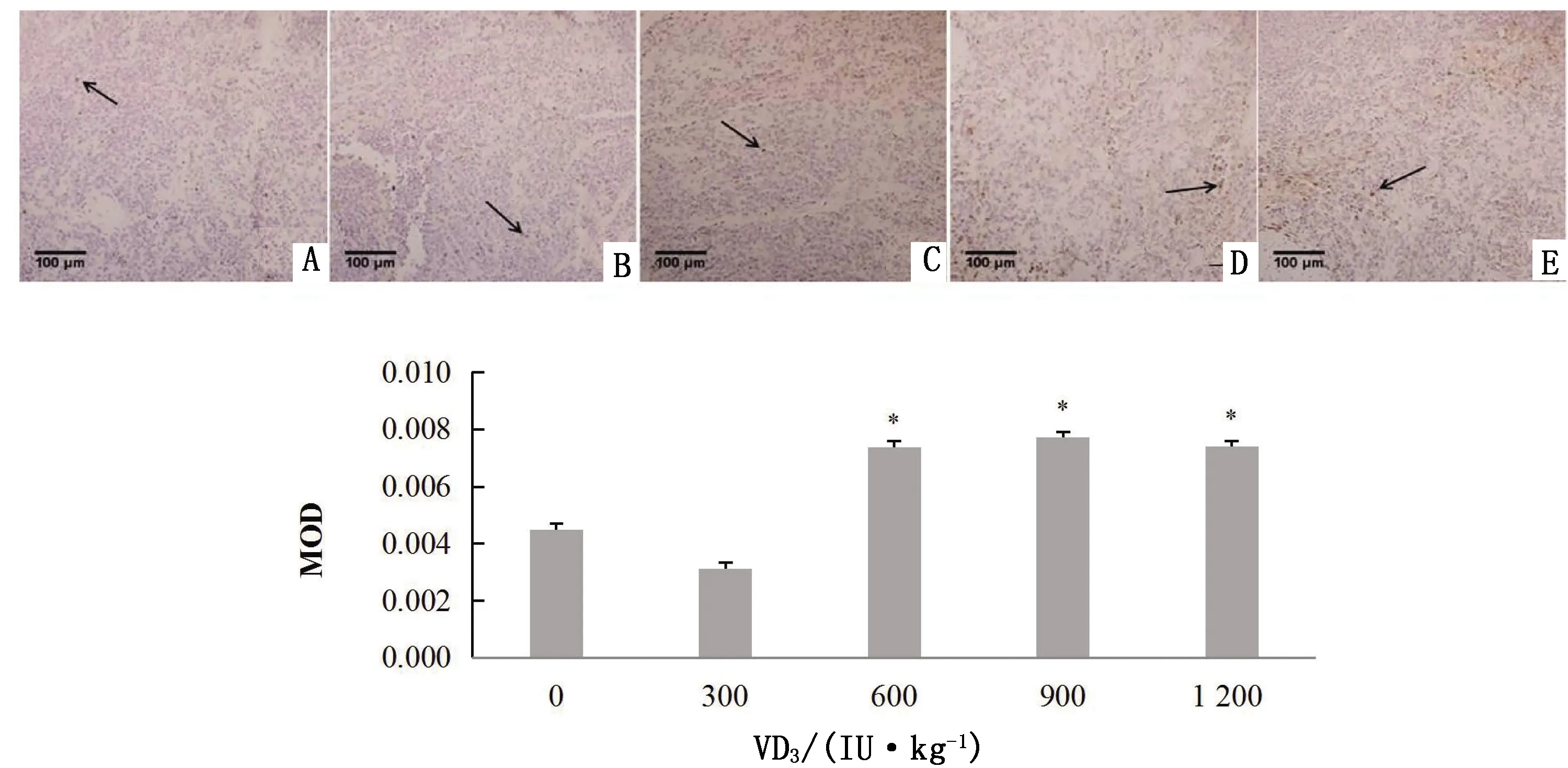
A.对照组; B~E.试验组,VD3添加水平分别为300,600,900,1 200 IU/kg图14 VD3对绵羊脾脏细胞凋亡的影响以及MOD值分析(400×)
由图15可知,绵羊饲料中添加600 IU/kg VD3,胸腺可见较多的的凋亡细胞,添加600,900,1 200 IU/kg VD3,胸腺MOD值显著升高(P<0.05)。

图15 VD3对绵羊胸腺细胞凋亡的影响以及MOD分析(400×)
由图16可知,绵羊饲料中添加600,900,1 200 IU/kg VD3,肠系膜淋巴结可见较多的凋亡细胞,MOD值显著升高(P<0.05)。

图16 VD3对绵羊肠系膜淋巴细胞凋亡的影响以及MOD值分析(400×)
3 讨论
3.1 VD3对绵羊各组织抗氧化性能的影响氧化应激的主要表现是脂质过氧化和活性氧(ROS)生成过多,CAT和GSH-Px等抗氧化酶活性不足[3]。GSH-Px是一种重要的抗氧化酶,与自由基的清除密切相关。MDA是脂质过氧化产物,其含量可反映自由基的水平[9]。袁丽伟等[10]发现,VD3能够降低机体的氧化应激水平,提高GSH-Px和还原酶类活性,提高抗氧化能力[11]。本试验结果表明,饲粮中添加VD3后,试验组绵羊血清和各组织的GSH-Px和T-SOD活性显著升高,MDA含量显著降低,关于VD3添加量对肾脏和血清T-SOD的影响本课题组已有相关报道[1]。王帅等[12]的试验也表明,VD3可以改善绵羊各肠段的CAT、T-SOD、GSH-Px活性及MDA的含量,从而提高了绵羊的抗氧化能力,与本试验结果类似。有文献表明,在其他物种饲粮中添加适量VD3也会有类似的抗氧化效果。在黑鱼饮食中添加适当含量的VD3可以增加T-SOD,CAT,GSH-Px的活性,MDA含量显著降低,改善了总抗氧化能力[13]。张淑云等[8]研究发现,随VD3添加水平的增加,生长肉鸡血清和肝脏T-SOD和GSH-Px的活性得以升高,MDA含量降低。李向等[14]研究发现,适量VD3可以显著提高机体肝脏的CAT和T-SOD活力。邢月等[15]研究表明,饲粮中添加VD3可以使产蛋种鹅SOD和GAH-PX活力显著增强。但维生素的添加量适合才会达到最佳效果,含量太少效果不显著,但维生素的过量可能会适得其反,王帅等[12]研究表明VD3添加量为300,600 IU/kg时肠道抗氧化效果最佳,与本实验研究结果一致。张淑云等[8]研究指出,生长肉鸡血清各抗氧化能力与VD3的添加量无显著的相关关系,李万佳等[16]研究发现,饲粮中VD3添加水平对生长獭兔血清的抗氧化能力可产生极显著影响,且随VD3添加水平的增加呈现先升高后降低的趋势。这些研究结果表明,饲料中添加适量的VD3有助于降低机体的氧化应激,改善其抗氧化能力,最佳添加剂量可能会因为物种而有所不同。
3.2 VD3对绵羊各组织细胞凋亡的影响细胞凋亡是一种不可逆的细胞死亡过程,这一事件主要由Cyt C介导的内源性线粒体通路和细胞表面死亡受体介导的外源性通路介导[17],Bcl-2家族是内源性凋亡途径的主要调控者[18]。研究表明,VD3可以通过抑制抗凋亡蛋白的表达或诱导促凋亡蛋白的表达来影响细胞凋亡,师朗等[19]的研究结果表明,VD3对于细胞凋亡及自噬功能的维持具有重要作用,其可通过上调VDR水平增强自噬活性。本试验结果表明,饲料中添加300 IU/kg VD3时,试验组绵羊肝脏、脾脏、胸腺组织的VDR表达水平相对于对照组显著降低,Bcl-2表达量相对于对照组显著升高,而Caspase-3、Caspase-9和BAX的表达量均有不同程度的降低,表明VD3通过调控VDR的表达诱导Bcl-2的表达,通过抑制Caspase-3、Caspase-9表达抑制细胞凋亡。有文献表明,在其他物种和组织中VD3也具有类似的效果,如:刘华等[20]的研究表明,VD3可抑制乳腺癌细胞及乳腺癌干细胞活力,诱导乳腺癌细胞凋亡[21];LEE等[22]研究发现VD3可增加BAX的表达,降低Bcl-2的表达;VDR能抑制大鼠肾小管上皮细胞增殖,诱导其凋亡[23]。然而,VD3的过量添加反而会适得其反,正如本试验,添加高剂量VD3时,绵羊各组织凋亡相关基因和VDR的表达量相对升高,Bcl-2的表达量相对降低,且各组织的凋亡程度和MOD值普遍升高,而添加量达到600,900,1 200 IU/kg时,绵羊部分组织凋亡基因和促凋亡基因均有所升高的现象,其作用机理有待进一步研究。以上研究说明VD3可通过调节VDR的表达调控相关凋亡基因的表达进而诱导细胞凋亡,且适量的VD3(本试验为300 IU/kg)可以抑制免疫相关细胞的凋亡,从而使机体的免疫力得以改善。

