酮病奶牛中性粒细胞脱颗粒增强与系统性炎性反应
姜 尚,李心慰,王 哲,刘国文,宋玉祥 (吉林大学 动物医学学院,吉林 长春 130062)
围产期奶牛处于能量负平衡(NEB)状态,导致脂肪过度动员,使得循环中游离脂肪酸(FFAs)浓度增加[1]。过量的FFAs在肝脏中蓄积,经不完全氧化生成酮体(主要为β-羟基丁酸,BHB),引发酮病。其中亚临床酮病的平均发病率约为24.1%,高于临床酮病[2]。酮病奶牛存在全身系统性炎症,其特征是促炎细胞因子和急性期蛋白(APP)在血液中的水平升高[3]。酮病奶牛的系统性炎性反应会增加乳腺炎、子宫内膜炎和蹄叶炎等其他炎症性疾病的发病率,进一步加剧其带来的经济损失[4]。然而,酮病奶牛发生全身系统性炎症的潜在原因尚不清楚。
中性粒细胞(PMN)是固有免疫的第一道防线,在血液白细胞中的占比最大,并且最先募集到局部炎症部位发挥作用。PMN在炎性反应放大中起着重要作用,其过度活化会导致局部和系统性炎性反应[5]。PMN富含多种包裹着丰富的生物酶的颗粒,其中髓过氧化物酶(MPO)是嗜天青颗粒(AGs)中含量最高的蛋白酶,其通过AGs脱颗粒释放到细胞外后作为一种多功能促炎因子发挥作用,促进炎症的发生发展[6-7]。
因此,本试验通过对比健康和酮病奶牛血液PMN的AGs的脱颗粒水平,并分析其与系统性炎性反应的相关性,尝试解释酮病奶牛系统性炎性反应的发生原因,为围产期奶牛酮病及其继发的炎症性疾病的防治提供一定的理论基础。
1 材料与方法
1.1 实验动物与样品采集所有实验动物来自于吉林省长春市某奶牛养殖场。选取胎次(2~4胎次),泌乳时间(产后3周内)相近的奶牛。所有筛查的奶牛都接受常规体检,确保没有临床症状。根据牛奶酮粉检测阳性结果筛选疑似酮病奶牛。随后检测血液BHB浓度,选择15头酮病(BHB>3 mmol/L)奶牛和15头对照(BHB<1.2 mmol/L)奶牛。所有被选中的奶牛都被安置在一个气候可控的谷仓内,并有单独的铁栏,以减少环境干扰。每天在08:00 和15:30时挤奶,根据连续3 d的数据计算每头奶牛的平均产奶量。奶牛可以随意获得同样的食物,淡水也可以持续供应。根据连续3 d内喂食和剩余的饲料计算各组的平均干物质采食量(DMI)[8]。喂食前(6:30~07:30)从颈静脉采集血样,连续5 d。为了获得血清,血样在室温下保存30 min,然后4℃,3 000 r/min离心10 min,收集血清,立即储存于-80℃。
1.2 主要仪器与试剂D-37520低温高速离心机购自德国Thermo Fisher公司;CO2细胞培养恒温箱购自日本三洋公司;通用型电泳仪购自美国Bio-Red公司;流式细胞仪购自美国Becton Dickinson公司;使用日立7170自动分析仪及商用试剂盒(FFAs:目录号FA115;BHB:目录号RB1008;GLU:目录号GL3815;Randox Laboratories)测定采集血清中FFAs、BHB和葡萄糖浓度;外周血PMN提取试剂盒(目录号:LZS1094)购自天津灏洋生物公司;RPMI-1640培养基(目录号:SH30809.01)购自美国Hyclone Laboratories公司;MPO抗体(目录号:LS-C663612-100)购自美国LifeSpan BioSciences公司;β-actin抗体(目录号:Ab8226)购自英国Abcam公司;CH138A抗体(目录号:WSC0608B-100)购自美国Kingfisher Biotech公司;CD63抗体(目录号:ABIN6254234)购自德国Antibodies online GmbH公司;PE荧光二抗购自美国United States Biological公司;Alexa Fluor®488荧光二抗购自美国Thermo Fisher Scientific公司;FITC CD11b荧光抗体购自美国Novus Biologicals公司。
1.3 血清炎性因子检测以下使用的ELISA试剂盒均购自美国LifeSpan BioSciences公司。严格按照说明书操作,使用牛特异性ELISA试剂盒(HP:目录号LS-F13229;SAA:目录号LS-F12552)测定血清中结合珠蛋白(HP)和血清淀粉样蛋白A(SAA)的质量浓度。试剂盒对HP和SAA的敏感性分别为7.8,3.12 μg/L。使用牛特异性ELISA试剂盒(IL-1β:目录号LS-F7588;IL-6:目录号LS-F9752;IL-8:目录号LS-F6143;TNF-α:目录号LS-F5014)测量血清中白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、白细胞介素-8(IL-8)和肿瘤坏死因子-α(TNF-α)的质量浓度。IL-1β、IL-6、IL-8和TNF-α的试剂盒敏感性分别为6.5,0.46,26.1,3.1 ng/L。使用牛特异性ELISA试剂盒(MPO:目录号LS-F6445)测定血清中MPO的质量浓度。MPO试剂盒灵敏度为0.64 μg/L。
1.4 外周血PMN分离试验应用商用试剂盒分离外周血PMN,其分离原理为密度梯度离心。严格按照说明书操作,在离心管中依次缓慢加入2种不同悬浮密度的A液和C液,体积比为2∶1,使其形成分离液面,然后加入相同体积的新鲜抗凝血液,在室温下800×g离心30 min,取PMN层加入到无菌离心管中,加入洗涤液,摇匀后,1 000×g离心10 min,弃掉上清后加入红细胞裂解液重悬, 5 min后, 1 000×g离心10 min,弃掉上清,用RPMI-1640培养基重悬洗涤PMN 2次。获得的PMN纯度约为97.5%,细胞活力约为95%(台盼蓝染色法)。提取出PMN后进行免疫印迹试验或流式细胞术试验。
1.5 蛋白质的提取和蛋白免疫印迹使用商用蛋白质提取试剂盒(目录号:C510003,生工生物技术有限公司),严格按照说明书操作,从PMN中提取蛋白质。通过BCA试剂盒(目录号:P1511,普利莱有限公司)测量所提蛋白的质量浓度。计算调整蛋白的质量浓度后,加入蛋白上样缓冲液, 95℃加热5 min 使蛋白变性;每孔上样30 μg总蛋白质到12%的SDS-PAGE分离胶中,80 V电泳30 min,然后120 V电泳60 min;根据所需蛋白的相对分子质量切取胶条,通过湿转法(120 V,45 min)将蛋白质转移到0.45 μm PVDF膜上;将PVDF膜置于3%的BSA中,在摇床上常温封闭3 h,把封闭后PVDF膜浸没于用TBST溶液 1∶1 000稀释的一抗中,4℃孵育过夜;将一抗孵育后的PVDF膜用TBST溶液清洗3次,每次6 min。然后加入二抗,常温孵育45 min;将二抗孵育后的PVDF膜用TBST溶液清洗3次,每次6 min;将PVDF膜放在显影仪中,膜上均匀滴涂ECL显影液,曝光,检测蛋白含量。
1.6 流式细胞术测定PMN AGs脱颗粒在室温下用4%多聚甲醛固定PMN 20 min,洗去固定液,将细胞与稀释浓度均为1∶100的CH138A抗体(一种特定的奶牛PMN标记物)和CD63抗体(一种特定的奶牛AGs标记物)一起孵育30 min;然后用4℃ PBS冲洗2次;将细胞与PE标记的抗小鼠荧光二抗、Alexa Fluor®488标记的抗山羊荧光二抗和FITC标记的CD11b抗体一同孵育30 min;用4℃的PBS冲洗细胞2次;最后,使用流式细胞术通过测量PMN膜CD63的水平来检测AGs的脱颗粒水平。
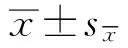
2 结果
2.1 对照组奶牛和酮病奶牛临床参数和能量代谢指标的比较如表1所示,与对照组相比,酮病组奶牛的DMI和产奶量较低(P<0.01)。酮病奶牛血清BHB和FFAs升高(P<0.01)。相反,酮病奶牛的血糖(GLU)较低(P<0.01)。表明酮病奶牛存在能量负平衡,表现为血清高FFAs、高BHB和低GLU。
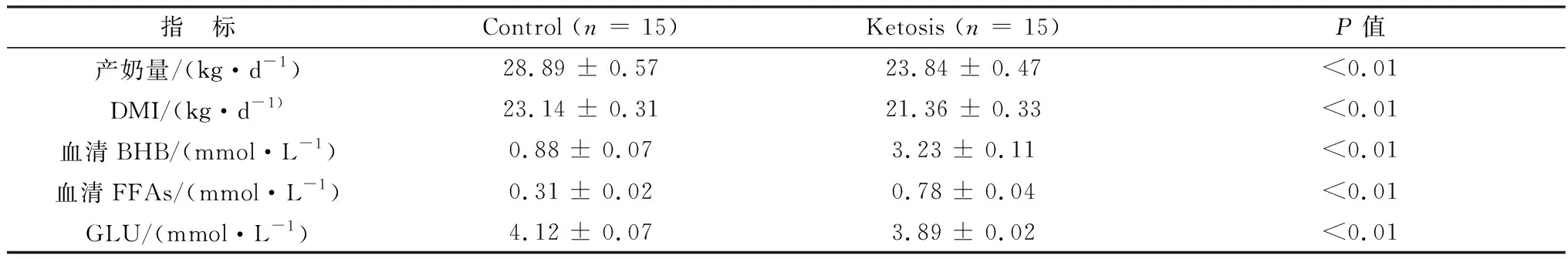
表1 健康和酮病奶牛临床参数和能量代谢指标比较
2.2 对照组奶牛和酮病奶牛炎症指标的比较与对照组相比,酮病组奶牛血清中HP和SAA的浓度更高(P<0.01)(图1A,B)。酮病奶牛血清促炎细胞因子质量浓度增加(P<0.01),包括IL-1β、IL-6、IL-8和TNF-α(图1C~F),同时血清中MPO质量浓度升高(P<0.01)(图1G)。
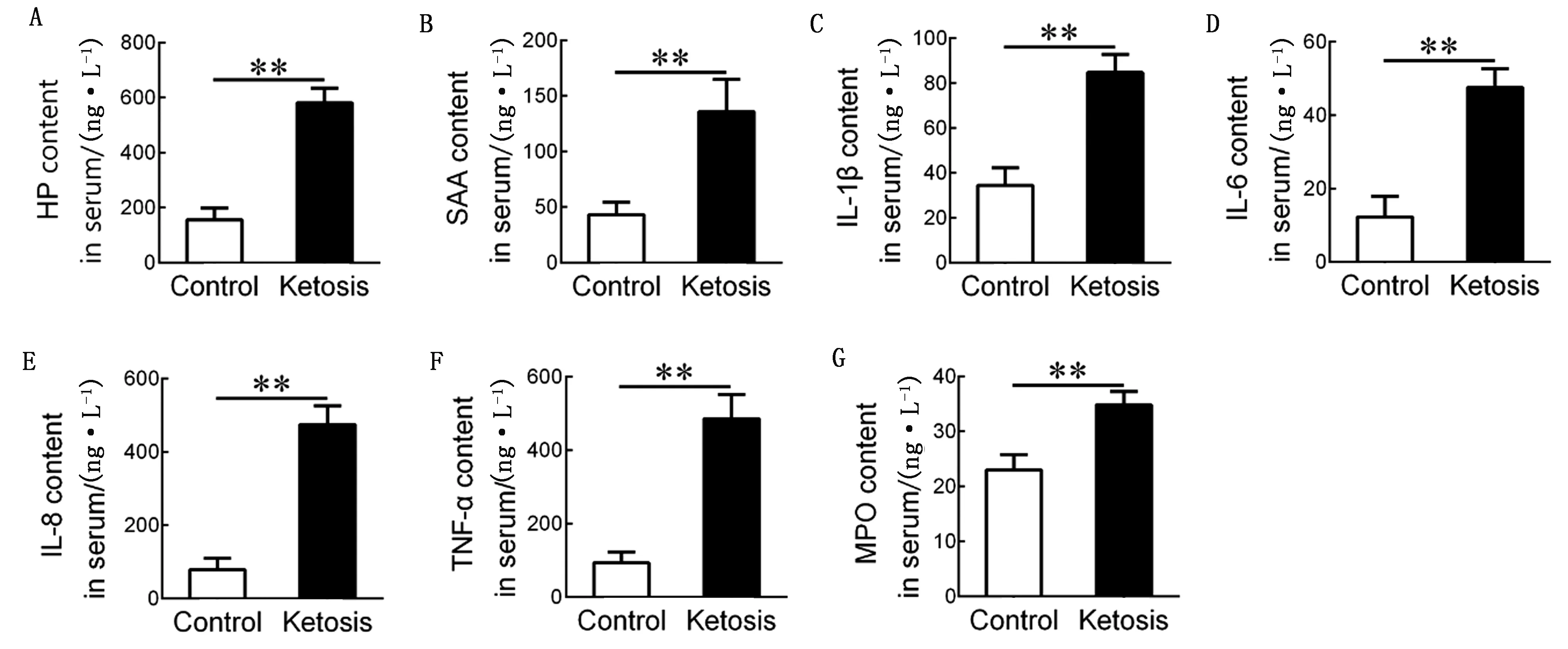
A,B.血清中HP和SAA的含量;C~F.血清中IL-1β、IL-6、IL-8和TNF-α的含量;G.血清中MPO的含量。**P<0.01图1 对照组(n=15)和酮病(n=15)奶牛的血清炎症指标
并且,HP、SAA、IL-1β、IL-6、IL-8和TNF-α与血清MPO均呈强正相关(表2),表明酮病奶牛存在系统性炎症反应,且血清MPO与血清中的炎性因子呈现正相关。

表2 炎性因子与血清MPO的相关性分析
2.3 对照组奶牛和酮病奶牛PMN AGs脱颗粒作用的比较与对照组相比,酮病奶牛血液中分离的PMN内MPO蛋白含量较低(P<0.01,图2A,B)。通过流式细胞术检测发现,酮病奶牛的CH138A+/CD63highPMN百分比较高(P<0.01),图2C,D)。同样,酮病奶牛PMN中CD63(AGs脱颗粒标志物)的平均荧光强度(MFI)升高(P<0.01,图2E),表明酮病奶牛PMN AGs脱颗粒作用增强。
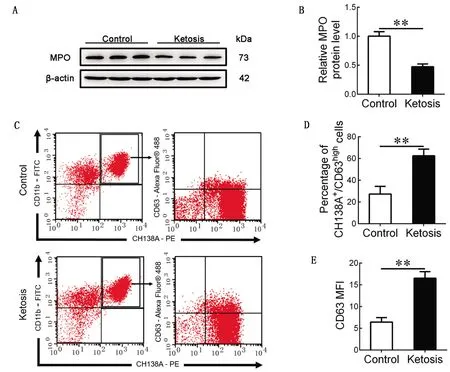
A.对照组和酮病奶牛PMN内MPO的蛋白质水平(每组的3条带分别代表来自各组的3个奶牛样本);B.A中MPO蛋白水平的量化;C.流式细胞术分析正常和酮病奶牛PMN膜CD63水平;D.PMN中CH138A+/CD63high细胞百分比定量分析结果;E.对照组和酮病奶牛PMN中CD63 MFI的定量分析结果。**P<0.01图2 对照组(n=15)和酮病组(n=15)奶牛PMN中AGs的脱颗粒
3 讨论
围产期奶牛的酮症是一种核心能量代谢紊乱疾病,伴有系统性炎性反应[9]。然而这种系统性炎性反应的发生机制尚不清楚。本研究确证了酮病奶牛的系统性炎性反应的发生。酮病奶牛出现血清促炎细胞因子(包括IL-1β和IL-6)以及急性期蛋白APP(包括HP和SAA)质量浓度的增加[3, 10]。这些系统性促炎介质可以降低食欲,引起肝损伤,增加免疫系统的能量消耗,从而加重奶牛的NEB状态[11-12]。系统性炎性反应也会增加奶牛患其他炎症性疾病的风险,包括乳腺炎、子宫内膜炎和蹄叶炎[13]。例如,与健康奶牛相比,酮病奶牛的子宫内膜炎和层黏连炎的发病率分别高出2倍和5倍[14]。本研究发现,酮病奶牛的血清MPO及其他促炎介质IL-1β、IL-6、IL-8、TNF-α、HP和SAA水平均显著升高。MPO是PMN AGs脱颗粒的特异性标记物,本研究进一步发现奶牛血清MPO含量与HP、SAA、IL-1β、IL-6、IL-8和TNF-α的含量均呈正相关。在已有的小鼠试验中,MPO的大量释放会导致炎性小体的过度激活从而导致严重的系统性炎性反应,通过添加脱颗粒抑制剂能有效抑制因MPO引起的系统性炎性反应[15]。MPO敲除小鼠与皮肤中IL-1β含量降低有关[16]。在体外用TNF-α刺激奶牛PMN,细胞上清液中分泌出更多的MPO[17],表明MPO和促炎细胞因子之间可能存在相互放大网络。综上所述,酮病奶牛PMN的AGs脱颗粒增强导致MPO等促炎介质向胞外释放增多与其系统性炎性反应的发生密切相关。
相比健康奶牛,酮病奶牛具有高FFAs血症特征。FFAs具有脂毒性,其可通过激活NF-κB和NLRP3等炎性信号通路导致局部和系统性炎症[18-20]。在免疫水平上,FFAs可损害先天性和适应性免疫细胞的功能[21],并且与酮病奶牛血液促炎细胞因子水平升高有关[22]。静脉输注FFAs可使人血浆MPO水平增加2倍[23],这一事实表明FFAs与PMN的AGs脱颗粒之间存在潜在关系。因此酮病奶牛血液高浓度的FFAs可能是诱发PMN的AGs脱颗粒增强的原因之一,然而该假设尚需进一步的研究来证实。
总之,本研究表明,酮病奶牛存在系统性炎性反应,该系统性炎性反应与PMN的AGs脱颗粒增强有关。本研究为围产期酮病奶牛全身系统性炎症的发生机制提供了新视野,为其防治提供了一定的理论基础。

