天麻中酚类成分对心脑血管疾病的药理作用研究进展
全毅恒,上官晨虹,陈 琛*
天麻中酚类成分对心脑血管疾病的药理作用研究进展
全毅恒1, 2,上官晨虹1, 2,陈 琛1, 2*
1. 陕西省天麻山茱萸工程技术研究中心,陕西理工大学中德天然产物研究所,陕西 汉中 723000 2. 陕西理工大学生物科学与工程学院,陕西省资源生物重点实验室,陕西 汉中 723000
天麻具有息风止痉、平抑肝阳、祛风通络的功效,含有天麻素、天麻苷元、天麻多糖等主要成分。总结了天麻中的主要酚类成分,阐明了天麻素、对羟基苯甲醇、巴利森苷、香草醛等酚类成分对心脑血管疾病如缺血性脑损伤、血管性痴呆、缺血性心肌损伤、高血压、动脉粥样硬化、血凝血栓、炎症等的药理作用,探讨了天麻酚类成分通过抗氧化、调节功能性蛋白表达、抗凋亡、抗炎等机制治疗心脑血管疾病的作用机制,为天麻酚类成分的深入研究提供参考和依据。
天麻;天麻素;对羟基苯甲醇;巴利森苷;心脑血管疾病
天麻Blume是兰科天麻属腐生草本植物[1],中药材中天麻指其干燥块茎[2],原名赤箭,在《神农本草经》中被定义为味甘,性平,归肝经的上品中药[3]。天麻对多种疾病如惊厥[4]、癫痫[5]、精神障碍[6]、健忘症[7]、脑血管疾病[8]、炎症[9]和代谢性疾病[10]等具有治疗或抑制作用。酚类是芳烃的含羟基衍生物,广泛分布于植物界,是植物中含量最丰富的次生代谢物,目前已知的酚类结构有8000多种[11]。天麻多酚的强抗氧化性能和在心脑血管疾病方面的显著作用使其备受关注。天麻中主要酚类成分如天麻素[12]、天麻苷元、香草醛、巴利森苷等已被分离鉴定。天麻中酚类化合物或提取物的鉴定和开发已成为天麻在健康和医学相关研究的主要领域[13]。心脑血管疾病在中老年人中的发病率愈来愈高,人口老龄化与不规律的饮食作息是其病因。天麻被证实在心脑血管疾病等多种中老年疾病中有良好作用[6]。本文主要综述了近10年天麻中酚类成分对心脑血管疾病的药理作用及机制的研究进展,旨在为天麻中酚类成分的深入研究提供参考依据。
1 天麻中酚类成分
天麻含有多种天然活性成分,目前已被分离确定的有酚类、多糖类、甾醇类、有机酸类以及其他参与人体代谢的物质[13]。酚类物质在天麻中种类、含量最多,通常被认为是天麻发挥药理及治疗作用的主要成分[14],其具有较好的抗氧化活性,许多研究都集中在天麻酚类成分的分离鉴定及药理药效评价上[15]。
天麻素是天麻的主要活性成分之一,是对羟基苯甲醇取代C-4位葡萄糖形成的吡喃葡萄糖苷,也是天麻质量控制的成分之一,其具有吸收迅速、半衰期短、代谢速度快、生物毒性小等特点,可快速透过血脑屏障进入脑内发挥作用。天麻苷元为天麻素在体内的代谢产物,其化学名称为对羟基苯甲醇,天麻苷元相对天麻素具有更强的跨膜能力,更易通过血脑屏障且在肠道中更容易吸收。巴利森苷类化合物都具有由3分子天麻素和1分子柠檬酸缩合而成的酯类结构。此外,天麻中还有80余种酚类成分。天麻中的酚类活性成分可分为简单酚类(图1)、酚苷类(图2)、酚醛类(图3)、酚酸类、酚醚类、酚酮类、含硫酚类(图4)和含氮酚类(图5)。天麻中的酚类活性成分见表1。

图1 天麻中简单酚类的化学结构
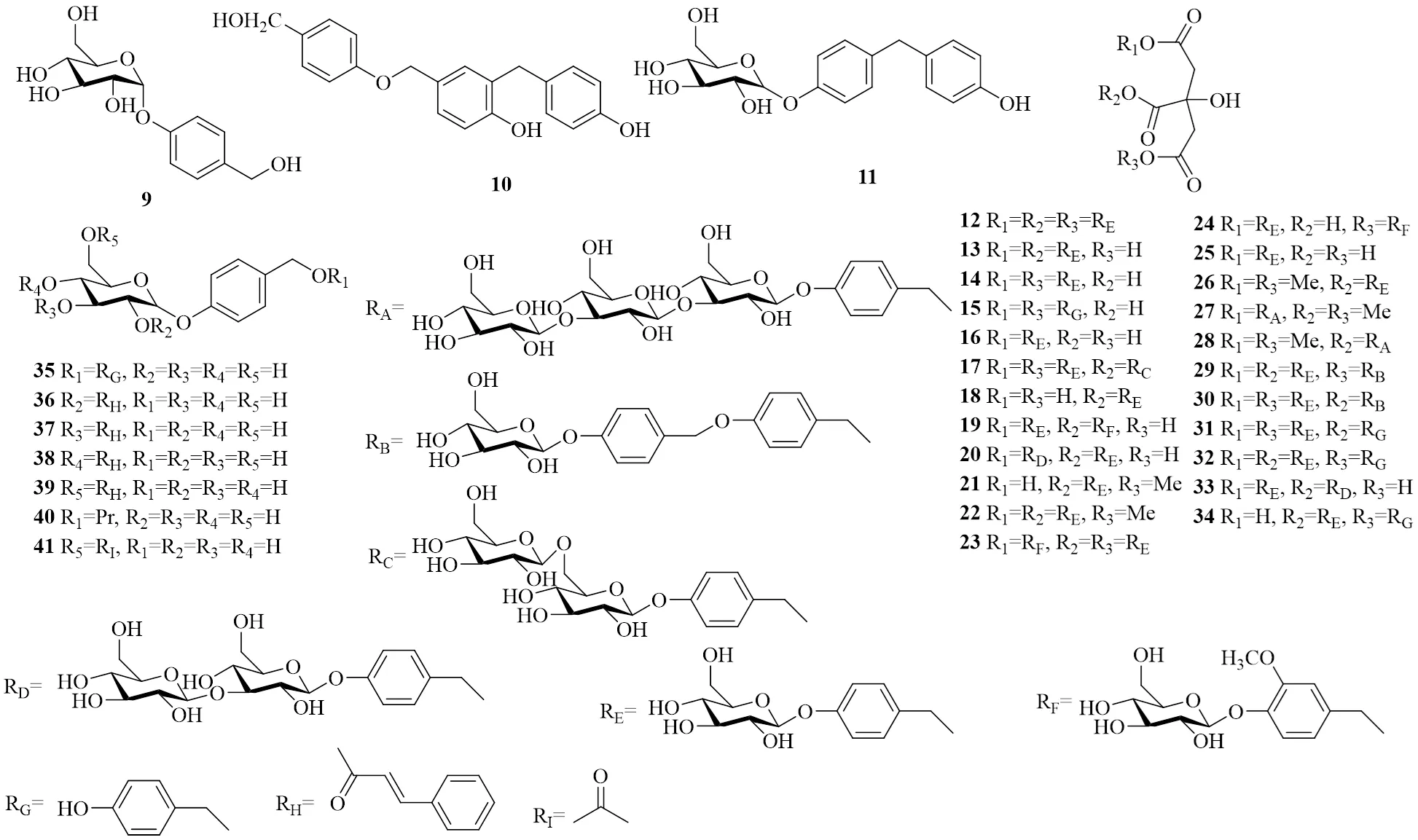
图2 天麻中酚苷类的化学结构
Fig. 2 Chemical structures of phenolic glycosides in

图3 天麻中酚醛类的化学结构
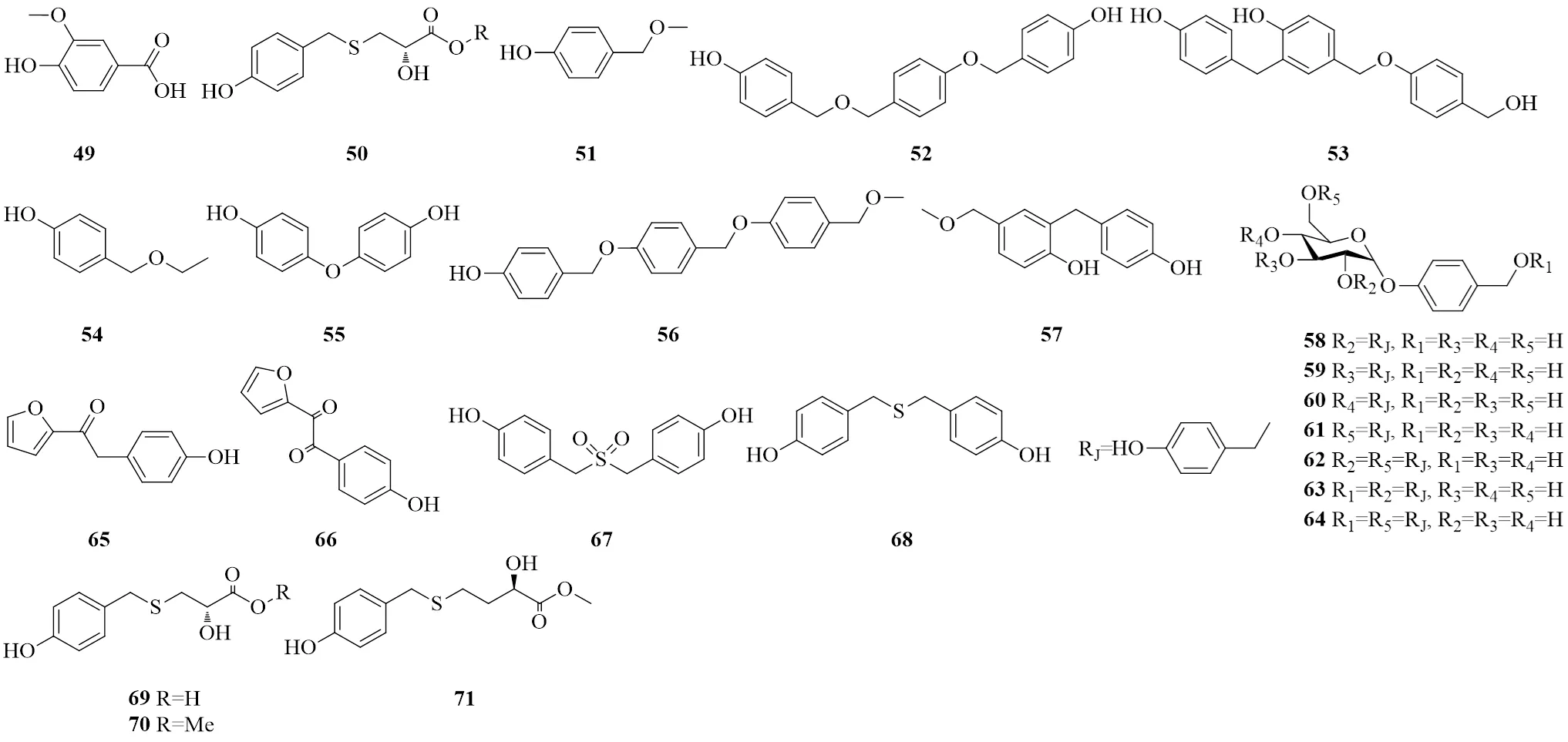
图4 天麻中的酚酸类、酚醚类、酚酮类和含硫酚类的化学结构
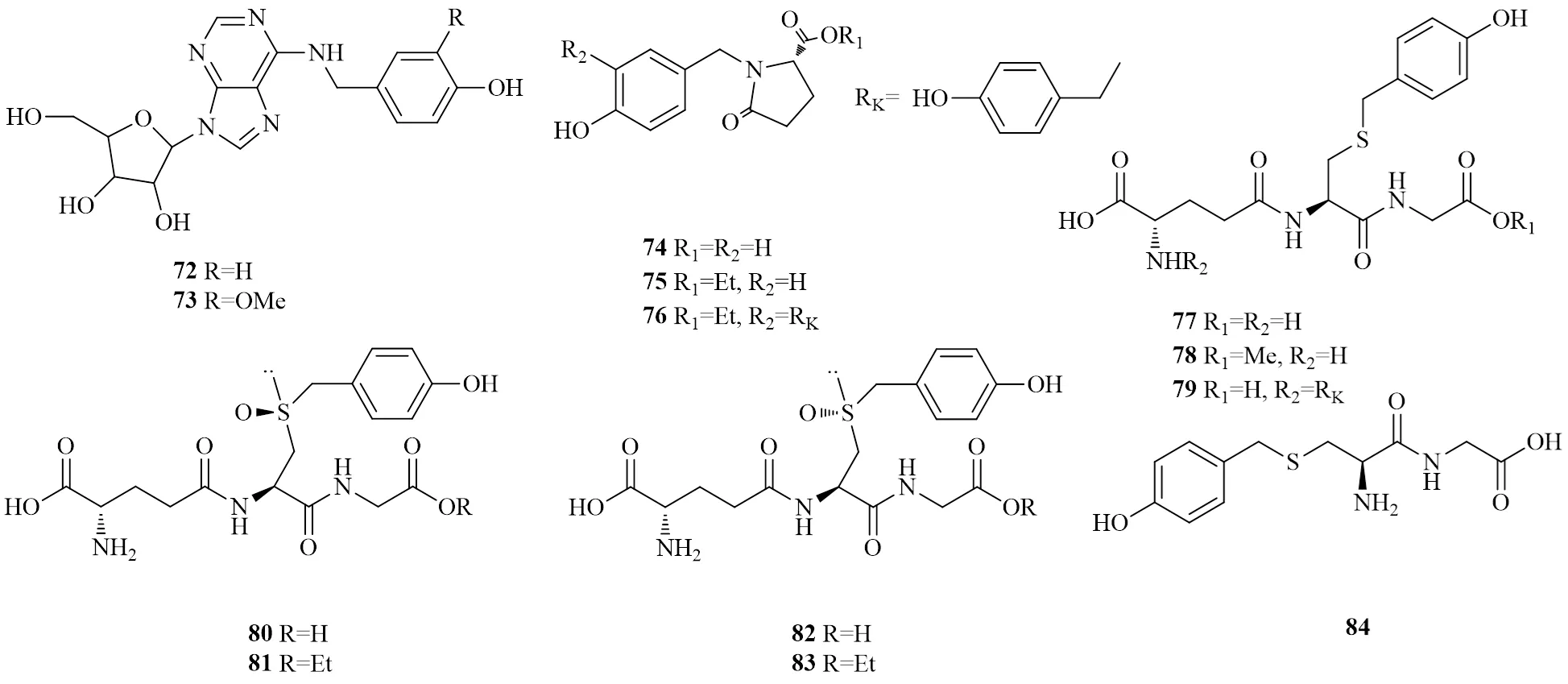
图5 天麻中含氮酚类的化学结构
表1 天麻中的酚类成分
Table 1 Phenolic compounds in G. elata
编号类别化学成分化学式相对分子质量文献 1简单酚类天麻苷元C7H8O2 124.13916 2香荚兰醇C8H10O3 154.16517 3苯甲醇C7H8O 108.14018 4(4-甲氧基苯基)甲醇C8H10O2 138.16617 54-丁氧基苯基甲醇C11H16O2 180.24717 62,4-双(4-羟基苄基)苯酚C20H18O3 306.36119 74,4′-亚甲基联苯酚C13H12O2 200.23720 84,4′-联苯二酚C12H10O2 186.21021 9酚苷类天麻素C13H18O7 286.27822 10天麻素AC21H20O4 336.38723 11天麻素BC19H22O7 362.37824 12巴利森苷C45H56O25 996.91825 13巴利森苷BC32H40O19 728.65325 14巴利森苷CC32H40O19 728.65325 15巴利森苷DC20H20O9 404.37125 16巴利森苷EC19H24O13 460.38825 17巴利森苷FC51H66O301 159.05925 18巴利森苷GC19H24O13 460.38825 19巴利森苷HC33H42O20 758.67925 20巴利森苷IC38H50O24 890.79425 21巴利森苷JC20H26O13 474.41525 22巴利森苷KC33H42O19 742.68025 23巴利森苷LC46H58O261 026.94425 24巴利森苷MC33H42O20 758.67925 25巴利森苷NC21H28O13 488.44225 26巴利森苷OC21H28O13 488.44225 27巴利森苷PC33H48O23 812.72425 28巴利森苷QC33H48O23 812.72425 29巴利森苷RC52H62O261 103.04225 30巴利森苷SC52H62O261 103.04225 31巴利森苷TC39H46O20 834.77725 32巴利森苷UC39H46O20 834.77725 33巴利森苷VC38H50O24 890.79425 34巴利森苷WC26H30O14 566.51225 35双(4-羟基苄基)醚单-β-L-半乳糖苷C20H24O8 392.40426 361-O-(4-羟甲基苯氧基)-2-O-反式肉桂基-β-D-葡萄糖苷C22H24O8 416.42627 371-O-(4-羟甲基苯氧基)-3-O-反式肉桂基-β-D-葡萄糖苷C22H24O8 416.42627 381-O-(4-羟甲基苯氧基)-4-O-反式肉桂基-β-D-葡萄糖苷C22H24O8 416.42627 391-O-(4-羟甲基苯氧基)-6-O-反式肉桂基-β-D-葡萄糖苷C22H24O8 416.42627 40对乙氧基甲基苯基-O-β-D-葡萄糖苷C15H22O7 314.33428 416′-O-乙酰天麻C15H20O8 328.31717

续表1
2 对心脑血管疾病的药理作用
心脑血管疾病是心脏血管和脑血管疾病的统称,指因高血压、高血脂、动脉粥样硬化、凝血和血栓等所导致的心脏、大脑及全身组织发生的缺血性或出血性疾病。心脑血管疾病患病率、致残率和死亡率极高,居各种死因首位,全球每年高达1500万人死于该病,其对人类健康有极大威胁。
2.1 脑血管疾病
2.1.1 缺血性脑损伤 缺血性脑损伤是由脑血流量的短暂或永久性减少引起栓塞或局部血栓的形成导致大脑动脉闭塞或血流恢复后加重组织损伤引起的,其发病率、死亡率和致残率都居高不下。研究表明天麻可以清除炎症、抗氧化损伤、抑制细胞凋亡和上调神经保护基因,从而表现出降低脑组织含水量、脑梗死面积,提高神经行为评分等缺血性脑损伤保护作用[8,32-33]。天麻中酚类化合物具有抗氧化特性,能保护组织的基本成分免受羟基自由基的损伤[4]。
Liu等[32]通过大脑中动脉闭塞(middle cerebral artery occlusion,MACO)获得大鼠缺血再灌注(ischemia-reperfusion,I/R)模型,发现天麻素能抑制I/R诱导的白细胞介素-1β(interleukin-1β,IL-1β)的上调,抑制环氧合酶-2和诱导型一氧化氮合酶的表达,从而产生缺血性脑损伤保护作用;对羟基苯甲醇预处理增强了B细胞淋巴瘤-2(B-cell lymphoma-2,)基因的表达,并消除了半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,Caspase-3)等的凋亡级联[33],这显示其对I/R大鼠皮层和下皮层的脑梗死区域减小的显著作用,这些保护机制可能与其抗凋亡作用有关,表明天麻酚类成分能通过调节抗细胞凋亡的相关基因表达减少脑缺血过程中细胞的凋亡。
天麻中酚类成分能通过调节保护性基因以及诱导神经元存活、发育和功能的蛋白质表达水平保护脑内正常组织功能。研究发现[34],对羟基苯甲醇通过激活雌性I/R大鼠中核因子E2相关因子2(nuclear factor NF-E2-related factor 2,Nrf2)、蛋白二硫化物异构酶(protein disulfide isomerase,PDI)和神经营养因子的活性来保护脑损伤和行为障碍;在给大脑I/R大鼠iv对羟基苯甲醛25 mg/kg后,其整个同侧大脑、皮质和纹状体的脑损伤大小显著缩小[35],这说明对羟基苯甲醛增加了抗氧化蛋白编码基因的表达,对脑缺血后的脑损伤起到一定预防作用。向彬等[36]以大肠杆菌脂多糖诱导建立了小鼠小胶质BV-2细胞模型,对羟基苯甲醛通过在炎症过程中下调一氧化氮的产生和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的表达水平、提高IL-10和转化生长因子-β的表达水平来显示其抗炎活性,预防大鼠急性脑缺血后的神经炎症。
2.1.2 血管性痴呆 血管性痴呆是由脑血管疾病引起的常见痴呆症,全球人口的老龄化已成为一个重大的公共卫生挑战。在双侧颈动脉阻断法建立的I/R大鼠模型中,天麻素90 mg/kg通过降低海马区淀粉样蛋白β(amyloid β,Aβ)和微管相关蛋白Tau磷酸化的水平来抑制Aβ-Tau斑块的沉积[37],因此,天麻素通过抑制Aβ和Tau的异常磷酸化,改善双侧颈动脉阻断大鼠的认知功能障碍,改善血管性痴呆。
2.2 心血管疾病
2.2.1 缺血性心肌损伤 缺血性心肌损伤是由冠状动脉供血急剧减少或中断引起的,会对心肌造成较大损伤,天麻中的酚类成分对缺血后的心肌保护有较强的药理活性,研究表明天麻酚类成分主要通过增强心肌梗死细胞的清除、下调炎症因子、促进新血管生成和抗凋亡等途径起到对缺血性心肌损伤的保护作用。Fu等[38]通过左冠状动脉前降支结扎构建心肌I/R小鼠模型,发现天麻素能促进心肌细胞的自噬通量和消除功能障碍的线粒体缓解心肌缺血再灌注损伤。天麻素还能通过抑制核苷酸结合寡聚化结构域样受体家族pyrin结构域蛋白3[nucleotide-binding and oligomerization domain (NOD)-like receptors family pyrin-domain-containing 3,NLRP3]与Caspase-1通路抑制心肌微血管内皮细胞松弛,减少体内和体外IL-1β的产生[39],这有效地减轻了心肌梗死面积和炎性细胞浸润,增加了毛细血管的形成,从而对心肌缺血损伤产生保护作用。在缺氧/复氧环境更替建立的心肌细胞H9c2缺氧/复氧损伤模型中,Wang等[40]证实了巴利森苷类化合物对心肌细胞具有显著的抗凋亡作用,这一过程是通过下调胞浆中裂解的Caspase-3、细胞色素C和凋亡基因的水平,以及上调线粒体和Bcl-2中细胞色素C的水平来实现的。
2.2.2 高血压 高血压是大多数心脑血管疾病的主要发病因素,天麻酚类成分能有效降低血压。肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosteronesystem,RAAS)是人体中重要的血压调节机制,肾素会升高血压,而天麻素能降低自发性高血压大鼠模型血清中血管紧张素II和醛固酮水平,同时降低心肌血管紧张素II1型受体的mRNA表达水平,减少其蛋白合成[41],同时天麻素还增加了过氧化物酶体增殖物激活受体γ(peroxisome proliferators-activated receptor γ,PPARγ)蛋白合成相关的mRNA表达,PPARγ可能调节RAAS并具有降压作用,天麻素的降压机制可能为直接干预RAAS,或通过激活PPARγ间接抑制RAAS。在对大鼠进行3,4-二羟基苯甲醛、4,4′-二羟基二苯醚、4-甲氧基苄基醇、4-羟基苯甲醛等天麻酚类成分给药后,均有不同程度依赖于血管内皮细胞的血管舒张作用[42],这可能与天麻酚类提取物通过调节血管张力改善高血压的过程有关。苯肾上腺素建立的大鼠肠系膜动脉环预收缩模型中[43],天麻素通过血管平滑肌蛋白激酶A激活腺苷三磷酸(adenosine triphosphate,ATP)敏感钾通道产生肠系膜动脉的浓度相关性舒张作用,从而降低血压。
2.3 其他血管疾病
2.3.1 动脉粥样硬化 动脉粥样硬化病因复杂,是心脑血管疾病的重要致病因素,研究表明天麻素给药治疗后早期动脉粥样硬化小鼠外周血中总胆固醇(total cholesterol,TC)和低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)水平明显降低,免疫组织化学显示小鼠胸主动脉内膜的脂质沉积和泡沫细胞减轻[44],无序肠道微生物在科和属水平上的细菌多样性和丰富度被重塑,肠黏膜损伤和通透性逆转,炎性细胞因子减少,天麻素重塑肠道微生物和其抗炎作用可能是其缓解心脑血管中脂质蓄积,缓解动脉粥样硬化的机制。
2.3.2 凝血和血栓 凝血和血栓是造成血管堵塞的重要原因,天麻酚类成分有较好的抗凝血作用,也通过干扰纤维蛋白分子之间的点状相互作用,从而有效地抑制血栓的形成,降低血栓形成的风险。在胶原、肾上腺素诱导的大鼠血小板聚集中,4,4′-二羟基二苄基醚等多种酚类都显示出较强的抗血小板凝集作用[45]。Liu等[46]通过使用石英晶体微量天平(药物)生物传感器,抗凝动物实验、分子对接模拟证实天麻素具有抗凝活性。郭营营等[47]通过下腔静脉结扎建立大鼠静脉血栓模型,结果表明对羟基苯甲醇能显著对抗大鼠静脉血栓。因此天麻酚类成分可起到预防凝血与血栓的作用,从而降低因其引起的心血管疾病风险。
天麻酚类成分对心脑血管疾病的药理作用及机制见表2。
表2 天麻酚类成分对心脑血管疾病的药理作用及机制
Table 2 Pharmacological action and mechanism of phenolic compounds in G. elata on cardio-cerebralvascular diseases
药理作用活性成分动物/细胞模型剂量/(mg∙kg−1)机制文献 脑缺血再灌注损伤保护天麻总酚雄性SD大鼠MACO诱导I/R262.3↑:神经行为评分↓:MyD88、NF-κB、TNF-α8 天麻素雄性SD大鼠右侧颈动脉结扎诱导I/R100(造模前1 h)↓:神经评分、脑含水量、IL-1β、NF-κB、TNF-α、p38 MAPK、PI3K、p-Akt48 对羟基苯甲醇雌性SD大鼠去卵巢后,MACO诱导I/R25↑:PDI、Nrf2、BDNF、GDNF、MBP基因表达↓:脑梗死总体积33 对羟基苯甲醇雄性SD大鼠MACO诱导I/R25↑:PDI、1-Cys Prx转录水平↓:总梗死面积34 4-羟基苯甲醇雄性SD大鼠MACO诱导I/R25、50(MACO前30 min)↑:神经评价和尼氏染色、Bcl-2、Caspase-3↓:TUNEL阳性细胞35 4-羟基苯甲醇雄性SD大鼠MACO诱导I/R/↓:TNF-α、TUNEL、梗死体积、神经细胞坏死49 巴利森苷C雄性Wistar大鼠MACO诱导I/R25、50、100↑:SOD、CAT、GSH-Px↓:脑组织含水量、神经功能缺损评分、MDA、TNF-α、IL-6、IL-1β、NF-κB50

续表2
“↑”表示上升,“↓”表示下降 MyD 88-髓样分化因子88 NF-κB-核因子-κB MAPK-丝裂原活化蛋白激酶 PI3K-磷脂酰肌醇3-激酶 Akt-蛋白激酶B PDI-蛋白质二硫键异构酶 BDNF-脑源性神经营养因子 GDNF-胶质细胞源性神经营养因子 MBP-髓磷脂碱性蛋白 1-Cys Prx-1-半胱氨酸过氧化还蛋白 SOD-超氧化物歧化酶 CAT-过氧化氢酶 GSH-Px-谷胱甘肽过氧化物酶 MDA-丙二醛 CA1-海马体CA1区 LDH-乳酸脱氢酶 ATF-2-激活转录因子-2 JNK-应激活化蛋白激酶 ALD-醛固酮
“↑” means rising, “↓” means falling MyD88-myeloid differentiation factor 88 NF-κB-nuclear factor kappa-B MAPK-mitogen-activated protein kinase PI3K-phosphatidyl inositol 3-kinase Akt-Protein Kinase B PDI-protein disulfide isomerase BDNF-brain-derived neurotrophic factor GDNF-glial cell derived neurotrophic factor MBP-myelin basic protein 1-Cys Prx-1-cysteine peroxiredoxin SOD-superoxide dismutase CAT-catalase GSH-Px-glutathione peroxidase MDA-Malondialdehyde CA1-hippocampus CA1 LDH-lactate dehydrogenase ATF-2-activating transcription factor-2 JNK-c-jun-terminal kinase ALD-aldosterone
3 结语与展望
天麻是一种性味温和、效用有佳的中药材[13],已广泛投入多种疾病的治疗,有多种天麻的成方制剂或单方制剂已被订立在册[2]。以往对天麻的研究主要集中在天麻栽培防病等基础方面,近年来有关天麻药理活性的研究性文献逐年增长,其研究的热点在于天麻、天麻活性成分或天麻制剂对中枢神经系统疾病方面的药理作用[15],天麻对心脑血管疾病作用的相关文献数量较少,其作为镇静、镇痛等中枢神经系统疾病治疗药物的研究较多,而针对天麻治疗心脑血管疾病的应用开发不足。动物实验表明天麻酚类物质如天麻素、对羟基苯甲醇、巴利森苷和香草醛均能明显改善模型的心脑血管疾病损伤。天麻酚类成分对脑缺血[32-35]、高血压[41]、心肌缺血[38-40]、动脉粥样硬化[44]、血管性痴呆[37]、血凝血栓均表现出良好的药效[46-47],其机制可能与其抑制细胞凋亡与抗炎作用有关。4,4′-二羟基苄基砜等在大鼠心脏血表现出抗血小板作用[45],4-羟基苯甲醛等酚醛在I/R大鼠中能通过调节血管张力达到降血压的作用[41],天麻素通过调节炎症信号通路减轻炎症反应[36]。主要通过抗氧化、抗炎、神经营养、血管通透性、血脂、血管生成、细胞凋亡的调节等多种途径发挥抗心脑血管疾病的作用。
天麻中酚类活性成分对心脑血管疾病的药理作用机制仍需进一步的探索阐明,以天麻的酚类活性成分为主体,可利用天麻研究开发更多治疗心脑血管疾病的临床制剂。本文通过对天麻治疗心脑血管疾病的相关文献进行查阅分析,综述了天麻中已被提取发现的多种酚类活性成分及其对心脑血管疾病的药理作用,为天麻对心脑血管疾病的临床治疗和进一步开发利用提供了思路和依据。
利益冲突 所有作者均声明不存在利益冲突
[1] 胡鹏程, 王进, 李墨香, 等. 天麻改善小鼠睡眠作用及其机制研究 [J]. 中草药, 2019, 50(13): 3140-3146.
[2] 中国药典[S]. 一部. 2020: 59.
[3] Liu Y, Huang G L. The chemical composition, pharmacological effects, clinical applications and market analysis of[J]., 2017, 51(3): 211-215.
[4] 黄红, 刘新民, 吕光华. 天麻防治神经精神疾病的研究进展 [J]. 中草药, 2018, 49(9): 2188-2194.
[5] Yang C S, Chiu S C, Liu P Y,. Gastrodin alleviates seizure severity and neuronal excitotoxicities in the rat lithium-pilocarpine model of temporal lobe epilepsy via enhancing GABAergic transmission [J]., 2021, 269: 113751.
[6] Liu Y, Gao J L, Peng M,. A review on central nervous system effects of gastrodin [J]., 2018, 9: 24.
[7] 黄红, 陈碧清, 姜宁, 等. 鲜天麻对睡眠干扰诱导小鼠学习记忆障碍的改善作用 [J]. 中草药, 2020, 51(9): 2509-2516.
[8] 夏霜莉, 王维, 张冰琳, 等. 天麻总酚抗大鼠脑缺血再灌注损伤的转录组学分析及实验验证 [J]. 中草药, 2021, 52(5): 1402-1410.
[9] Ma J Q, Sun Y Z, Ming Q L,. Effects of gastrodin against carbon tetrachloride induced kidney inflammation and fibrosis in mice associated with the AMPK/ Nrf2/HMGB1 pathway [J]., 2020, 11(5): 4615-4624.
[10] Bai Y, Mo K, Wang G R,. Intervention of gastrodin in type 2 diabetes mellitus and its mechanism [J]., 2021, 12: 710722.
[11] Rahman M M, Rahaman M S, Islam M R,. Role of phenolic compounds in human disease: Current knowledge and future prospects [J]., 2021, 27(1): 233.
[12] 付亚轩, 孟宪钰, 李明超, 等. 天麻抗抑郁药效物质及其作用机制研究进展 [J]. 中草药, 2020, 51(21): 5622-5630.
[13] 范殊琮, 刘东雪, 陈琛. 基于文献计量的天麻研究发展态势和热点分析 [J]. 中国现代应用药学, 2021, 38(21): 2754-2762.
[14] 陈琛, 蔺蓓蓓, 苏鹏超, 等. 不同产地红天麻多酚组成及体外抗氧化活性研究 [J]. 西北农林科技大学学报: 自然科学版, 2021, 49(12): 144-154.
[15] 陈琛, 蔺蓓蓓, 徐尤美, 等. 天麻水提物活性成分分析及其抗氧化活性 [J]. 食品工业科技, 2019, 40(5): 17-22.
[16] Li Y H, Zhang Y M, Zhang Z J,. Quality evaluation oftubers based on HPLC fingerprint analyses and quantitative analysis of multi-components by single marker [J]., 2019, 24(8): E1521.
[17] Zhan H D, Zhou H Y, Sui Y P,. The rhizome ofBlume-an ethnopharmacological review [J]., 2016, 189: 361-385.
[18] Jang Y W, Lee J Y, Kim C J. Anti-asthmatic activity of phenolic compounds from the roots ofBl [J]., 2010, 10(2): 147-154.
[19] Xu C B, Guo Q L, Wang Y N,. Gastrodin derivatives from[J]., 2019, 9(6): 393-404.
[20] Ma Q Y, Wan Q L, Huang S Z,. Phenolic constituents with inhibitory activities on acetylcholinesterase from the rhizomes of[J]., 2015, 51(1): 158-160.
[21] Yang X D, Zhu J, Yang R,. Phenolic constituents from the rhizomes of[J]., 2007, 21(2): 180-186.
[22] 徐德宏, 崔培梧, 罗怀浩, 等. 天麻素生物合成的研究进展 [J]. 中草药, 2020, 51(22): 5877-5883.
[23] Li N, Wang K J, Chen J J,. Phenolic compounds from the rhizomes of[J]., 2007, 9(3/4/5): 373-377.
[24] Zhang Z C, Su G, Li J,. Two new neuroprotective phenolic compounds from[J]., 2013, 15(6): 619-623.
[25] Li Z F, Wang Y W, Ouyang H,. A novel dereplication strategy for the identification of two new trace compounds in the extract ofusing UHPLC/Q-TOF-MS/MS [J]., 2015, 988: 45-52.
[26] Farooq U, Pan Y J, Lin Y F,. Structure characterization and action mechanism of an antiaging new compound fromBlume [J]., 2019, 2019: 5459862.
[27] Wang Z W, Li Y, Liu D H,. Four new phenolic constituents from the rhizomes ofBlume [J]., 2019, 33(8): 1140-1146.
[28] Huang Z B, Wu Z, Chen F K,. The protective effects of phenolic constituents fromon the cytotoxicity induced by KCl and glutamate [J]., 2006, 29(11): 963-968.
[29] Huang L Q, Li Z F, Wang Q,. Two new furaldehyde compounds from the rhizomes of[J]., 2015, 17(4): 352-356.
[30] Guo Q L, Wang Y N, Lin S,. 4-Hydroxybenzyl-substituted amino acid derivatives from[J]., 2015, 5(4): 350-357.
[31] Guo Q L, Wang Y N, Zhu C G,. 4-hydroxybenzyl-substituted glutathione derivatives from[J]., 2015, 17(5): 439-454.
[32] Liu B, Li F, Shi J S,. Gastrodin ameliorates subacute phase cerebral ischemia‑reperfusion injury by inhibiting inflammation and apoptosis in rats [J]., 2016, 14(5): 4144-4152.
[33] Yu S S, Zhao J, Zheng W P,. Neuroprotective effect of 4-hydroxybenzyl alcohol against transient focal cerebral ischemia via anti-apoptosis in rats [J]., 2010, 1308: 167-175.
[34] Kam K Y, Yu S J, Jeong N,.-Hydroxybenzyl alcohol prevents brain injury and behavioral impairment by activating Nrf2, PDI, and neurotrophic factor genes in a rat model of brain ischemia [J]., 2011, 31(3): 209-215.
[35] Yu S J, Kim J R, Lee C K,.Blume and an active component, p-hydroxybenzyl alcohol reduce focal ischemic brain injury through antioxidant related gene expressions [J]., 2005, 28(6): 1016-1020.
[36] 向彬, 肖纯, 申婷, 等. 对羟基苯甲醛可预防大鼠急性脑缺血后神经炎症 [J]. 中成药, 2017, 39(8): 1572-1576.
[37] Shi R, Zheng C B, Wang H Y,. Gastrodin alleviates vascular dementia in a 2-VO-vascular dementia rat model by altering amyloid and Tau levels [J]., 2020, 105(7/8): 386-396.
[38] Fu S S, Chen L L, Wu Y Z,. Gastrodin pretreatment alleviates myocardial ischemia/reperfusion injury through promoting autophagic flux [J]., 2018, 503(4): 2421-2428.
[39] Sun W J, Lu H Q, Lyu L C,. Gastrodin ameliorates microvascular reperfusion injury-induced pyroptosis by regulating the NLRP3/Caspase-1 pathway [J]., 2019, 75(4): 531-547.
[40] Wang Q, Li Z F, Wang D X,. Myocardial protection properties of parishins from the roots ofBl [J]., 2020, 121: 109645.
[41] Liu W, Wang L Y, Yu J H,. Gastrodin reduces blood pressure by intervening with RAAS and PPARγ in SHRs [J]., 2015, 2015: 828427.
[42] Dai R, Wang T, Si X Q,. Vasodilatory effects and underlying mechanisms of the ethyl acetate extracts from[J]., 2017, 95(5): 564-571.
[43] Chen S, Hao X W, Yu L,. Gastrodin causes vasodilation by activating KATP channels in vascular smooth muscles via PKA-dependent signaling pathway [J]., 2017, 37(6): 543-549.
[44] Liu F Y, Wen J, Hou J,.remodels intestinal microflora to suppress inflammation in mice with early atherosclerosis [J]., 2021, 96: 107758.
[45] Pyo M K, Jin J L, Koo Y K,. Phenolic and furan type compounds isolated fromand their anti-platelet effects [J]., 2004, 27(4): 381-385.
[46] Liu Y, Tang X L, Pei J F,. Gastrodin interaction with human fibrinogen: Anticoagulant effects and binding studies [J]., 2006, 12(30): 7807-7815.
[47] 郭营营, 蒋石, 林青, 等. 天麻中对羟基苯甲醇抗血小板聚集的作用及机制研究 [J]. 时珍国医国药, 2014, 25(1): 4-6.
[48] 崔海彬, 张倩. 天麻素对脑缺血再灌注大鼠大脑皮质的影响及可能机制 [J]. 解剖科学进展, 2021, 27(3): 277-279.
[49] Seok P R, Oh S J, Choi J W,. The protective effects ofBlume extracts on middle cerebral artery occlusion in rats [J]., 2019, 28(3): 857-864.
[50] Wang T, Chen H B, Xia S Y,. Ameliorative effect of parishin C against cerebral ischemia-induced brain tissue injury by reducing oxidative stress and inflammatory responses in rat model [J]., 2021, 17: 1811-1823.
[51] Kim H J, Hwang I K, Won M H. Vanillin, 4-hydroxybenzyl aldehyde and 4-hydroxybenzyl alcohol prevent hippocampal CA1 cell death following global ischemia [J]., 2007, 1181: 130-141.
[52] Liu M Y J, Zhao L, Han L W,. Discovery and identification of proangiogenic chemical markers frombased on zebrafish model and metabolomics approach [J]., 2020, 31(6): 835-845.
Research progress on pharmacological effects of phenols inon cardio-cerebralvascular diseases
QUAN Yi-heng1, 2, SHANG GUAN Chen-hong1, 2, CHEN Chen1, 2
1. Chinese-German Joint Institute for Natural Product Research of Shaanxi University of Technology, Shaanxi Engineering Research Center of Tall Gastrodia Tuber and Medical Dogwood, Hanzhong 723000, China 2. Key Laboratory of Bio-resources of Shaanxi Province, College of Biological Science and Engineering, Shaanxi University of Technology, Hanzhong 723000, China
has the effects of calming endogenous wind and relieving spasm, suppressing hyperactive liver and subsiding yang, expelling wind and dredging collaterals, and contains main components such as gastrodin,-hydroxybenzyl alcohol and gastrodia polysaccharide. Main phenolic components inwere summarized, and pharmacological effects of gastrodin,-hydroxybenzyl alcohol, parishin, vanillin and other phenols on cardio-cerebralvascular diseases such as ischemic brain injury, vascular dementia, ischemic myocardial injury, hypertension, atherosclerosis, blood coagulation thrombosis and inflammation were clarified in this paper. Mechanism ofphenolic components in treatment of cardio cerebral vascular diseases through antioxidant, regulating functional protein expression, anti-apoptosis, and other mechanisms was explored, in order to provide a reference and basis for in-depth study of phenolic components in.
Blume; gastrodin;-hydroxybenzyl alcohol; parishin; cardio-cerebralvascular diseases
R282.710.5
A
0253 - 2670(2022)14 - 4582 - 11
10.7501/j.issn.0253-2670.2022.14.035
2022-03-23
国家高端外国专家项目(GDT20186100426);陕西省重点研发项目(2020NY-139);陕西省创新能力支撑计划项目(2019XY-04)
全毅恒(1998—),男,硕士研究生,从事天然产物研究与开发。E-mail: QuanYiheng0205@Outlook.com
陈 琛(1978—),教授,博士,从事天然产物研究与开发。Tel: (0916)2641011 E-mail: cchen@snut.edu.cn
[责任编辑 崔艳丽]