鞣花酸的制备及应用研究进展
屈艳君,王文慧,曹家南,汪育文,刘淼,沈才洪,宋萍

摘要:目的:综述了鞣花酸和鞣花单宁的结构和来源、鞣花酸的提取和生物法制备工艺的研究进展,以期为鞣花酸的工业生产提供科学依据。方法:总结有关鞣花酸制备的研究性论文、综述及书籍等。结果:固态发酵、液态发酵和酶转化方法生产鞣花酸的工艺优缺点各异。结论:鞣花酸的应用前景广阔,生产方式多样,生物技术法生产鞣花酸是一种绿色高效的生产的方法。
关键词:鞣花酸;鞣花单宁;固态发酵;液态发酵;酶转化
鞣花酸是没食子酸的二聚衍生物。自然界中的鞣花酸多以聚合形式存在,鞣花酸与糖之间用酯键相连形成可水解的单宁,即鞣花单宁(ETs)。鞣花酸和鞣花单宁具备多酚化合物的抗氧化性。相比于鞣花单宁,鞣花酸的分子量小,人体吸收效果好,更受关注,可应用于化妆品、保健品、饮料、医药等行业。此外,因鞣花酸具备多酚二内酯的结构,还可以应用于材料领域,作为共聚物、螯合剂、离子交换树脂和电化学装置等。因此,鞣花酸具有广阔的应用前景。
1鞣花酸和鞣花单宁的结构
1.1鞣花酸
鞣花酸的4个酚羟基和2个内酯基具有亲水性质,而2个苯环具有疏水部分,因此鞣花酸具有两亲特性。鞣花酸的水溶性低,仅微溶于水,在甲醇中的溶解度大大提高,在吡啶中也有较高的溶解度[1-2]。当鞣花酸作为药剂开发时,有希望的溶剂是N-甲基吡咯烷酮、聚乙二醇400、三乙醇胺[1]。
1.2鞣花单宁
鞣花单宁由六羟基二苯甲酰基(HHDP)基团与葡萄糖通过酯键相连。HHDP基团是鞣花单宁的特征结构,由两个3,4,5-三羟基苯甲酰基(没食子酰基)单元碳碳键结合生成。鞣花单宁在酸或碱条件下,酯键被水解从而释放出HHDP基团。HHDP基团是一个不稳定的基团,会进一步内酯化,从而生成具有高抗氧化活性的鞣花酸。鞣花单宁结构复杂多样,到目前为止已经发现了1 000多种鞣花单宁。通过HHDP基团和没食子酰基部分之间的C-O氧化连接,鞣花单宁可以形成高达几千分子量的二聚体Sanguiin H-6,还可以形成三聚体和四聚体等。鞣花单宁也可以与其他类别的分子结合而产生杂化结构,形成Epiacutissimin B等化合物。
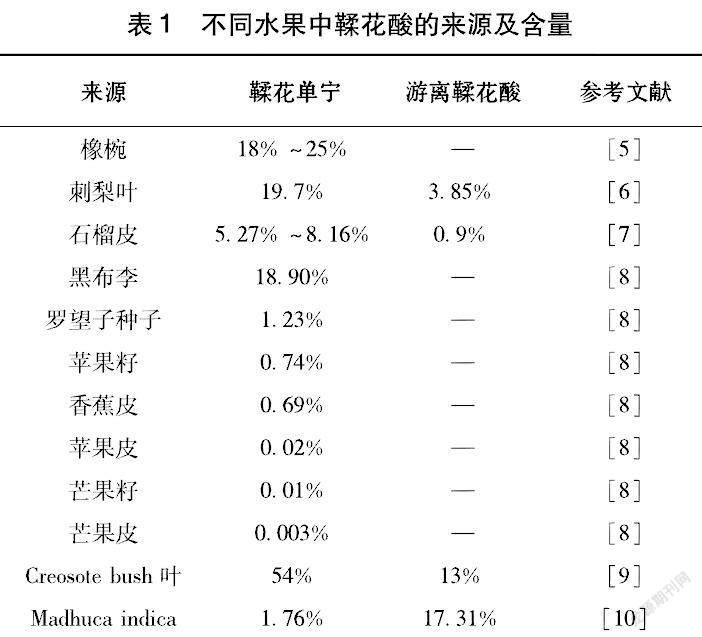
2鞣花酸和鞣花单宁的来源
鞣花单宁广泛存在自然界中,在树莓、覆盆子、草莓等蔷薇科植物中含量较为丰富,在刺梨叶中含量高达197.08 mg/g[3]。表1可见,100 g石榴皮中鞣花酸含量达到3.5 g,可以作为鞣花酸工业制备的主要原料[4]。我国是石榴生产大国,栽种面积居世界第一,年产量超过170万t。石榴皮占石榴总重20%~30%,是果汁加工副产物,除药用外大部分被废弃,造成一定的资源浪费和环境污染。因此,充分、有效地开发利用石榴皮中的鞣花酸是实现农废资源回收利用的有效途徑。
3鞣花酸的生产
鞣花酸的制备方法有3种:化学合成法、提取法和生物法。其中化学法利用没食子酸或没食子酯氧化聚合制备鞣花酸,产率可达到20%~30%,但是因为没食子酸(酯)的生产过程非常复杂,并且获得的产物中还掺杂醌类物质,使得鞣花酸的分离纯化具有一定困难,故目前很少使用此法进行鞣花酸的生产[11]。本综述主要讨论提取法和生物法制备鞣花酸的研究进展。
3.1提取法生产鞣花酸
利用鞣花酸易溶于有机溶剂的性质,可以直接从原料中提取。通常使用乙醇、丙酮等溶剂作为萃取剂。对于一些鞣花酸含量比较高的蔷薇科植物,例如树莓可以单独使用萃取剂提取。对于其他含有鞣花酸的原料还会在使用萃取剂的基础上增加加热、超声、微波等技术,同时结合酸或碱水解,以获得较高纯度的鞣花酸(表2)。
提取过程的关键步骤是溶剂的选择。甲醇/水或丙酮/水的混合物有较好的提取效率。Lei [12]通过比较这些溶剂混合物发现,1 g含鞣花单宁样品加入10 mL溶剂(7 ∶3的丙酮/水的溶剂混合物),提取温度维持60 ℃,不断搅拌,并在提取过程中避免光照,提取12~24 h后过滤去除纤维、色素和其他化合物等杂质,利用蒸发除去溶剂,将含丙酮/水的提取物通过冷冻干燥,鞣花酸的产量最高可达到0.55%,鞣花单宁产量最高可达到6.72%。
结合水解可以增加鞣花酸的收率和纯度。Lu[4]等采用甲醇提取石榴皮中的鞣花单宁,随后用5%的硫酸水解5 h,并通过提取和重结晶进行纯化,最终从100 g石榴皮中获得3.5 g纯度90%的鞣花酸产品。鞣花单宁也可以在碱性条件下水解获得鞣花酸。五倍子为中国特有资源,是叶上的虫瘿,主要分布在川贵一带,约含有50%~70%的鞣花单宁。雷焱[13]将蒸馏水与五倍子混合浸取,加入碳酸氢钠和氢氧化钠,得到48.46%粗鞣花酸产品,再通过对鞣花酸进行碱变性溶解,最后加入酸进一步纯化,鞣花酸纯度可达95%以上。该工艺常温常压下即可进行,产品纯度高,生产成本约为国际市场价的20%左右。但是五倍子是昆虫的尸体,用其制备的鞣花酸只能用于外用,而不能应用于食品和保健品领域。
离子液体可以替代传统的挥发性溶剂。Chowdhury[14]使用质子型可蒸馏的离子液体[N1100][N(C1)2CO2]从儿茶和橄榄果中提取鞣花酸,提取率达到85%。这种方法效率较高,可以减少萃取中水的用量,该离子液体可以通过低温蒸馏去除,在收率和能源成本方面较有优势。另一种方法是使用离子液体辅助微波萃取蒸馏桉树种叶片,同时提取鞣花酸、没食子酸和精油[14],该方法具有高效、节能、省时且环保的特点。
3.2生物法生产鞣花酸
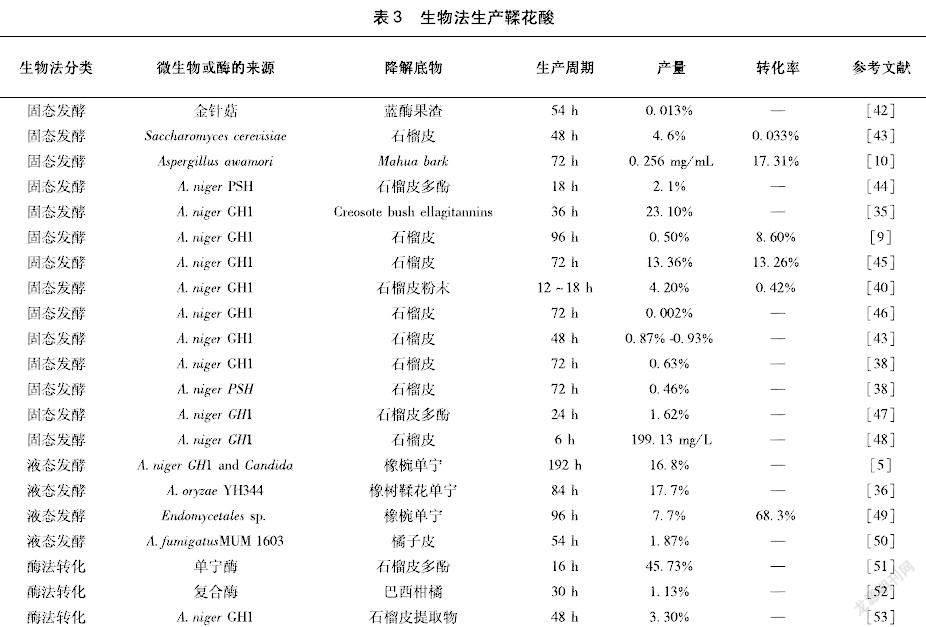
溶剂萃取结合酸解提取鞣花酸是传统的方法,但是存在产率低、成本高和环境污染等缺点。鞣花酸产率低的主要原因是植物来源种类繁多,鞣花单宁结构复杂多样、纯化困难、处理过程易引入其他杂质[34-35]。因此,需要开发在产率和能源成本方面更有效的替代技术,以实现鞣花酸的高纯度和大规模生产。目前,生物技术生产已成为一种有前途的替代方法(表3)。
3.2.1与鞣花单宁降解相关的酶单宁酶是鞣花单宁降解过程中研究比较多的酶,可以水解鞣花单宁中的酯键。单宁酶是一种诱导酶,在单宁酸和单宁存在的情况下可以诱导生成。单宁酶在各种真菌,细菌和酵母菌中广泛存在。生产中常用的单宁酶生产菌主要是真菌,如黑曲霉A.niger和米曲霉A.oryzae[36-38]。随着对生物法制备鞣花酸的深入研究,发现了另外一种参与鞣花单宁特异性降解的酶—鞣花单宁酶,也称作鞣花单宁酰基水解酶(EAH)。鞣花单宁酶与单宁酶的酶解过程类似,都是降解鞣花单宁中的酯键,但是两种酶出现的时间不一致。Aguilera-Carbo[35]在A.niger固态发酵杂丛灌木鞣花单宁过程中检测了单宁酶(酶活检测以没食子酸甲酯为底物)和鞣花酸酶活性(酶活检测以石榴皮多酚为底物),发现鞣花酸积累的时间与单宁酶酶活出现的时间不一致,却与鞣花单宁酶酶活出现的时间一致,因此提出了鞣花单宁酶参与鞣花单宁降解过程的假设。Ascacio-Valdés[39]在A.niger固态发酵石榴皮提取物的过程中也发现了类似的现象,鞣花单宁酶出现的时间与鞣花酸大量积累期间一致、鞣花单宁酶的酶活更高、鞣花单宁酶和单宁酶最高酶活出现的时间不一致,因此作者推测HHDP基团与糖苷之间的酯键被具有高特异性的鞣花单宁酶降解,使得鞣花酸积累[39]。随后,Juan A.Ascacio[40]通过变性和非变性电泳确定了存在特定降解鞣花单宁的酶,该酶分子量约200kDa,并且该酶由石榴皮鞣花单宁诱导产生。作者还推测了石榴皮鞣花单宁的降解途径:石榴皮中鞣花单宁的主要成分安石榴苷在鞣花单宁酶作用下生成中间产物安石榴林,鞣花单宁酶进一步降解安石榴林生成gillagic acid,最后生成鞣花酸,但该研究并没有指出这种特定降解鞣花单宁的酶是否就是鞣花单宁酶。
由于鞣花单宁结构的复杂性和多样性,鞣花单宁的降解过程中除了单宁酶和鞣花单宁酶会直接参与[34],在一些鞣花酸的生产过程中还发现了多种酶的协同作用。Huang等[41]发现,在A.oryzae與Trichoderma reesei共培养降解橡椀单宁提取物时,鞣花单宁酰基水解酶、纤维素酶和木聚糖酶在生成鞣花酸的过程中存在协同作用。而在Ascacio-Valdés JA[39]用A.niger GH1固态发酵石榴皮提取物时,鞣花酸的产量与纤维素酶、木聚糖酶、β-葡萄糖苷酶、多酚氧化酶无关,仅与鞣花单宁酶相关。尽管已经对单宁酸的生物降解和一些简单单宁酸的降解机理进行了许多研究,但对鞣花单宁等复杂单宁的断裂途径和参与降解过程的酶知之甚少。在积累机理上,仍然缺少一些中间体的具体降解过程。对于单宁酶和鞣花单宁酶之间的认知,目前仅知道两者催化底物的不同和在同一催化过程中出现酶活峰值的时间不同,而对于两者在酶学性质等信息仍然未知。
3.2.2固态发酵法制备鞣花酸固态发酵的发酵过程粗放、设备要求简单,使得单宁酶的酶活高,发酵后鞣花酸浓度高易提取,菌体对底物的耐受浓度更高,不容易出现分解代谢阻遏和产物反馈抑制现象,而且单宁酶的胞外特性及其较强的pH和温度稳定性,使得固态发酵广泛应用于单宁酶生产和鞣花酸的制备研究[54]。根据固态发酵中固相的性质,可以把固态发酵分为两种类型:一种是以农作物同时作为底物和固相的固体底物基质固态发酵;另一种是以惰性载体作为固相的惰性载体吸附固态发酵。在以石榴皮为固相时,Armando R[38]发现,A.niger GH1菌株可以将石榴皮总多酚在72 h内降解71%,发酵120 h后可以获得6.3 mg/g的得率。当A.niger GH1菌株固态发酵的固相改为浸润了鞣花单宁提取液的聚氨酯泡沫载体时,在30 ℃、1×107 个孢子/mL的孢子悬浮液、培养12~18 h的条件下,鞣花酸的最大产量为42.02 mg/g[39]。Aguilera-Carbo A[35]的研究同样发现,A.niger GH1能够在培养36 h时完全降解杂丛灌木的鞣花单宁,鞣花酸产率为23.1%。惰性载体吸附固态发酵与固体底物基质固态发酵相比,产物提取简便,可以较容易地从惰性载体中提取到胞外产物,杂质含量少,载体可重复使用。
培养基和培养条件的优化也是鞣花酸固态发酵研究的重点。Rajiv Chandra Rajak[10]以印度的一种树皮作为底物(含17.31%左右的水解单宁),通过A.awamori固态发酵,在料液比1 ∶2、温度35 ℃、pH 5.5、培养72 h的条件下,单宁酶活性最高可达56.16 IU/gds,鞣花酸产量为0.256 mg/mL。Federica M等[43]以酿酒酵母作为菌种,在温度25 ℃、湿度70%、1×106个孢子/mL的孢子悬浮液、pH 5、蛋白胨20 g/L、酵母提取物5 g/L、氯化钠460 g/L,使用1∶100的固液比,用二甲基亚砜作为溶剂,鞣花酸的产量是46 mg/g。 不同的底物选择也会影响鞣花酸的产量,Paranthaman R[55]采用茶的残渣作为A.niger GH1固态发酵生产鞣花酸的底物,生成最大鞣花酸产量最佳条件是在35 ℃下持续96 h,最高可生产42.35 μg/g 鞣花酸。
单宁酶和鞣花单宁酶是诱导酶,通常会使用单宁酸或者单宁作为诱导剂,也可以将单宁酸和单宁作为唯一的碳源和诱导剂[56]。诱导剂和碳源的合适配比有利于单宁的降解。Aguilar-Zárate P用A.niger GH1固态发酵时,30 g/L安石榴苷用作碳源和诱导剂,添加少量麦芽糖(0.15 g/L)作为促进生长的碳源,可使鞣花酸和鞣花单宁酶产率提高至33.18 mg/L/h和33.70 U/L/h,与不添加麦芽糖的组做对照,分别提高2.8、1.5倍[48]。
在工艺及优化反应器方面,Sepúlveda L[45]优化A.niger GH1在托盘生物反应器上以石榴粉为载体进行固态发酵。使用Plackett-Burman设计筛选培养因子,结合中央复合设计评估培养条件。在最优条件下,鞣花酸产量达到132.62 mg/g,生产速率为0.24 g/L/h。此外,Buenrostro-Figueroa J[57]还开发了一种以聚氨酯泡沫颗粒(0.85 mm)为载体的柱形连续生物反应器,以固态发酵方式生产菌体并固定化鞣花单宁酶(30 ℃、18 h);向装有生物催化剂的填充床反应器注入石榴皮鞣花单宁提取液(0.1%,w/v),在60 ℃的条件下,生物反应器可以保持60%的水解速率,连续进行10个连续循环生产。在水解的前70 min,鞣花酸产量为235.89 mg/g,鞣花酸产量高达175 mg/g。这是第一份使用自动固定化酶高产量连续生产鞣花酸的研究。
由于鞣花单宁聚合物的解聚对于鞣花酸的生产也很重要,可以通过减少鞣花单宁酸的大分子聚合物的位阻,使得水解酶可以容易地到达反应部位以催化鞣花单宁酸水解成游离鞣花酸单元。Huang[41]利用产单宁酶的A.oryzae和产纤维素酶的T.reesei共培养,使用橡椀提取物(含有62%鞣花单宁)为底物生产鞣花酸。生产过程中检测到较高的鞣花单宁酶、纤维素酶和木聚糖酶含量,鞣花单宁酶、纤维素酶和木聚糖酶的活性与鞣花酸产量有很强的相关性。在最佳生产条件下(初始pH 4.5、鞣花单宁浓度4 g/L),发酵96 h后,鞣花酸的产率可达到24%[41]。
3.2.3液态发酵法制备鞣花酸目前,利用液态发酵制备鞣花酸的报道比较少。尽管在比较固态发酵和液态发酵的研究中显示出固态发酵有较高鞣花酸转化率,但是液态发酵条件更可控,因此也具有一定的应用潜力。Leonardo[50]发现,桔皮废弃物中有28%为多酚类化合物、27%为鞣花单宁、25%为黄酮类化合物、20%为没食子单宁,多酚类化合物主要为儿茶素、鞣花酸和橘皮素。通过使用中心实验设计,烟曲霉A.fumigatus MUM1603在最优发酵条件下(温度30℃、孢子接种量2×107个孢子/g、桔皮多酚6.2 g/L),鞣花酸的产量为18.68 mg/g。Huang[58]发现,以橡椀单宁为底物,利用曲霉SHL-6生产鞣花酸时,碳源和氮源是菌株降解鞣花单宁的重要参数,在5 g橡椀单宁、蔗糖为碳源、蛋白胨为氮源、28 ℃、初始pH在4.5~5、120 r/min发酵72 h的条件,鞣花酸的产率可以达到15%。Huang等 [37]以橡子果实提取物为底物,利用A.oryzae和Endomycopsis fibuligera共发酵产生鞣花酸,当这两种菌株在30 ℃、pH 5.0和5.6 g/L的初始底物濃度下时,鞣花酸的最大产率可达到32%,鞣花酸的最大产量是1.84 g/L。在发酵过程中,两种菌起到了不同的作用,A.oryzae因为有更高的鞣花单宁酶酶活、多酚氧化酶酶活和葡萄糖苷酶酶活,能产生更多的鞣花酸,而E.fibuligera则可以有效降解鞣花单宁。
3.2.4酶转化制备鞣花酸酶转化法主要是利用微生物生产单宁酶或者鞣花单宁酶将鞣花单宁水解生成鞣花酸。酶法转化较发酵法而言,副产物相对较少,目标产物更易于提纯。酶转化将单宁酶的生产和鞣花单宁的转化分为两个步骤,使得转化过程更可控。酶浓度、pH值和反应时间等因素对酶促反应影响较大。程艳[53]确定了以石榴皮为底物酶法生产鞣花酸的最佳条件:在50 mL含6.7%的单宁溶液中加入15 mL 65 U/mL酶液、pH 5.5、30 ℃反应48 h,鞣花酸得率约13%,纯度约32%。Huang[36]选择来自A.oryzae来源的鞣花单宁酰基水解酶,使用含60%鞣花单宁的橡子果实为底物,初始鞣花单宁浓度为5 g/L,鞣花单宁酰基水解酶活性30.8 IU/mL的条件下,转化84 h时鞣花酸达到17.7%。也可以通过不同酶的组合,同时获得植物组织中包括鞣花酸在内的其他产品。Madeira[52]通过纤维素酶、果胶酶和单宁酶同时获得来自巴西柑橘残留物的酚类,其中橙皮素、柚皮素和鞣花酸产量分别为120、80、11 250 mg/g。尽管酶解法和酸解法制备的鞣花酸粗品中的鞣花酸的含量基本相等,但是酸法生产鞣花酸经过纯化后纯度可以达到90%以上,而酶法纯化后的纯度只有60%[53]。
4鞣花酸的前景及展望
生物法生产鞣花酸面临着成本较高的问题,因此有必要加强以下几个基础研究:(1)研究鞣花单宁的降解机制,特别是石榴皮鞣花单宁(安石榴苷)的降解机制,解析单宁酶和鞣花单宁酶在降解过程中的具体步骤,为提高鞣花单宁的降解效率奠定基础;(2)进一步优化生物法制备鞣花酸的工艺,期望得到能大幅度提高鞣花酸产量的方法。
参考文献
[1]I B,V B,S H,et al.Analytical methods for assay of ellagic acid and its solubility studies[J].Journal of Pharmaceutical and Biomedical Analysis,2006,40(1):206-210.
[2]Goriparti S,Harish MNK,Sampath S.Ellagic acid - a novel organic electrode material for high capacity lithium ion batteries[J].Chemical Communications,2013,49(65):7234-7236.
[3]Konczak I,Maillot F,Dalar A.Phytochemical divergence in 45 accessions of Terminalia ferdinandiana(Kakadu plum)[J].Food Chemistry,2014,151(5):248-256.
[4]Lu J,Yuan Q.A new method for ellagic acid production from pomegranate husk[J].Journal of Food Process Engineering,2008,31(4):443-454.
[5]黄文.橡椀单宁生物降解及其机理研究[D].成都:四川大学,2002.
[6]谭登航,王鹏娇,张硕,等.刺梨不同药用部位中鞣花酸的含量测定及其醇提物的体外抗氧化活性研究[J].中国药房,2019,30(9):1236-1240.
[7]刘宇文.鞣花酸的生产制备工艺研究[D].北京:北京化工大学,2015.
[8]Saeed S,Aslam S,Mehmood T,et al.Production of gallic acid under solid-state fermentation by utilizing waste from food processing industries[J].Waste and Biomass Valorization,2021,12(1):155-163.
[9]Aguilar CN,Aguilera-Carbo A,Robledo A,et al. Production of antioxidant nutraceuticals by solid-state cultures of pomegranate(Punica granatum)peel and creosote bush(Larrea tridentata)leaves[J].Food Technology and Biotechnology,2008,46(2):218-222.
[10]Rajak RC,Singh A,Banerjee R.Biotransformation of hydrolysable tannin to ellagic acid by tannase from Aspergillus awamori[J].Biocatalysis and Biotransformation,2017,35(1):1-8.
[11]李素琴,袁其朋,徐健梅.鞣花酸的生理功能及工艺开发研究现状[J].天然产物研究与开发,2001,52(5):71-74.
[12]Lei Z.Monomeric ellagitannins in oaks and sweetgum[D].Virginia Tech,2002.
[13]雷焱.五倍子单宁为原料制备鞣花酸及鞣花酸的纯化[D].北京:北京化工大学,2007.
[14]Liu Z,Chen Z,Han F,et al.Microwave-assisted method for simultaneous hydrolysis and extraction in obtaining ellagic acid,gallic acid and essential oil from Eucalyptus globulus leaves using Brnsted acidic ionic liquid[HO3S(CH2)4 mim]HSO4 [J].Industrial Crops & Products,2016,81(1):152-161.
[15]崔珊珊,毕凯媛,吴杰,等.响应面法优化树莓鞣花酸提取工艺及其体外抗氧化活性[J].食品工业科技,2019,40(1):149-155.
[16]刘丽娜.响应面法优化红树莓籽中鞣花酸的提取工艺[J].北方园艺,2020(2):107-112.
[17]郭叶莹,吴小刚,陈品品,等.石榴皮鞣花酸的超声波-微波协同碱水解提取工艺研究[J].浙江树人大学学报(自然科学版),2019,19(1):38-42.
[18]王妙飞,程庚金生,张道英,等.水解法制取五倍子鞣花酸的研究[J].食品工业科技,2010,31(2):233-234.
[19]徐加喜,高迪,朱晓梅,等.高温高压条件制备石榴皮鞣花酸的试验研究[J].食品工业科技,2017,38(17):174-177.
[20]邓小莉,董翠月,吴羽晨,等.不同提取方法对石榴皮鞣花酸提取率的影响[J].云南农业大学学报(自然科学),2015,30(6):969-973.
[21]邸幼军,贾光锋.超聲强化提取石榴皮鞣花酸的工艺研究[J].现代生物医学进展,2010,10(19):3703-3705.
[22]杨小玲,刘地发,刘伟,等.山香圆叶药材中鞣花酸的提取分离与含量测定[J].中国实验方剂学杂志,2014,20(10):54-57.
[23]柳静.塔拉单宁及鞣花酸的制备工艺研究[D].北京:北京化工大学,2012.
[24]张亮亮,徐曼,汪咏梅,等.响应面优化化香树果序中鞣花酸超声波提取的研究[J].林产化学与工业,2011,31(2):19-24.
[25]黄娟.芡果实主要成分性质与应用[D].江苏扬州:扬州大学,2014.
[26]An J-Y,Wang L-T,Lv M-J,et al.An efficiency strategy for extraction and recovery of ellagic acid from waste chestnut shell and its biological activity evaluation[J].Microchemical Journal,2021,160(4):105616.
[27]王佳宁,马永强,王鑫,等.蓝靛果鞣花酸超声波辅助提取工艺的研究[J].农产品加工,2017(20):38-42.
[28]魏征,赵雅娇,黄羽,等.响应面试验优化超声波辅助提取圆叶葡萄鞣花酸和总酚工艺[J].食品科学,2015,36(12):29-35.
[29]吴士龙,李敏,李小玢,等.响应曲面法优化树莓叶中鞣花酸的提取工艺[J].中国新药杂志,2014,23(6):692-697.
[30]刘艳,熊伟,田吉,等.可变波长同时测定泸州龙眼没食子酸和鞣花酸的含量[J].中国实验方剂学杂志,2012,18(6):84-86.
[31]薛茗月,罗星晔,湛志华,等.甜茶根中鞣花酸的提取纯化、表征及含量测定[J].林业科技,2011,36(4):25-28.
[32]刘玉革,刘胜辉,臧小平,等.高效液相色谱法测定番石榴叶提取物中的游离鞣花酸[J].食品科学,2011,32(8):252-254.
[33]王予祺,斯建勇,刘新民,等.蛇莓中鞣花酸和短叶苏木酚羧酸的分离鉴定及含量测定[J].天然产物研究与开发,2008(4):667-671.
[34]Aguilera-Carbo A,Augur C,Prado-Barragan LA,et al.Microbial production of ellagic acid and biodegradation of ellagitannins[J].Applied Microbiology and Biotechnology,2008,78(2):189-199.
[35]Aguilera-Carbo A,Hernández JS,Augur C,et al.Ellagic acid production from biodegradation of creosote bush ellagitannins by aspergillus niger in solid state culture[J].Food and Bioprocess Technology,2009,2(2):208-212.
[36]Huang W,Niu H,Gong GH,et al.Individual and combined effects of physicochemical parameters on ellagitannin acyl hydrolase and ellagic acid production from ellagitannin by aspergillus oryzae[J].Bioprocess and Biosystems Engineering,2007,30(4):281-288.
[37]Wen H,Zhenshan L,Hai N,et al.Utilization of acorn fringe for ellagic acid production by aspergillus oryzae and Endomyces fibuliger[J].Bioresource Technology,2008,99(9):3552-3558.
[38]Armando R,Antonio A-C,Raúl R,et al.Ellagic acid production by aspergillus niger in solid state fermentation of pomegranate residues[J].Journal of Industrial Microbiology & Biotechnology,2008,35(6):507-513.
[39]Ascacio-Valdés JA,Buenrostro JJ,Cruz RDl,et al.Fungal biodegradation of pomegranate ellagitannins[J].Journal of Basic Microbiology,2014,54(1):28-34.
[40]Ascacio-Valdés JA,Aguilera-Carbó AF,Buenrostro JJ,et al.The complete biodegradation pathway of ellagitannins by aspergillus niger in solid-state fermentation[J].Journal of Basic Microbiology,2016,56(4):329-336.
[41]Wen H,Hai N,Zhenshan L,et al.Optimization of ellagic acid production from ellagitannins by co-culture and correlation between its yield and activities of relevant enzymes[J].Bioresource Technology,2008,99(4):769-775.
[42]郭麗,王鹏,张春华.食用菇发酵蓝莓果渣代谢过程及抗氧化研究[J].食品工业,2016,37(10):75-79.
[43]Federica M,C F-GA,L C-GM,et al.Ellagic acid recovery by solid state fermentation of pomegranate wastes by aspergillus niger and saccharomyces cerevisiae:A comparison[J].Molecules(Basel,Switzerland),2019,24(20):1-11.
[44]Sepúlveda L,Wong-Paz JE,Buenrostro-Figueroa J,et al. Solid state fermentation of pomegranate husk:recovery of ellagic acid by SEC and identification of ellagitannins by HPLC/ESI/MS[J].Food Bioscience,2018,22(3):99-104.
[45]Sepúlveda L,Aguilera-Carbó A,Ascacio-Valdés JA,et al.Optimization of ellagic acid accumulation by aspergillus niger GH1 in solid state culture using pomegranate shell powder as a support[J].Process Biochemistry,2012,47(12):2199-2203.
[46]Robledo A,Aguilera-Carbo AF,Prado LA,et al.Kinetics of ellagic acid accumulation by solid-State fermentation[M].Theoretical Models and Experimental Approaches in Physical Chemistry,2018,35(7):268-278.
[47]Buenrostro-Figueroa J,Ascacio-Valdes A,Sepulveda L,et al.Ellagic acid production by solid-state fermentation influenced by the inert solid supports[J].Emirates Journal of Food and Agriculture,2018,30(9):750-757.
[48]Aguilar-Zárate P,Wong-Paz JE,Rodríguez-Duran LV,et al.On-line monitoring of aspergillus niger GH1 growth in a bioprocess for the production of ellagic acid and ellagitannase by solid-state fermentation[J].Bioresource Technology,2018,247(5):412-418.
[49]吕远平,姚开,李庆.可降解橡碗单宁产鞣花酸的菌种筛选[J].食品与发酵工业,2003(2):38-41.
[50]Sepúlveda L,Laredo-Alcalá E,Buenrostro-Figueroa JJ,et al.Ellagic acid production using polyphenols from orange peel waste by submerged fermentation[J].Electronic Journal of Biotechnology,2020,43(12):1-7.
[51]孙雨晴.石榴皮多酚及其酶解产物的抗氧化活性和对氧化应激小鼠的保护作用研究[D].南京:南京农业大学,2016.
[52]Jr.JVM,Macedo GA.Simultaneous extraction and biotransformation process to obtain high bioactivity phenolic compounds from brazilian citrus residues[J].Biotechnology Progress,2015,31(5):1273-1279.
[53]程艳.石榴皮为原料酶法生产鞣花酸[D].北京:北京化工大學,2008.
[54]Aguilar CN,Augur C,Favela-Torres E,et al.Induction and repression patterns of fungal tannase in solid-state and submerged cultures[J].Process Biochemistry,2001,36(6):565-570.
[55]Paranthaman R,Kumaravel S,Singaravadivel K. Development of bioprocess technology for the production of bioactive compound,ellagic acid from tea waste[J].World Journal of Agricultural Sciences ,2009,5(3):2976-2984.
[56]Chávez-González ML,Guyot S,Rodríguez-Herrera R,et al.Exploring the degradation of gallotannins catalyzed by tannase produced by aspergillus niger gH1 for ellagic acid production in submerged and solid-state fermentation[J].Applied Biochemistry and Biotechnology,2018,185(2):476-483.
[57]Buenrostro-Figueroa J,Huerta-Ochoa S,Prado-Barragán A,et al.Continuous production of ellagic acid in a packed-bed reactor[J].Process Biochemistry,2014,49(10):1595-1600.
[58]Huang W,Ni J,Borthwick AGL.Biosynthesis of valonia tannin hydrolase and hydrolysis of valonia tannin to ellagic acid by Aspergillus SHL 6[J].Process Biochemistry,2004,40(3):1245-1249.
Research Progress on Preparation and Application of Ellagic Acid
QU Yan-jun1 ,WANG Wen-hui1 ,CAO Jia-nan1 ,WANG Yu-wen1 ,LIU Miao1,2 ,SHEN Cai-hong2,SONG Ping1
(1School of food and pharmaceutical engineering,Nanjing Normal University,Nanjing 211800,China;
2National Solid State brewing Engineering Technology Research Center,Luzhou 646000,China)
Abstract:ObjectiveTo review the structure and source of ellagic acid and ellagitannins and the research on the preparation of ellagic acid by extraction and biological methods, in order to provide reference for the application of ellagic acid in industrial production.MethodWe summarized research papers,reviews and books on preparation and application of ellagic acid.ResultThe advantages and disadvantages of solid fermentation, liquid fermentation and enzyme conversion methods for producing ellagic acid are different.ConclusionThe application prospect of ellagic acid is broad, and the production methods are diverse. The production of ellagic acid by biotechnology is a green and efficient production method.
Keywords:ellagic acid;ellagitannins;solid state fermentation;liquid fermentation;enzymatic conversion
