秋水仙素对药用蒲公英种子萌发及生长特性的影响
朱梦鑫,刘 茗,张 建,王 宇,武彦芳,霍星孜
(宜宾学院农林与食品工程学部,四川宜宾 644000)
药用蒲公英(Taraxacum officinalis)为菊科蒲公英属植物,分布广泛,适应性强,具有多糖、多酚、三萜[1,2]等活性成分,在药剂、食品、化妆品、饲料等方面具有广泛应用.随着需求量越来越大,蒲公英栽培面积逐渐增大. 对蒲公英种子萌发特性[3]、栽培技术[4]、抗病性[5]等虽有相关研究,但药用蒲公英依然存在抗病性低、药用成分含量低、产量低等问题. 多倍体育种对于提高植物抗性、产量以及有效成分含量具有独特优势.诱导多倍体的化学药剂主要是秋水仙素,用于处理萌发的种子、嫩芽、愈伤组织等[6,7],以获得多倍体植株,这在燕麦[8]、人参果[9]、猕猴桃[10]等植物方面获得了成功. 本文将药用蒲公英种子用不同浓度秋水仙素处理,旨在筛选出最佳的染色体加倍条件,并对秋水仙素处理过的蒲公英幼苗进行移栽,以获得有实际应用价值的蒲公英材料.
1 材料与方法
1.1 试验材料
药用蒲公英种子为2020年5月收集,4℃冰箱保存,千粒重为(0.043±0.0021)g.五个月后进行秋水仙素处理.
1.2 试验方法
(1)秋水仙素处理. 避光条件下称取秋水仙素粉末,配置0.1%、0.3%、0.5%浓度的秋水仙素溶液,4℃下依次浸泡处理1d、3d、5d,蒸馏水浸泡作对照,共12 组处理,每个处理100 粒种子,重复三次.将秋水仙素处理后的种子用清水彻底清洗,分别放入铺有两层滤纸的培养皿中培养,定期浇水使滤纸始终保持湿润状态.在生态培养箱中进行25℃黑暗条件培养.观察并记录种子每日发芽数,计算最终发芽率.同时观察并记录种苗的形态特征,并与对照组做比较分析.培养至第10 天,使用游标卡尺测量萌发种子的胚根、胚轴和胚芽长度,每个处理中随机选取10棵蒲公英幼苗,进行相关测定.
(2)移栽管理. 每一组不同浓度秋水仙素处理的种子培养的第20 天,分别将种苗移栽进装有椰土的花盆中,正常管理,每一盆标记上组数和浓度便于后期统计观察,放入培养室中继续培养,定期浇水.三组种苗移栽的操作步骤相同.
(3)根系构型观察. 对移栽培养2 个月后成活的幼苗使用根系扫描仪MICROTK SANMAKER i800plus测量蒲公英种根的长度、面积、平均直径.
(4)气孔密度观察. 对移栽成活四个月的蒲公英撕取下表皮制作装片使用光学显微镜进行观察,与对照比较进行分析.
(5)计算分析. 参照武彦芳[11]的方法对种子的发芽率和发芽势进行计算:

2 结果与分析
2.1 秋水仙素对药用蒲公英种子萌发的影响
从表1 中可看出清水处理的对照组发芽率最高,0.5%秋水仙素处理的对种子发芽率最低,总体呈现出发芽率与处理浓度成反比的关系.种子萌发过程中,对照组发芽率最高,秋水仙素处理的种子发芽率受到不同程度抑制,随着处理浓度的提高,种子发芽率逐渐下降,可能是秋水仙素对种子产生了毒害作用,导致种子发芽率降低.

表1 不同秋水仙素处理组合对种子萌发的影响
对照组和实验组的种子萌发情况均为浸泡3 天的萌发率最高、发芽速度最快,发芽势和发芽指数均高于浸泡1 天和5 天的发芽势和发芽指数.可见,浸泡3 天的种子吸水量最为适宜,有助于种子萌发,浸泡时间过长或过短均会导致种子萌发率的降低.
2.2 不同浓度秋水仙素处理对幼苗形态的影响
萌发10 天后,每处理组合中随机取出4 个幼苗拍照并进行形态比较分析(图1),再对每组进行幼苗胚根、胚轴和子叶长度测量,得到的结果见表2.图1 显示,经秋水仙素处理的种子与清水处理的种子相比,胚轴的直径明显增大,且随着秋水仙素处理浓度的提高,胚轴直径明显增加,胚芽和胚轴长度缩短,胚根出现黄化腐烂现象. 经秋水仙素处理后,蒲公英幼苗形态出现不同程度变异,出现三片子叶的幼苗,萌发初期,诱变剂对植物组织的正常生理环境造成破坏,导致形态的改变.

表2 不同秋水仙素处理组合对幼苗质量的影响

图1 不同浓度秋水仙素处理三天的幼苗形态
2.3 秋水仙素对蒲公英根的影响
秋水仙素处理后,对蒲公英的根生长有不同作用.通过使用MICROTK SANMAKER i800plus 对处理后移栽成活的三株蒲公英根的长度、表面积、平均直径进行测定(图2、表3). 实验组1 总根长、表面积均小于对照,这可能是秋水仙素导致多次加倍,从而使植株表现矮小,发育迟缓.实验组2 主根长度和平均直径明显大于对照组,总根长和根表面积远小于对照组总根长,说明实验组2 侧根极不发达.实验组3 根的平均表面积和平均直径明显大于正常组的平均根表面积和直径,效果较好,根系发达.

图2 对照组和实验组蒲公英的根对比图
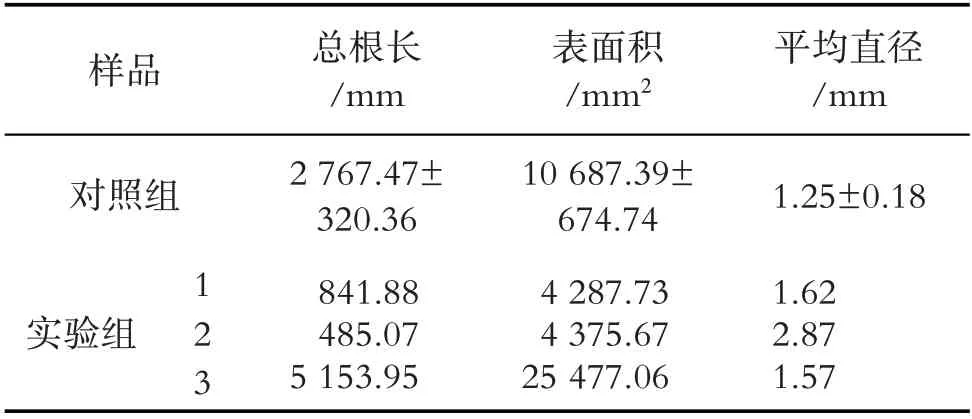
表3 秋水仙素对蒲公英根的影响
2.4 气孔密度观察
实验组移栽成活四个月后,撕取下表皮,用光学显微镜观察正常蒲公英和经秋水仙素处理的蒲公英叶片下表皮气孔的大小及气孔数目.在10×40倍下,观察气孔的数目,统计十个视野范围内气孔的数量,通过在显微镜下观察正常蒲公英和加倍蒲公英叶片的表皮气孔(图3),发现对照组蒲公英叶片气孔47个左右,秋水仙素处理的蒲公英叶片气孔每个视野27 个左右.经处理的蒲公英叶片气孔数明显少于对照组的蒲公英叶片气孔.

图3 秋水仙素处理获得植株和正常植株叶片气孔
3 结论与讨论
3.1 秋水仙素对蒲公英种子萌发的影响
秋水仙素对蒲公英种子萌发率呈现出处理浓度与种子萌发率成反比的关系,且第三天浸泡处理种子的萌发率最高.随着秋水仙素处理浓度的提高,药用蒲公英种子的发芽率明显下降,这一结果与前人研究结果一致[12],可能是因为秋水仙素本身的毒性对蒲公英种子产生了毒害作用,抑制种子的萌发,导致发芽率的降低.在处理浓度相同时,三天浸泡处理的萌发率均为最高,猜测是因为浸泡三天的蒲公英种子吸水达到一个适宜状态,种子生理活性较强,有利于种子的萌发. 徐佳琦等[13]在秋水仙素对洋紫荆种子处理的实验中表明:在秋水仙素处理浓度相同时,随着处理时间的增加,其发芽率也呈现先上升后降低的趋势,处理24h 的发芽率显著大于其他处理时间,二者趋势相同,但最佳浸泡时间存在差异,这说明适宜的浸泡处理时间有利于种子的萌发,但不同植物种类的种子,其适宜浸泡处理时间不同.
3.2 秋水仙素对蒲公英幼苗的影响
秋水仙素处理对蒲公英幼苗影响主要体现在胚轴增粗缩短、子叶明显增厚.方庆[14]在对石榴种子的研究中表明石榴种子在经秋水仙素处理后,其幼苗冠幅大多比未经处理的幼苗冠幅大. 梁海峰等[15]在对红肉火龙果种子的研究中也提出经秋水仙素处理后的幼苗与对照相比出现一些形态上的变异,表现为幼苗矮化、生长缓慢、子叶肥厚、胚轴膨大,说明秋水仙素对不同幼苗的影响不同,具有个体差异.本实验中发现秋水仙素处理对胚根影响较大,具有毒害作用[6],经处理过的胚根易发黑损坏,导致胚轴部难以生长出新胚根,从而导致幼苗营养耗尽后死亡,这也是导致后期蒲公英存活率低的主要原因;但秋水仙素对蒲公英种子胚轴和子叶的诱导效果较好,其胚轴明显缩短,子叶明显增厚,可能是染色体加倍产生了变异,但这种胚根损坏的幼苗不能进行正常的生长,难以形成正常的根系. 因此,对秋水仙素处理的蒲公英种子,应采取激素诱导或者组织培养的方式,可获得大量可供利用的诱导材料,为进一步选育提供材料基础.
3.3 秋水仙素诱导对植株的影响
秋水仙素诱导对蒲公英的影响是不同的.通过对存活三株的蒲公英进行观察发现,地上部分三株蒲公英在形态上均存在叶片增厚的现象,这与基因剂量效应使多倍体细胞体积、植物器官增大,使之表现出巨大性有关[16,17];在气孔特征上出现单位面积内气孔数减少,气孔增大的情况,这一结果与前人研究一致[18],根据其叶片增厚和气孔的变化,可初步认定这三株蒲公英均为加倍植株.其中一株较正常植株根系更加发达,生长更加旺盛,猜测可能成功加倍,达到最佳倍性,从而使植株表现优良;另外两株根系体积较正常明显缩小,叶片产生卷曲,有可能发生倍性混杂,从而使植株表现弱小,生长势变弱,说明秋水仙素对蒲公英倍性可能会有产生不同的效果,这方面还需要结合流式细胞仪以及染色体观察,确定其倍性,从而为进一步开发利用提供基础生物学基础.

