TRIM37在宫颈癌中的表达及临床意义
刘雅雯 章玲玲 胡本辉 李 凌
全球调研数据显示,在女性妇科恶性肿瘤中,宫颈癌的发病率仅次于乳腺癌[1]。TRIM37是TRIM家族中的一员,位于17q22-23染色体上,是具有RING结构域的E3泛素化连接酶[2]。已有文献报道,TRIM37发生突变可与15种以上的疾病相关[3-5]。研究证实TRIM37在多种肿瘤中呈过表达状态,并发挥着多种重要的生物学功能[2,6-7]。然而,TRIM37在宫颈癌组织中的表达情况、生物学功能及机制尚不明确。本研究旨在探讨TRIM37在宫颈癌组织中的表达情况,分析TRIM37的表达与宫颈癌患者生存间的关系,以及可能影响患者生存预后的相关因素。
1 材料与方法
1.1 一般资料
选择2012年1月至2012年12月间经病理确诊的131例宫颈癌患者,获取这些患者的宫颈癌组织、癌旁组织(与病灶之间的距离大于2 cm)石蜡标本;标本由我院肿瘤科及病理科提供。选择的癌组织及癌旁组织均经过病理科医师确定。收集患者的一般临床病理资料。除此之外,2019年10月至2020年2月期间,收集我院8对新鲜的宫颈癌组织标本和成对的相邻宫旁组织标本供后续研究所用。分期标准选用的是2018年国际妇产科联盟FIGO 提出的标准。总生存时间(overall survival)是确诊日至随访截止日或死亡日。
1.2 方法
1.2.1 主要试剂及仪器 TRIM37兔抗人单克隆抗体购自美国GeneTex公司。辣根过氧化物酶标记山羊抗兔一抗、二抗购自北京全式金公司。RIPA裂解液购自BOSTER公司。ECL Western blot Kit购自Pirece公司。
1.2.2 免疫组化 常规石蜡包埋、切片、脱蜡、水化。加入抗TRIM37蛋白抗体(1∶80),4℃过夜,加二抗,DAB显色,苏木精复染,常规脱水,中性树脂封片。阳性结果判定需结合染色深浅程度及染色肿瘤细胞在总面积中的占比来判断。染色深浅情况判断:未染色=0分,淡黄色=1分,棕黄色=2分,褐黄色=3分;同时通过使用光学显微镜(×200)对肿瘤细胞进行观察,选择5个显微镜下的视野,对染色肿瘤细胞进行计数,计算其在总面积中的占比:无阳性细胞=0分,阳性细胞占比<25%=1分;阳性细胞≥25%~50%=2分,阳性细胞占比>50%=3分。根据两者乘积总分将其分为TRIM37低表达组(得分<4分)和TRIM37高表达组(得分>4分)。
1.2.3 Western blot检测宫颈组织中TRIM37蛋白的表达 宫颈组织标本于液氮中研磨成粉状,加入RIPA裂解液,冰浴裂解,BCA法对蛋白样品进行定量;上样;电泳每个组织样本取等量蛋白进行SDS-PAGE凝胶电泳,转膜,取出PVDF膜,TRIM37向一抗、二抗中加入适量的封闭液对其进行稀释,洗膜,二抗封闭2 h,ECL发光,暗室压片。使用红光照射等,对X光片进行裁剪,计算TRIM37条带灰度值与GAPDH条带灰度值的比值来表示TRIM37蛋白表达水平。
1.3 统计学方法
采用SPSS Statistics22 统计软件包。应用卡方检验(χ2)分析TRIM37的表达与临床病理特征参数间的关系。Kaplan Meier绘制生存曲线。COX回归进行单因素及多因素分析。当P<0.05,差异具有统计学意义。
2 结果
2.1 TRIM37在宫颈癌组织与癌旁正常组织中的表达差异
免疫组化对样品组织进行检测,结果显示,相较于癌旁正常组织,TRIM37在肿瘤组织中有较高的表达水平。此外,TRIM37在Ⅲ~Ⅳ期较Ⅰ~Ⅱ期的组织中表达增高。另外,本研究还显示,在8对新鲜的宫颈癌组织中,其中7对组织中TRIM37蛋白表达水平相对较高(图1)。
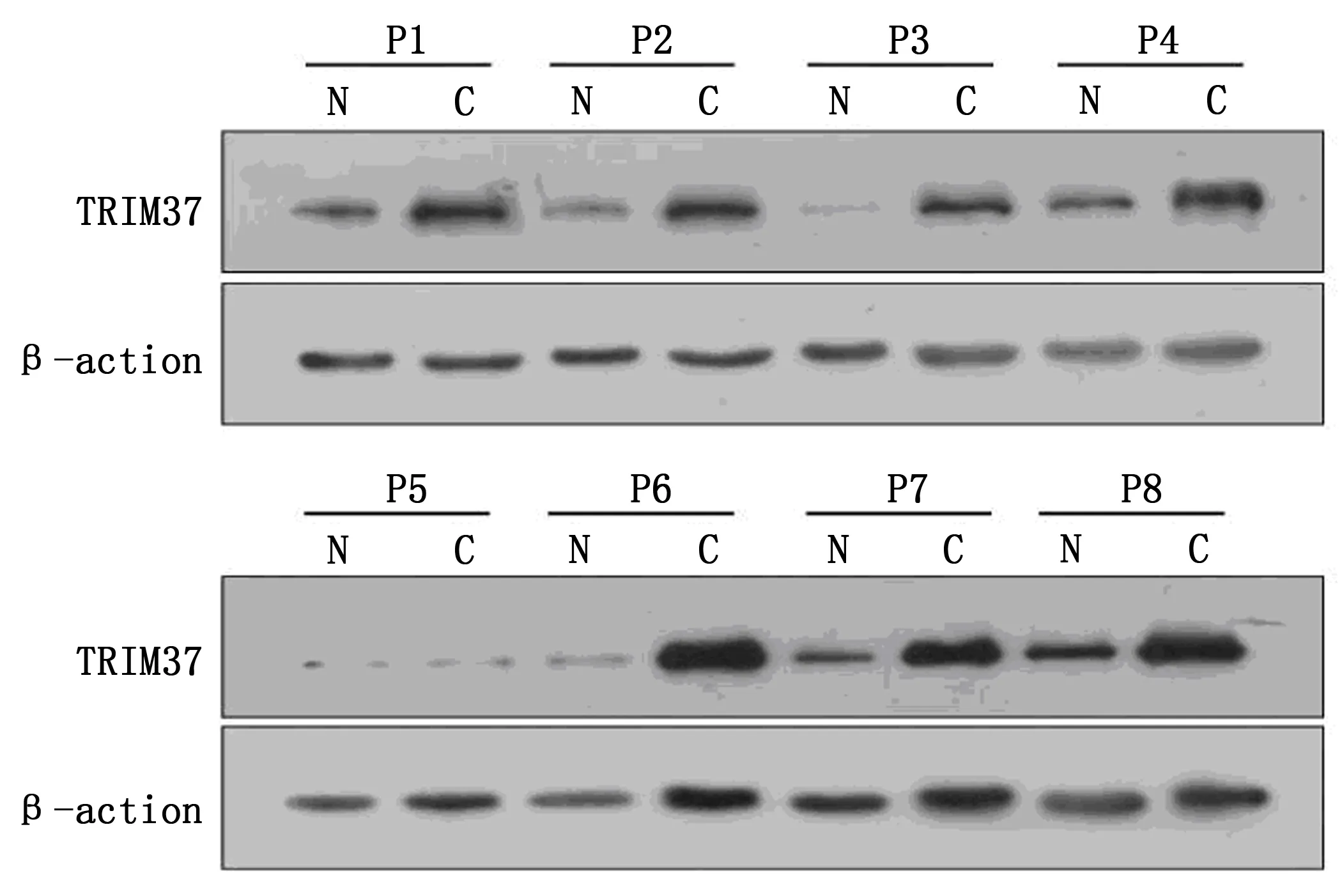
注:N为癌旁组织;C为癌组织。
2.2 TRIM37与宫颈癌临床病理特征间的关系
TRIM37高表达与低表达的患者分别有39例、92例。本研究中TRIM37表达率为29.8%。卡方检验结果显示,在宫颈癌组织中,TRIM37的高表达与肿瘤直径(P=0.005)、淋巴结转移(P=0.007)、FIGO分期(P=0.000)密切相关,与年龄(P=0.175)、病理类型(P=0.074)等因素无显著关联。见表1。
2.3 TRIM37与宫颈癌患者生存预后的关系
本研究的中位随访时间为62个月(9~96个月),所有患者整体的中位OS为56个月(95%CI:41.342~70.658)。TRIM37低表达的患者,中位OS为70个月(95%CI:54.538~85.462);而TRIM37高表达组的中位OS为40个月(95%CI:34.653~45.347)。TRIM37高表达组与低表达组患者的5年生存率分别是21.34%、53.25%。 随后我们对2组患者进行了生存分析,结果提示:2组患者的生存差异有统计学意义(P=0.001)。见图2。
2.4 预后影响因素分析
单因素分析结果表明: FIGO分期(P=0.000)、肿瘤直径(P=0.002)、淋巴结转移(P=0.000)、TRIM37表达(P=0.000)与生存预后密切相关;为了减少统计偏倚,我们对单因素分析结果中有意义的因素进行了COX多因素分析,最终分析结果表明:FIGO分期晚(P=0.000)、淋巴结转移(P=0.020)、TRIM37高表达(P=0.002)与宫颈癌患者生存差密切相关。见表2。

表2 与宫颈癌患者预后相关的COX因素分析
3 讨论
RBCC结构域作为TRIM家族蛋白中的特征结构首次在非洲爪蟾核因子(XNF7)中被发现[8]。TRIM37是其家族中的一员,参与了机体的多种生理及病理过程。多项报道证实,TRIM37的高表达与多种肿瘤的预后差密切相关,或可成为肿瘤治疗的潜在靶标[9-13]。
既往的研究已证实TRIM37在多种肿瘤中呈高表达,且与生存预后差密切相关。Zhao等[14]报道TRIM37在肠癌细胞系HCT116中呈高表达,且在蛋水平也得到了验证。随后,Li等[15]的实验结果证实,无论是mRNA还是蛋白水平,与癌旁组织及正常组织相比,TRIM37在非小细胞肺癌组织及细胞系中均呈高表达,且与预后差密切相关。研究者分析了189例肺癌患者的蜡块组织,结果证明TRIM37表达升高与侵袭性强相关,同时该研究结果还显示TRIM37表达高的患者相较于表达低的患者生存期明显缩短(28个月vs.61个月);且多因素分析结果提示,TRIM37与较晚的临床分期是非小细胞肺癌患者的预后不良因素。为了明确TRIM37在胃癌中的功能,Chen等[16]在对55对胃癌及癌旁组织的检测中发现,TRIM37在胃癌组织中的表达均高于癌旁组织且TRIM37表达高的患者生存期更短;因素分析结果可知,胃癌患者的T分期(P<0.001)、pTNM分期(P=0.001)、淋巴结转移(P<0.001)与TRIM37的表达密切相关,因此在胃癌中,TRIM37也被认为是预后不良因素。也有研究者分析了肝癌中TRIM37与患者临床病理因素的关系,结果发现:TRIM37高表达与肿瘤分期晚(P=0.002)、肿瘤直径大于5 cm(P=0.025)相关;同时还发现TRIM37高表达的患者,其总生存时间明显缩短(P=0.029)[7]。该研究结果认为TRIM37可成为肝癌的独立预后因素。本研究同样证明TRIM37在宫颈癌组织中呈高表达,而且TRIM37在Ⅲ~Ⅳ期较Ⅰ~Ⅱ期的宫颈癌中表达更高。生存分析结果提示:相较于TRIM37低表达患者而言,TRIM37高表达的患者生存期明显缩短(40个月 vs.70个月;P=0.001),低表达者中位生存期几乎是高表达者的两倍。COX回归分析探索影响生存的相关因素。结果发现:FIGO分期晚、淋巴结转移、TRIM37高表达与生存差密切相关。以上均表明本研究的结果与上述既往的研究结果相似,即均可证明TRIM37在肿瘤的进程中发挥着促癌作用。但本研究也存在一定的局限,由于样本量较少无法进行更详尽的因素分析可能造成明显的生存差异,如:纳入患者的分期遵循FIGO2009分期原则且未能进行更详尽的分期,病理类型仅将其分为鳞癌与非鳞癌,实际上非鳞癌中包括多种病理类型,且生存预后本身存在较大的差异,以上均可能影响结果。
综上所述,本研究初步证明TRIM37在宫颈癌组织中的表达高,其与宫颈癌的不良预后密切相关。然而,TRIM37能否成为宫颈癌治疗的新靶标,仍需更大样本量,进行更详细的亚组分析来验证这一结果。后续的研究中,我们将探讨TRIM37在宫颈癌的发生、发展中发挥的生物学功能及机制,以明确其在宫颈癌中的意义。

