丝裂原激活蛋白激酶激酶激酶激酶4在动脉粥样硬化易损斑块形成中的调节作用
陶晓芳 王雅洁 王文斌 费年华
咸宁市中心医院(湖北科技学院附属第一医院)1老年病科,2甲状腺乳腺外科(湖北咸宁 437000)
动脉粥样硬化(atherosclerosis,AS)是冠心病的主要病因[1]。大约60%的心肌梗死是由斑块破裂引起的[2]。易损的AS 斑块具有脆弱、不稳定的结构,是急性冠脉综合征最常见的病因[3]。越来越多的证据表明,细胞凋亡是易损斑块形成的关键。抑制细胞凋亡可抑制斑块破裂并预防急性心血管事件[4]。研究发现,血管紧张素Ⅱ(angiotensin Ⅱ,Ang Ⅱ)通过对高血压的间接诱导作用和对血管壁的直接作用来介导AS 发病机制[5]。动物和临床试验证明,Ang Ⅱ受体阻滞剂可以降低斑块破裂和冠状动脉血栓形成的风险[6-7]。然而,Ang Ⅱ介导的易破裂斑块形成的潜在机制需要进一步研究。丝裂原激活蛋白激酶激酶激酶激酶4(mitogen-activated protein kinase kinase kinase kinase 4,MAP4K4)是哺乳动物STE20/MAP4K 家族中的丝氨酸/苏氨酸激酶,参与多种生物过程,例如细胞运动、细胞增殖和细胞骨架的重排[8]。已发现Map4k4 可加速AS 和血管炎症[9]。最近一项研究表明,小鼠骨髓间充质干细胞分泌的外泌体通过抑制Map4k4 减缓ApoE-/-小鼠AS 斑块的形成[10]。然而,Map4k4 与AS 斑块稳定性之间的关联尚不清楚。因此,本研究假设Map4k4 可能参与AngⅡ对AS 病变中巨噬细胞凋亡和斑块稳定性的影响。为了验证这一假设,研究采用Ang Ⅱ联合或不联合Lenti-shMap4k4 和Lenti-Map4k4 处理ApoE-/-小鼠和小鼠腹腔巨噬细胞,探讨Map4k4 在巨噬细胞凋亡和AS 斑块易损性中的作用。
1 材料与方法
1.1 动物实验分组 32只雄性ApoE-/-小鼠(6 ~8周龄)购自北京维通利华实验动物技术有限公司。小鼠在标准条件[温度(22 ± 1)℃;湿度55% ~60%;12 h明暗循环]下饲养,可自由获取水和食物。适应一周后,将小鼠随机分为四组(每组8 只):Control组、Ang Ⅱ组、Ang Ⅱ+ shMap4k4(shMap4k4)组(小鼠尾静脉注射Lenti-shMap4k4)和AngⅡ+ Map4k4(Map4k4)组(小鼠尾静脉注射Lenti-Map4k4)。除Control 组小鼠外,Ang Ⅱ组小鼠按照标准量[1 000 ng/(min·kg)]配制微量渗透泵,并在常规麻醉下埋入颈背部皮下12周。在给予Ang Ⅱ4周和8周时,Ang Ⅱ+shMap4k4组通过鼠尾静脉向小鼠注射100 μL携带shMap4k4的慢病毒(1×108TU/mL),和Ang Ⅱ+Map4k4 组通过鼠尾静脉向小鼠注射100 μL携带Map4k4质粒的慢病毒(1×108TU/mL)。在研究结束时(埋入颈背部皮下12 周后,即实验开始后第13 周的第1 天),处死小鼠,收集标本。本研究已通过本院伦理委员会审查(批号:2019 第(03)号)。
1.2 细胞培养和转染 通过用冰冷的Dulbecco 改良的Eagle′s 中/高糖(DMEM,美国Hyclone 公司)冲洗腹腔分离C57BL6J雄性小鼠腹腔巨噬细胞。细胞接种在含10%胎牛血清(Hyclone)和1%青霉素/链霉素(美国Gibco 公司)的DMEM/高糖培养基中培养。巨噬细胞用不同浓度Ang Ⅱ(0、5、100、200、500、1 000 μmol/L)处理24 h或200 μmol/L Ang Ⅱ处理不同时间(0、6、12、24、48 h),通过Western blot 分析巨噬细胞中Map4k4 蛋白表达情况。为了敲低Map4k4 或过度表达Map4k4,用慢病毒携带靶向小鼠Map4k4的shRNA(GGACCAAGTTAGGTTCCAGCTAA,汉恒生物科技(上海)有限公司)(Lenti-shMap4k4)或含有启动子Map4k4 上游区域的质粒构建物(汉恒生物科技(上海)有限公司)(Lenti-Map4k4)转染巨噬细胞48 h。为了考察Map4k4 对Ang Ⅱ诱导的小鼠腹腔巨噬细胞凋亡影响,将细胞实验分为两部分,第一部分考察Map4k4 敲低对巨噬细胞凋亡影响,细胞分为:Control 组、Ang Ⅱ组、shMap4k4 组、Ang Ⅱ+shMap4k4组。其中,Control组加入DMSO处理24 h;Ang Ⅱ组加入200 μmol/L Ang Ⅱ处理24 h;shMap4k4 组用shMap4k4 转染巨噬细胞48 h,加入DMSO处理24 h;Ang Ⅱ+shMap4k4组用shMap4k4转染巨噬细胞48 h,加入200 μmol/L Ang Ⅱ处理24 h。第二部分考察Map4k4 过表达对巨噬细胞凋亡影响,细胞分为:Control 组、Ang Ⅱ组、Map4k4 组、Ang Ⅱ+Map4k4 组。其中,Control 组加入DMSO 处理24 h;Ang Ⅱ组加入200 μmol/L Ang Ⅱ处理24 h;Map4k4组用Map4k4转染巨噬细胞48 h,加入DMSO处理24 h;Ang Ⅱ+Map4k4组用Map4k4转染巨噬细胞48 h,加入200 μmol/L Ang Ⅱ处理24 h。
1.3 Western blot 分析 使用RIPA 从巨噬细胞中提取总蛋白。并使用BCA 法(美国Pierce 公司)测定蛋白质浓度。样品(各20 μg)在10%SDS-PAGE凝胶上分离,并转移至聚偏氟乙烯(PVDF)膜(美国Millipore 公司)。膜用5%脱脂牛奶封闭后,与不同的一级抗体孵育过夜:Map4k4(英国Abcam 公司),抗切割半胱天冬酶3(c-Caspase3,美国CST 公司),抗Bcl-2(CST),抗Bax(CST)和β-actin(美国Sigma-Aldrich 公司)(稀释度均为1∶1 000)。然后用PBS 清洗膜,并用辣根过氧化物酶(HRP)偶联的山羊抗兔二级抗体(Abcam;1∶10 000)在室温下孵育1 h。洗涤后,PVDF 膜与ECL 底物一起孵育以在印迹上产生化学发光。利用Image J 进行密度分析,定量蛋白质条带。
1.4 RNA分离和实时定量PCR 使用TRIzol 试剂(美国Invitrogen 公司)从培养细胞中分离总RNA。纯化的RNA 通过使用逆转录第一链cDNA 合成试剂盒(日本Takara 公司)反转录成cDNA,并通过SYBR Premix Ex TaqTMII(Takara)进行实时定量PCR 分析。使用标准的2-ΔΔCt(周期阈值)方法测定mRNAs 的相对表达水平。β-actin 作为内源性对照用于标准化。本研究中的引物为:小鼠Map4k4:(正向):5′-GAAGCAAGAGAGAGAGAGCAAGAG-3′(反向):5′-CCTCGAGAGAGAGAGAGAG-3′;小鼠β-actin(正向):5′-GTGACGTTGACATCCGTAAA-3′(反向):5′-TAAAACGCAGCTCAGTAACA-3′。
1.5 组织病理学染色和免疫荧光分析 对所有小鼠,采集主动脉根部包埋在最佳切割温度的化合物(OCT)中,然后连续切片成6 μm厚的切片。切片用苏木精/伊红(HE)、油红O(Sigma)、Masson 染色(北京Solaibio公司)和抗α-SMA抗体(Abcam,1∶150)和抗F4/80 抗体(Abcam,1∶100)染色。油红O 染色用于脂质积累分析;Masson 染色用于胶原分析;α-肌动蛋白免疫荧光染色用于平滑肌细胞分析;F4/80染色用于巨噬细胞分析。切片通过F4/80和Map4k4一级抗体的双重免疫荧光染色,并在4 ℃下孵育过夜,然后在室温下与特异性荧光标记二级抗体孵育2 h。使用荧光倒置显微镜捕获荧光信号,并使用Image J 对F4/80+Map4k4+细胞进行量化。斑块易损性指数=(巨噬细胞+脂质核心)阳性染色面积/(平滑肌细胞+胶原)阳性染色面积。
1.6 TUNEL 染色 采用原位TUNEL 试剂盒(瑞士Roche 公司)检测AS 病变中的细胞凋亡。小鼠主动脉根部的F4/80+TUNEL+细胞首先用F4/80+一抗在37 ℃染色2 h,然后依次与FITC 标记的山羊抗小鼠IgG 抗体和TUNEL 反应混合物在37 ℃孵育1 h。使用荧光倒置显微镜捕获荧光信号,并使用Image J 进行量化。
1.7 血浆AngⅡ水平分析 从小鼠眼眶静脉收集血样。根据小鼠外周血Ang ⅡELISA 检测试剂盒(武汉云克隆科技股份有限公司)检测血浆AngⅡ水平。
1.8 统计学方法 所有统计分析均由Graph Prism 5.0 进行。数据表示为平均值±标准差。两组之间的比较采用Student′st检验。多组比较采用单向方差分析和Tukey检验。P<0.05为差异有统计学意义。
2 结果
2.1 AngⅡ加剧ApoE-/-小鼠AS 发展并促进斑块易损性 为了证实AngⅡ诱导的AngⅡ动脉粥样硬化小鼠模型(Ang Ⅱ组小鼠),研究首先检测了小鼠血浆Ang Ⅱ浓度,发现Ang Ⅱ组小鼠血浆Ang Ⅱ浓度较Control 组显著升高(P<0.01,图1A)。与Control 组相比,Ang Ⅱ组小鼠主动脉根部的坏死核心大小显著扩大(P<0.01,图1B-D)。此外,Ang Ⅱ组小鼠显示巨噬细胞数量增加(P<0.01),但病变区域的胶原沉积减少(P<0.01),平滑肌细胞数量减少(P<0.01),表明存在易损斑块表型(图1E-J)。

图1 Ang Ⅱ加剧ApoE-/-小鼠AS 的发展并促进斑块易损性Fig.1 Ang Ⅱaggravated the development of AS and promoted plaque vulnerability in ApoE-/-mice
2.2 AngⅡ诱导巨噬细胞凋亡,并在体内外上调Map4k4 通过TUNEL 和F4/80 联合染色,结果发现,AngⅡ组小鼠主动脉根部中巨噬细胞的凋亡比例高于Control 组(P<0.05,图2A),并且AngⅡ组小鼠斑块内巨噬细胞中Map4k4 的表达显著上调(P<0.05,图2B)。与体内结果一致,AngⅡ显著增加小鼠腹腔巨噬细胞Map4k4 的表达(P<0.05),并在200 μmol/L Ang Ⅱ和处理24 h时达到峰值(图2C)。

图2 AngⅡ诱导巨噬细胞凋亡,并在体内外上调Map4k4Fig.2 AngⅡinduced apoptosis of macrophages and up-regulated Map4k4 in vitro and in vivo
2.3 Map4k4介导AngⅡ处理的ApoE-/-小鼠AS病变的发展和易损斑块的形成 为了评估AngⅡ存在时Map4k4对AS的影响,通过尾静脉注射Lenti-Map4k4 shRNA 来抑制Map4k4 表达或Lenti-Map4k4 来诱导小鼠中Map4k4过度表达。通过实时PCR 检测证实在主动脉中出现Map4k4 抑制或过表达(P<0.05,图3A)。各组小鼠血浆Ang Ⅱ浓度均在15 μmol/L以上,不受慢病毒注射的影响(图3B)。与AngⅡ组小鼠相比,AngⅡ+shMap4k4 组小鼠的主动脉根部坏死核心大小显著减少,但在Ang Ⅱ+Map4k4 组小鼠中显著增加(P<0.05,图3C-E)。同时,AngⅡ+shMap4k4 组显著降低了脂质积累、巨噬细胞浸润和斑块易损指数(均P<0.05),并增加了斑块内的胶原沉积和平滑肌细胞数量(均P<0.05),而Ang Ⅱ+Map4k4 组的作用相反(图3F-K)。

图3 Map4k4 介导AngⅡ处理的ApoE-/-小鼠AS 病变的发展和易损斑块的形成Fig.3 Map4k4 mediated the development of AS lesions and the formation of vulnerable plaques in AngⅡ-treated ApoE-/-mice
2.4 Map4k4 通过减少巨噬细胞凋亡促进AngⅡAS 小鼠易损斑块的形成 使用Map4k4 和F4/80共染色评估了Map4k4 在AS 斑块巨噬细胞中的表达,发现AngⅡ组中Map4k4+F4/80+细胞的数量显著增加(P<0.05),修饰的慢病毒可以有效地敲低或上调Map4k4(P<0.05,图4A)。然后使用具有F4/80 共染色的TUNEL 检测巨噬细胞中的细胞凋亡。与AngⅡ组小鼠相比,AngⅡ+Map4k4 组增加了TUNEL+F4/80+细胞的数量(P<0.05)。而AngⅡ+shMap4k4 组沉默了Map4k4 会减少TUNEL+F4/80+细胞的数量(P<0.05),见图4B。

图4 Map4k4 通过减少巨噬细胞凋亡促进Ang ⅡAS 小鼠易损斑块的形成(n=6)Fig.4 Map4k4 promoted the formation of vulnerable plaques in Ang ⅡAS mice by reducing macrophage apoptosis(n=6)
2.5 Map4k4 促进AngⅡ诱导的小鼠腹腔巨噬细胞凋亡 使用修饰的慢病毒转染实现了巨噬细胞中的Map4k4 敲低或过表达。Map4k4 敲低有效减弱了AngⅡ诱导的c-Caspase3、Bax 蛋白表达增强(P<0.05),并增强了Bcl-2 蛋白表达(P<0.05)。而Map4k4 过表达进一步增强了Ang Ⅱ的诱导作用(P<0.05,图5A-B)。
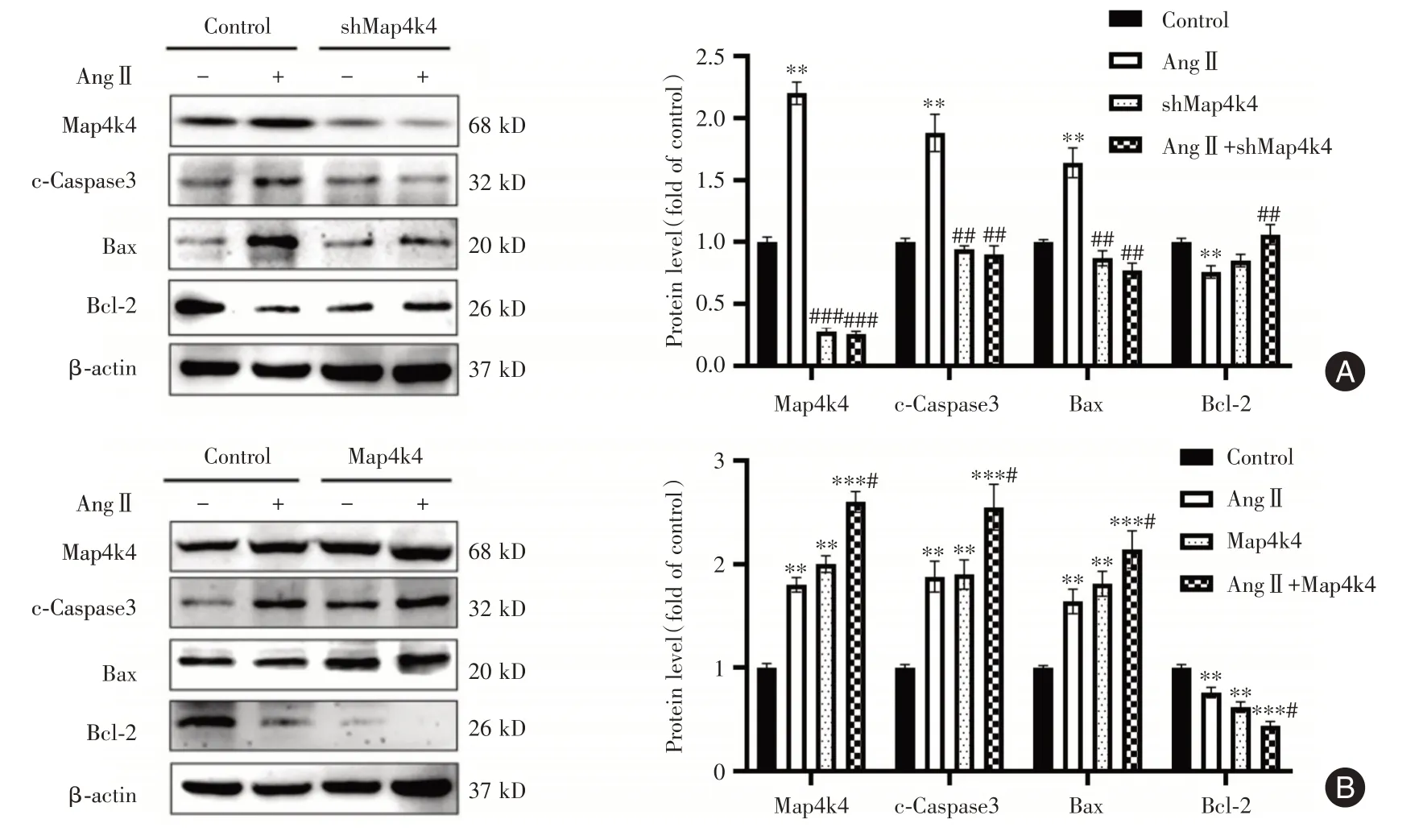
图5 Map4k4 促进Ang Ⅱ诱导的小鼠腹腔巨噬细胞凋亡(n=3)Fig.5 Map4k4 promoted Ang Ⅱ-induced apoptosis of mouse peritoneal macrophages(n=3)
3 讨论
急性冠状动脉综合征是常见的临床事件,会导致相当大的即刻死亡和冠状动脉意外发生。进一步了解斑块破裂的分子机制对于探索新的急性冠状动脉综合征治疗靶点至关重要[11]。AngⅡ作为一种有效的促炎细胞因子,其通过调节氧化应激、炎症反应和细胞增殖来促进AS,但潜在机制仍未明确[12]。先前研究报道,AngⅡ通过促进巨噬细胞中的组蛋白甲基化和抑制胆固醇流出来促进AS 的进展[13]。观察性研究表明,AngⅡ是急性心血管事件的独立危险因素。最近,急性冠脉综合征队列研究也证实了AngⅡ与斑块进展之间的关联[14]。然而,没有直接证据表明AngⅡ与巨噬细胞凋亡有关。本研究发现AngⅡ可以加速ApoE-/-小鼠AS 斑块的进展并促进斑块的不稳定性,包括更大的主动脉根部的病变面积和坏死核心,更多的巨噬细胞浸润以及病变区域的胶原沉积和平滑肌细胞数量减少。此外,TUNEL 染色表明巨噬细胞凋亡与AngⅡ诱导的ApoE-/-小鼠中不稳定斑块形成有关。最重要的是,AngⅡ上调了巨噬细胞中Map4k4 的表达。沉默Map4k4 可防止AngⅡ诱导的巨噬细胞凋亡和AS 中易损斑块的形成,表明Map4k4 可能是AngⅡ诱导AS 的潜在治疗靶点。
AS 是血管死亡的主要原因,通常由斑块破裂引起,进而导致血栓形成和血管闭塞[15-16]。巨噬细胞凋亡是AS 斑块发展的一个重要特征[17]。巨噬细胞凋亡极大地促进了不稳定的斑块形成,并且随着斑块中巨噬细胞凋亡的积累,坏死核心的形成加速,斑块容易破裂[18-19]。最终可能会发生与急性动脉粥样硬化血栓形成相关的血管疾病。研究表明,Map4k4 是一种促炎激酶,并且是介导多种细胞类型中TNF-α 的有害功能所必需的[20-21]。最近研究发现,巨噬细胞Map4k4 可调节细胞因子的释放,巨噬细胞衍生的细胞因子可促进小鼠和人类AS的进展[22]。因此,使用基因缺失策略敲低巨噬细胞中Map4k4表达可以改善AS[10]。本研究发现AngⅡ在体内和体外均促进巨噬细胞凋亡,并诱导Map4k4+F4/80+细胞的数量显著增加。通过沉默Map4k4会减少TUNEL+F4/80+细胞的数量,相应的斑块中脂质积累、巨噬细胞浸润和斑块易损指数降低,并增加了斑块内的胶原沉积和平滑肌细胞数量。此外,敲低Ang Ⅱ处理的巨噬细胞中Map4k4表达可以抑制caspase-3 的激活,下调了促凋亡Bax 的表达并上调了抗凋亡Bcl-2 的表达。总之,Map4k4在Ang Ⅱ诱导的巨噬细胞凋亡和易损AS斑块的发展中起重要作用。但是,本研究没有测试该调节中的其他凋亡途径,仍需要在未来进行探索。
总之,本研究发现Ang Ⅱ通过上调Map4k4 表达促进巨噬细胞凋亡,并进一步参与AS 中易损斑块的形成。Map4k4 可能是Ang Ⅱ诱导的AS 的潜在治疗靶点。深入了解Map4k4 对易损斑块形成的作用机制可能为预防急性冠状动脉综合征和不良心血管事件提供新的治疗方法。

