曲妥珠单抗联合帕妥珠单抗靶向治疗在HER2阳性乳腺癌的疗效评估△
陈 璐 关润年 周素珠
(1.开平市中心医院肿瘤一区 江门 529300;2.开平市中心医院消化科 江门 529300)
乳腺癌是一种恶性肿瘤,常见于女性,是女性死亡的最常见原因,好发于40到60岁的绝经前后的妇女[1]。乳腺癌是一种复杂的异质性疾病,根据组织学特征把它分为激素受体阳性、人表皮生长因子受体-2过表达(HER2+)和三阴性乳腺癌(TNBC)[2]。有研究表明,约有20%~25%的患者为HER2阳性的类型的乳腺癌患者[3]。而在临床应用中,检测乳腺癌的指标主要有以下3种:糖类抗原153(CA153)、糖类抗原125(CA125)、癌胚抗原CEA。其中CA153诊断乳腺癌的灵敏度高于80%。其他两种检测指标灵敏度仅有20%,所以在临床上CA153主要是乳腺癌的检测指标及预后情况,且有研究证实HER2也是乳腺癌预后判断的重要因素[4]。
激素反应性乳腺癌的主要治疗手段是内分泌治疗,以雌激素受体(ER)和HER2为靶点的药物,如他莫昔芬和曲妥珠单抗已广泛成为治疗乳腺癌的药物。曲妥珠单抗是治疗HER2阳性乳腺癌的重要靶向药物,也是目前临床应用首选的药物。帕妥珠单抗于2019年才正式进入临床应用,成为治疗HER2阳性乳腺癌的新的治疗药物,也是对曲妥珠单抗治疗HER2阳性乳腺癌的重要补充药物[5]。本研究主要针对曲妥珠单抗联合帕妥珠单抗靶向治疗在HER2阳性早期乳腺癌的临床疗效及预后进行分析,现报道如下。
1 资料与方法
1.1 一般资料
选取2018年5月-2019年8月我院收治的通过纳入及排除标准筛选出符合要求的126例HER2阳性乳腺癌患者为研究对象,依据治疗方式的不同,分为曲妥珠单抗治疗组(对照A组)、帕妥珠单抗治疗组(对照B组)、曲妥珠单抗联合帕妥珠单抗治疗组(试验组)各42例。年龄30~70岁,平均年龄(52.01±15.20),分为曲妥珠单抗组(对照A组),平均年龄(51.91±14.32)岁,绝经21例、未绝经21例,分期:I期8例、II期12例、III期16例、IV期6例;帕妥珠单抗组(对照B组),平均年龄(52.11±15.34)岁,绝经23例、未绝经19例,分期:I期10例、II期12例、III期15例、IV期5例;曲妥珠单抗联合帕妥珠单抗组(试验组),平均年龄(52.18±14.97)岁,绝经20例、未绝经22例,分期:I期9例、II期15例、III期14例、IV期4例。3组患者一般资料经组间对比无差异。
1.2 纳入指标
(1)经病理学及免疫组化检查确诊为HER2阳性乳腺癌患者;(2)首次接受药物治疗;(3)治疗前心电图作筛选检查,结果无明显异常;(4)评估生存期>12个月;(5)肿瘤体积>2cm;(6)患者及家属自愿参加试验。
1.3 排除指标
(1)临床病理资料不全者;(2)治疗期间接受其他抗肿瘤药物治疗者;(3)治疗期间出现严重不良反应者;(4)同时患有其他重大疾病者;(5)生存期低于12个月者。
1.4 治疗方法
依据国际乳腺癌治疗指南推荐的曲妥珠单抗用药方案:以每3周为1个周期,每3周重复给药一次,连续治疗4个周期。药物剂量:首次剂量8mg/kg,之后剂量为6mg/kg;帕妥珠单抗首剂量840mg,之后剂量为420mg,连续治疗4个周期。
1.5 观察指标
1.5.1检测3组HER2、CA153水平
通过酶联免疫吸附法检测3组治疗前后浓度水平。 HER2平均浓度≥15ng/mL为阳性,<15ng/mL为阴性。CA153参考值为0~25U/mL。
1.5.2临床疗效观察
按实体瘤临床疗效评价标准(response evaluation criteria insolid tumors 1.1,RECIST 1.1)标准[6]分为:完全缓解 (complete remission,CR):目标病灶均消失,其中任意病理性淋巴结短轴值减少必须<10mm。 部分缓解 (partial remission,PR):目标病灶直径的总和较基线至少减少30% 。病情稳定 (stable disease,SD):病灶缩小的程度没有达到PR,病灶增加的程度也没有达到PD水平,介于两者之间。疾病进展 (progressive disease,PD):以所有出来靶病灶直径之和最小值为对照,肿瘤病灶直径总和至少增加20%。另外,直径总和增加的绝对值必须增加至少5 mm。(CR+PR)作为治疗有效,(CR+ PR)/(CR+PR+ SD+ PD)为称为客观缓解率(objective remission rate,ORR),(CR+ PR+SD)/(CR+PR+ SD+ PD)为疾病控制率 (disease control rate,DCR)。
1.5.3观察3组不良反应
3组在治疗期间出现的不良反应主要有恶心呕吐、骨髓抑制、皮疹瘙痒、乏力、肝功能异常、心脏毒性等不良反应。依据国际治疗肿瘤通用的不良反应标准[7],对3组在治疗期间出现的不良反应进行统计评估。
1.6 统计学分析

2 结果
2.1 观察检测3组化疗前后血清中的HER2、CA153的水平
3组使用药物之前的浓度相比较,均无明显差异(P>0.05);3组治疗后与治疗前相比较,浓度水平均有显著降低(P<0.05);3组治疗后的组间比较,试验组的水平明显比对照组低(P<0.05),对照A组与对照B组相比较无明显差异(P>0.05),见表1。

表1 比较3组化疗前后血清中的HER2、CA153的水平的变化
2.2 比较3组临床疗效
试验组ORR及DCR明显高于对照A组与对照B组,且差异有统计学意义(P<0.05),见表2。
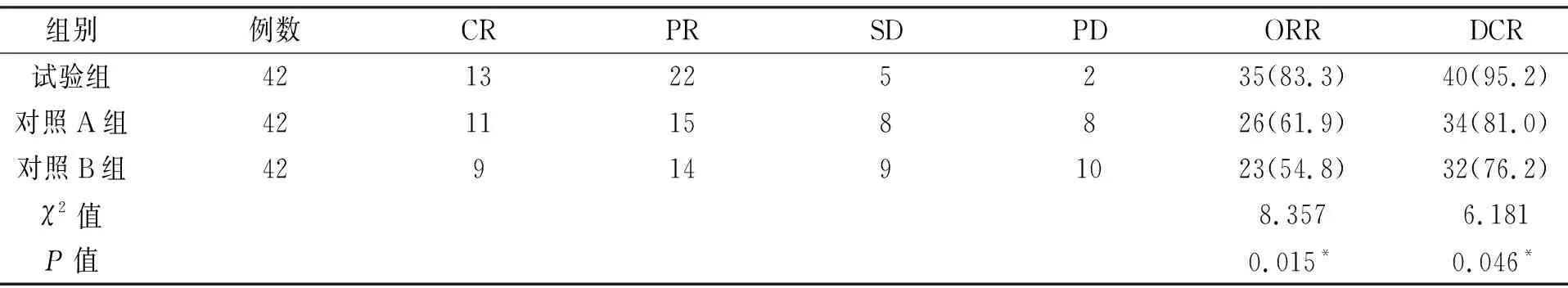
表2 3组HER2阳性乳腺癌患者临床治疗效果比较分析[n(%)]
2.3 比较3组化疗后不良反应的发生情况
试验组、对照A组、对照B组不良总发生率分别为16.7%、40.5%、47.6%。试验组不良总发生率显著低于对照A、B组,(P<0.05),见表3。

表3 3组HER2阳性乳腺癌患者治疗后不良反应分析[n(%)]
3 讨论
乳腺癌是在分子水平上有高度异质性的肿瘤疾病[8]。国内外大量文献研究发现,基于分子对乳腺癌进行分型,主要有ER(estrogen receptor,雌激素受体),PR(progesterone receptor,孕激素受体)以及HER2在乳腺癌的发生、发展及预后等过程中的起重要作用[9]。近年来,也有文献证实了HER2被发现在乳腺癌的发生和发展过程中发挥重要作用,且HER2阳性乳腺癌具有浸润性强、进展快速、复发风险高和预后差等临床特点[10]。
针对HER2阳性乳腺癌的治疗抗HER2药物如曲妥珠单抗、拉帕替尼和帕妥珠单抗等。作为目前临床应用最广的一线抗化疗药物,均可显著改善HER2阳性乳腺癌患者的治疗现状及预后[11]。曲妥珠单抗可直接对HER2的浓度进行降低,同时也有研究显示曲妥珠单抗可以通过对抗细胞凋亡蛋白Mc1的浓度的降低,增加HER2敏感性来促进细胞的凋亡。而帕妥珠单抗2012年就在美国通过FDA认证,其主要机制是通过对HER2与其他HER受体的杂二聚阻滞,抑制肿瘤细胞的生长[12]。依据国际不良反应评价系统4.0版,指出其最常见的不良反应包含骨髓抑制、消化系统反应、心脏毒性、口腔炎以及药物外渗引起的静脉炎或严重组织坏死及肝功能异常等[7]。帕妥珠单抗在临床上表现出良好的安全性和耐受性,乏力、恶心和呕吐等为其最常见的不良反应表现,但对心脏毒性相较于曲妥珠单抗试验没有明显降低。
本研究结果显示,3组治疗后与治疗前HER2、CA153浓度水平均有显著降低(P<0.05);组间比较,试验组明显比对照组低(P<0.05),提示曲妥珠单抗联合帕妥珠单抗靶向治疗较单独使用化疗药能明显降低HER2阳性乳腺癌中的HER2及肿瘤标志物CA153的浓度,相对于对照组疗效更佳,说明HER2、CA153可作为HER2阳性乳腺癌疗效及预后的判断因子。通过临床疗效的观察,试验组ORR及DCR明显高于对照A组与对照B组(P<0.05),提示曲妥珠单抗联合帕妥珠单抗靶向治疗较单独使用化疗药疗效更显著。通过对用药后的不良反应的统计分析,试验组的总发生率明显低于对照A组与对照B组,说明联合用药安全性相对较高。本研究证实了曲妥珠单抗联合帕妥珠单抗协同作用的显著疗效。
综上所述,本研究认为HER2阳性乳腺癌采用曲妥珠单抗联合帕妥珠单抗靶向治疗的疗效显著,安全性较高,但存在一定的不良反应,在临床使用过程中,需要加强不良反应监控,也可以通过研究也可通过检测血中HER2、CA153水平来判断治疗疗效及预后情况。本试验中纳入的样本量不多,存在一定的局限性,有待进一步研究。

