一次性使用无菌注射器中的易氧化物研究
赵煜松,王贵文,胡健,曾海霞(通信作者),甄晓兰,陈明,刁立琴
1 河北省药品医疗器械检验研究院 (河北 石家庄 050227);2 河北省药品审评中心·河北省医疗器械技术审评中心 (河北 石家庄 050091)
一次性使用无菌注射器属于二类医疗器械,被广泛应用于药物输注治疗中,其质量控制一般参照GB 15810-2019《一次性使用无菌注射器》[1]、YY/T 0573.3-2019《一次性使用无菌注射器第3部分:自毁型固定剂量疫苗注射器》[2]、YY/T 0573.4-2020《一次性使用无菌注射器 第 4部分:防止重复使用注射器》[3]。据统计,我国每年注射器产量约260亿支,其中1 ml疫苗注射器产量因新型冠状病毒肺炎疫情持续增加。历年国家级、省级医疗器械监督抽验发现,不合格的检测项往往集中出现在1 ml规格注射器的易氧化物项[4]。Kurmi等[5]在注射器活塞萃取液中发现了8种外来杂质;Yao等[6]对注射器中的双酚A迁移进行了测定;周文钊等[7]通过研究注射器的挥发性有机物残留,确定了残留物主要为环己酮;李永贵等[8-9]对注射器中的单体、抗氧剂1010的迁移进行了检测;管璐晗等[10]、薄晓文等[11]分别对注射器的浸出有机物进行了检测。业界一般认为,注射器的易氧化物可能来源于生产工艺、配方和灭菌中[12],其检测结果主要影响因素是活塞质量。然而这些均未能解释“为何小容量注射器易氧化物水平高于大容量注射器,即便是来自同一个厂家的产品”。本研究对注射器的结构和材料性能等方面进行了考察,确定了注射器结构因素、材料因素对易氧化物检测结果的影响,对注射器的质量控制进行了有针对性的研究。
1 实验材料
1.1 样品
不同厂家生产的不同规格的一次性使用无菌注射器。
1.2 试剂
高锰酸钾(1/5 KMnO4)滴定溶液标准物质[编号:GBW(E)081237 ]、硫代硫酸钠标准滴定溶液(天津市光复科技发展有限公司,批号:20210827),上述试剂均从有资质的试剂商店购买。实验用水为易普易达(EPED)实验室级超纯水机制备的高纯水。
1.3 设备
游标卡尺、电子天平BP121S、滴定管和移液管、容量瓶、碘量瓶、电热恒温干燥箱(DHG-9147A型),上述设备均经计量检定。
2 方法与结果
2.1 注射器萃取液制备
将每批次注射器取足量,按GB 15810-2019中附录G制备易氧化物萃取液Ⅰ和空白液:用注射器抽取实验用水至公称容量,排尽气泡,恒温(37~40 ℃)下放置1 h,制备萃取液Ⅰ;另取注射器同量,用同法注水后抽出活塞组件,设法保持密封,制备萃取液Ⅱ,同时制备空白液;注意制备萃取液Ⅰ时应确保活塞与萃取液充分接触,制备萃取液Ⅱ时应确保活塞不与萃取液接触。
2.2 橡胶材料萃取液制备
取与“2.1”相同数量的注射器,卸下活塞,用游标卡尺精密测定与萃取液接触的表面积(有效面积),并称重,计算均值作为单个活塞的表面积;按YY/T 0243-2016制备活塞的易氧化物供试液,取一定数量的整只活塞,按0.2 g(活塞)∶1 ml(水),恒温(37 ℃)下放置1 h,将水排出置于玻璃容器内,作为浸提液(制备不少于300 ml的浸提液);取1份同体积的水作为空白对照液。
2.3 注射器及外套组件的测定与结果
按GB 15810-2019中方法测定注射器易氧化物,精密量取萃取液Ⅰ20 ml,按GB/T 14233.1-2008中5.2.2方法二进行试验;精密加入0.002 mol/L 的高锰酸钾滴定液20 ml、硫酸溶液2 ml,煮沸3 min,迅速冷却,加入碘化钾1.0 g,密塞,摇匀;用0.01 mol/L 硫代硫酸钠滴定液滴定,滴定至近终点时,加入5滴淀粉指示液,继续滴定至无色,另取空白对照液同法操作,注射器萃取液与同批等体积的空白对照液相比,0.002 mol/L 的高锰酸钾溶液消耗量之差应不超过0.5 ml(A0)。
精密量取萃取液Ⅱ 20 ml,同法进行测定,最终结果为注射器外套组件的高锰酸钾溶液消耗量之差(A1),结果见表1。
2.4 橡胶材料的测定与结果
按YY/T 0243-2016的规定测定注射器活塞易氧化物,取“2.2”所述浸提1 h的浸提液20 ml,方法同“2.3”浸提液与同批等体积的空白对照液相比,0.002 mol/L的高锰酸钾溶液消耗量之差为橡胶原材料的易氧化物结果(A3),结果见表1。
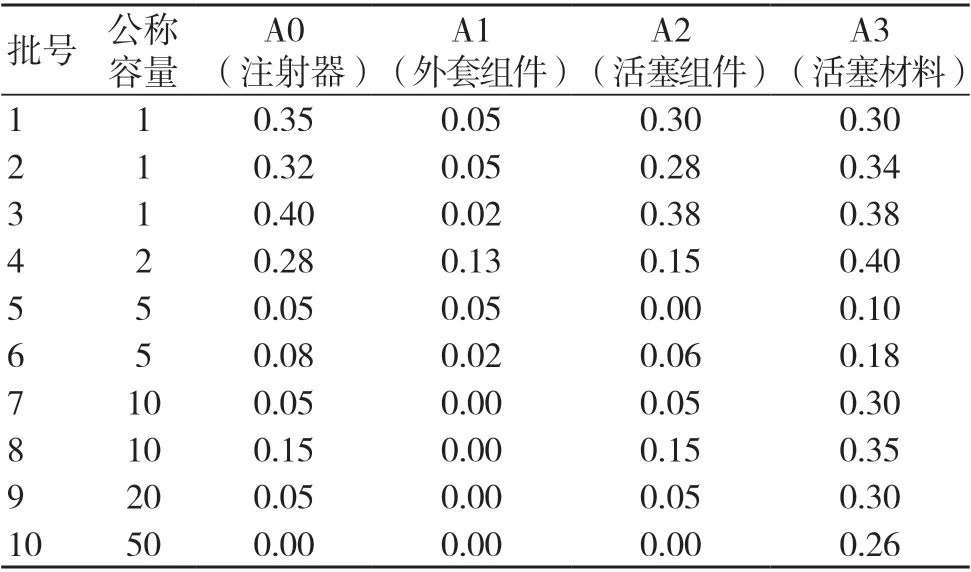
表1 各组成结构易氧化物结果(ml)
3 讨论
注射器的结构一般分为活塞组件和外套组件,材质为聚乙烯或聚丙烯,活塞往往采用天然橡胶或合成橡胶。GB 15810-2019中规定的润滑剂包括聚二甲基硅氧烷(用于三件式注射器)、油酸酰胺和芥酸酰胺(用于二件式注射器),这三种润滑剂均不溶于水,在制备萃取液时对易氧化物结果的影响较小,暂未考虑,本研究主要分析外套组件和活塞橡胶对易氧化物结果的影响。
3.1 公称容量与易氧化物的关系
分别选取规格为1(3批)、2(1批)、5(2批)、10(2批)、20 (1批)、50 ml(1批)的注射器进行检验,测定总的高锰酸钾溶液消耗量之差A0。注射器易氧化物检测结果随公称容量的增加而呈现两个梯度:1、2 ml小容积注射器易氧化物检测结果明显偏高,接近标准要求,公称容量大于5 ml后,易氧化物检测结果明显下降,渐趋于0,见图1。
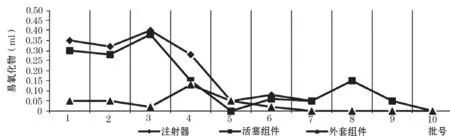
图1 一次性使用无菌注射器的易氧化物结果
3.2 外套组件与易氧化物的关系
同批注射器,测定外套组件的内表面积(零刻度线至公称容量线,锥头腔忽略不计),按“2.2”制备萃取液Ⅱ,测定高锰酸钾溶液消耗量之差A1,可以认为此数据是外套组件的易氧化物检测结果。从数据结果可以(图1)看出,外套组件公称容量与易氧化物检测结果相关度不明显,说明外套组件整体质量较好,在影响注射器易氧化物的因素中,外套塑料组件的影响较小;然而,4号样品检测出了一定量的易氧化物。
3.3 活塞组件与易氧化物的关系
注射器的高锰酸钾溶液消耗量之差(A0)-外套组件的高锰酸钾消耗量之差(A1),可以认为是活塞组件的易氧化物结果(A2)。
取相应的同批注射器,按“2.2”测定活塞有效表面积(活塞基准线以上直接接触浸提液的表面积)、质量,制备供试液,按“2.4”测定活塞橡胶材料的高锰酸钾溶液消耗量之差(A3)。
从数据结果(表2)可知,不同厂家、不同批次(10批次)的注射器,活塞所使用的橡胶材料易氧化物含量均较高,高锰酸钾溶液消耗量之差接近或等于YY/T 0243-2016中的要求(≤0.4 ml),只有5号样品稍好,说明各批样品的橡胶材料差别不大,均含有明显的易氧化物杂质。然而检测结果有一个很明显的特点,小容量注射器(如1、2 ml)的易氧化物检测结果更高,更接近标准要求上限,去除外套组件影响后,活塞组件(A2)和橡胶材料的易氧化物检测结果接近,大于5 ml 的注射器,易氧化物检测结果下降明显,甚至接近于0,A2也很小(图1)。
进一步研究注射器活塞有效表面积和橡胶用量对易氧化物的影响,GB 15810-2019和YY/T 0243-2016中均采用20 ml 供试液进行检测,为增强可比性,以制备20 ml 供试液所需样品为计算单元。如表2所示,1号样品1 ml 规格的注射器需20支(以公称容量计),20个胶塞总重3.99 g,7号样品10 ml 规格的注射器需2支,2个活塞总重3.44 g,对10批次样品统计后发现,活塞质量的相对偏差在1.98%~36.5%之间,主要偏差来源于活塞厚度和样式,10批次样品间无明显差异,说明活塞克重与注射器易氧化物检测结果无关,即橡胶材料用量与易氧化物检测结果无直接关系;活塞有效表面积与公称容量的比值相关,公称容量越小,比值越高,与药液的接触面积也就越大,溶出的易氧化物杂质越多,高锰酸钾溶液消耗量相应的也越高。1 ml 规格的注射器比值高达0.7左右(1~3号样品),A0、A2都很高,约等于A3(图2),5 ml 以上规格的注射器比值低于0.25,A2迅速下降到0.5 ml,约等于A0(图1),这也与近年来的注射器监督抽验结果相一致,即1 ml 的注射器常被检出不合格,而大容量的注射器从未被检出不合格。4号样品表现出一定的特异性,样品使用的橡胶材料A3最高,达到0.4 ml 的标准上限,因表面积/容积较小,A2下降至0.15 ml,外套组件0.13 ml 的测定值提示外套组件塑料材料的易氧化物风险,外套组件与药液的接触面积越大,越有利于杂质的溶出。外套组件一般采用医用的聚丙烯、聚丙烯专用料,执行标准中未对材料易氧化物的检测方法和标准做专门限定,外套组件对易氧化物的影响整体较小,本研究也未做进一步的探索。
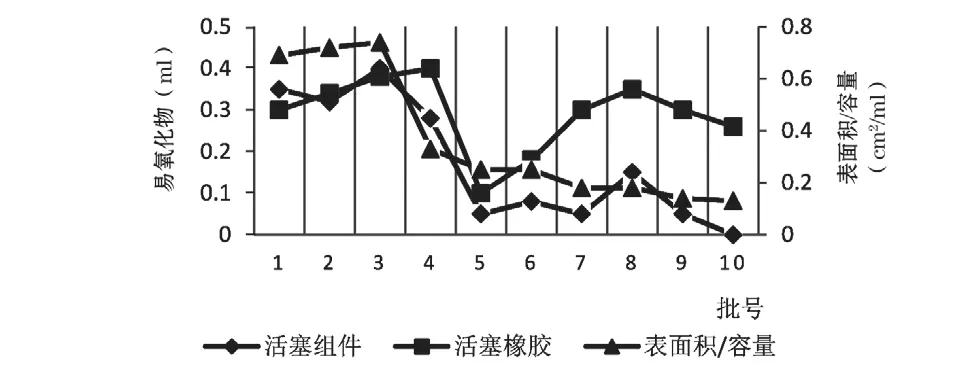
图2 活塞结构的易氧化物检测结果
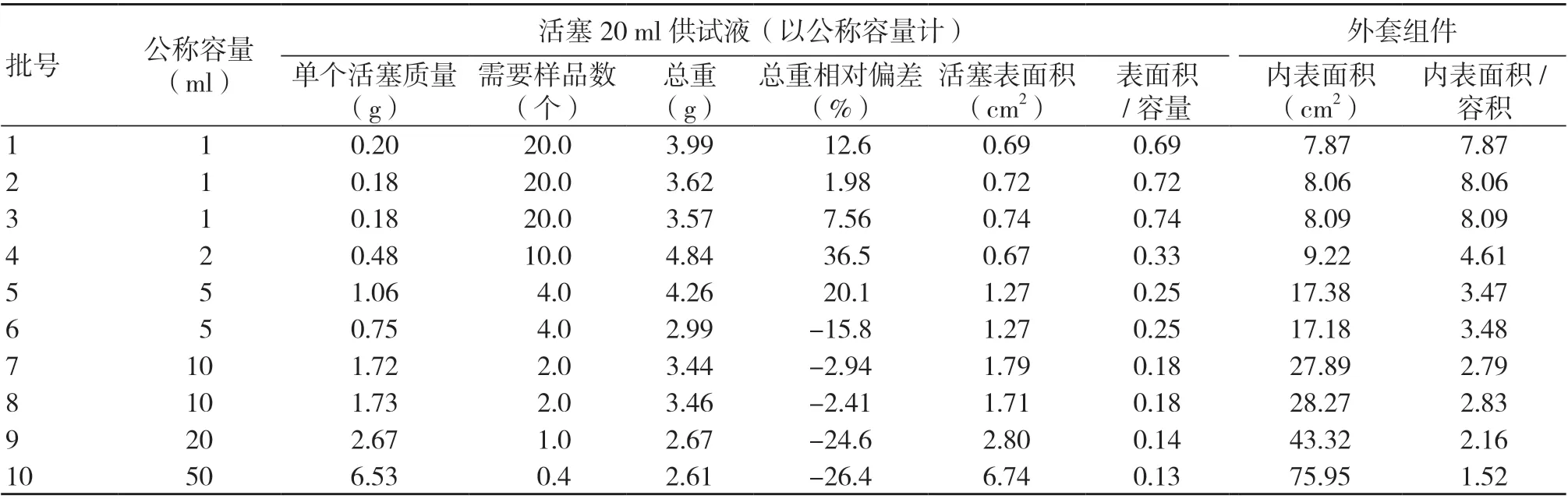
表2 易氧化物影响因素
4 小结
由上述内容可知,影响注射器易氧化物结果的主要是活塞的橡胶材料,橡胶材料的质量越好,化学性质越稳定,易氧化物(还原性物质)溶出越少;使用相同橡胶材料生产的注射器,公称容积越小,活塞接触药液的相对表面积越大,易氧化物溶出越多,高锰酸钾溶液消耗量之差越高。由此推断,在注射器生产过程中,特别是规格为1 ml 甚至更小容量的注射器,即便橡胶材料完全符合YY/T 0243的标准要求,综合考虑塑料组件、润滑剂等因素的共同影响,产品也有不合格的风险,从而造成不必要的损失。因此,对于橡胶材料,必然要有更高的质量标准,且应充分考虑塑料材料的影响,才能保证生产出来的注射器产品满足质量标准和使用安全的需要。

