miR-125a-3p介导DUSP1信号通路对急性髓系白血病细胞化疗敏感度的影响
郭艳荣 金丽虹 林佩佩 段玉波



[摘要] 目的 分析沉默微小RNA-125a-3p(miR-125a-3p)介導双特异性磷酸酶1(DUSP1)信号通路对急性髓系白血病细胞化疗敏感性的影响。 方法 购买人急性白血病细胞株进行培养,分为空白组、耐药组、沉默组、过表达组。检测每组细胞增殖、细胞凋亡、细胞DUSP1信号通路蛋白表达情况,并分析其作用机制。 结果 与耐药组相比,沉默组miR-125a-3p表达量降低,过表达组miR-125a-3p表达量升高(均P<0.05),与沉默组相比,过表达组miR-125a-3p表达量升高(P<0.05),说明miR-125a-3p转染成功。与耐药组相比,沉默组细胞增殖抑制率、凋亡率降低,过表达组细胞增殖抑制率、凋亡率升高(均P<0.05);与沉默组相比,过表达组细胞增殖抑制率、凋亡率升高(均P<0.05)。与耐药组相比,沉默组化疗敏感性降低,过表达组化疗敏感性升高(均P<0.05),与沉默组相比,过表达组化疗敏感性升高(P<0.05)。与耐药组相比,沉默组DUSP1蛋白表达量升高,p38、MAPK蛋白表达量降低,过表达组DUSP1蛋白表达量降低,p38、MAPK表达量升高(P<0.05);与沉默组相比,过表达组DUSP1蛋白表达量降低,p38、MAPK表达量升高(均P<0.05)。 结论 过表达miR-125a-3p可抑制急性髓性白血病细胞凋亡、促进增殖、增强敏感性,其作用机制可能与DUSP1信号通路被激活相关。
[关键词] miR-125a-3p;DUSP1信号通路;急性髓系白血病细胞;化疗敏感性
[中图分类号] R733.7 [文献标识码] A [文章编号] 1673-9701(2022)17-0027-04
Effect of miR-125a-3p-mediated DUSP1 signaling pathway on the chemotherapy sensitivity of acute myeloid leukemia cells
GUO Yanrong1 JIN Lihong2 LIN Peipei1 DUAN Yubo3
1.Department of Hematology,Taizhou Central Hospital (Taizhou University Hospital), Taizhou 318000,China;2.Department of Pediatric Surgery,Taizhou Hospital of Zhejiang Province affiliated to Wenzhou Medical University,Taizhou 317000,China;3.Department of Intensive Care Unit, Jiangxi Cancer Hospital, Nanchang 330000,China
[Abstract] Objective To analyze the effect of miR-125a-3p-mediated dual specificity phosphatase 1 (DUSP1) signaling pathway on the chemotherapy sensitivity of acute myeloid leukemia cells. Methods Human acute leukemia cell lines were purchased for culture and divided into the blank group, the drug-resistant group, the silent group and the overexpression group.Cell proliferation, apoptosis, and the protein expression in the cellular DUSP1 signaling pathway in each group were detected, and the mechanism of action was analyzed. Results Compared with the drug-resistant group, the miR-125a-3p expression was decreased in the silent group and increased in the overexpression group(all P<0.05),and compared with the silent group, the miR-125a-3p expression was increased in the overexpression group(P<0.05),indicating the successful transfection of miR-125a-3p. Compared with the drug-resistant group, the inhibition rate of cell proliferation and apoptosis rate were decreased in the silent group and increased in the overexpression group(all P<0.05),and compared with the silent group, the inhibition rate of cell proliferation and apoptosis rate were increased in the overexpression group(all P<0.05).Compared with the drug-resistant group, the chemotherapy sensitivity was decreased in the silent group and increased in the overexpression group(all P<0.05), and compared with the silent group, the chemotherapy sensitivity was increased in the overexpression group(P<0.05).Compared with the drug-resistant group, DUSP1 protein expression was increased and the expressions of p38 and mitogen-activated protein kinase (MAPK) were decreased in the silent group, and DUSP1 protein expression was decreased and the expressions of p38 and MAPK were increased in the overexpression group(all P<0.05). Compared with the silent group,DUSP1 protein expression was decreased and the expressions of p38 and MAPK were increased in the overexpression group(all P<0.05). Conclusion Overexpression of miR-125a-3p can inhibit apoptosis, promote proliferation and enhance sensitivity of acute myeloid leukemia cells, and the mechanism of action may be related to the activated DUSP1 signaling pathway.
[Key words] miR-125a-3p; DUSP1 signaling pathway; Acute myeloid leukemia cells; Chemotherapy sensitivity
白血病是由于造血系统恶性克隆产生的疾病,并浸润其他造血组织器官,抑制正常造血功能,出现发热、贫血、出血、浸润等临床症状[1]。急性髓系白血病(acute myeloid leukemia,AML)是白血病的重要亚型。目前白血病治疗的主要手段为化疗,但白血病特有的生物学特征使白血病细胞对化疗药物产生耐药性,使白血病患者对化学药物的敏感性降低,且在化疗过程易出现重症感染[2]。目前临床研究表明,AML发生化疗耐药性是因miRNA表达异常,丧失对下游靶基因的正常调控[3]。双特异性磷酸酶1(DUSP1)是双特异性磷酸酶家族的一员,负调节有丝分裂原蛋白激酶通路(MAPK),抑制该通路上丝氨酸和酪氨酸的磷酸化[4]。基于上述研究背景,本研究分析沉默微小RNA-125a-3p(miR-125a-3p)對急性髓系白血病细胞增殖、凋亡及DUSP1信号通路的影响,为临床髓系白血病的化疗敏感性研究提供新方向。
1 材料与方法
1.1 研究材料
研究细胞:人急性白血病细胞株K562购于上海圻明生物科技有限公司。主要试剂:PRMI-1640培养基(北京百奥莱博科技有限公司);miR-125a-3p沉默质粒、miR-125a-3p过表达质粒构建(上海吉玛制药技术有限公司);Lipofectamine 2000试剂盒(Invitrogen公司);DUSP1、p38、MAPK检测试剂盒(上海梵态生物科技有限公司)。
1.2 方法
1.2.1 急性髓系白血病细胞培养 取人急性髓系白血病化疗耐药细胞株K562放入37℃ 5% CO2含10%胎牛血清的PRMI-1640的培养液中培养,2~3 d传代1次,对K562细胞加入5 μg/ml化疗药物进行培养耐药维持表型,试验前两周换为不含化疗的培养液。取生长期的细胞分别接种于96孔板,向细胞中加入0.01、0.1、1、5、10、50和100 μg/ml的化疗药物放入37℃ 5% CO2、饱和湿度的无菌培养箱中培养24 h,每个浓度设5个平行复孔,每孔加入10 μl MTT溶液继续孵育4 h,每孔加入10 μl 10% DMSO终止反应。试验重复测量3次。
1.2.2 细胞转染 取对数K562耐药细胞,将其接种于6孔板,细胞融合至80%时,将miR-125a-3p过表达质粒、miR-125a-3p沉默质粒转染于K562耐药细胞,对其进行48 h的培养。耐药组不做任何处理,另外取不做任何处理的人急性髓性白血病细胞株K562作为空白组。
1.2.3 细胞增殖检测 采用MTT比色法检测细胞增殖情况,调整测定细胞浓度,将其接种于96孔板中,并在孔板中加入200 μl细胞悬液,放入37℃、5% CO2环境中进行培养,24、48、72 h后加入10 μl MTT试剂,孵育4 h后采用酶标仪对OD值进行测定,并计算增殖率。
1.2.4 细胞凋亡检测 采用流式细胞术检测细胞凋亡率,取各组细胞,制备细胞悬液,采用Annnexin V-FITC凋亡试剂盒,37℃避光孵育0.5 h,采用流式细胞仪检测细胞凋亡数。
1.2.5 DUSP1通路蛋白检测 采用Western Blot法检测细胞DUSP1、p38、MAPK表达情况,对所培养的细胞做离心、蛋白提取,之后收集上清,使用BCA试剂盒检测DUSP1、p38、MAPK蛋白含量,提取等量蛋白质,100℃变性5 min,使用凝胶电泳分离,4℃条件下加入一抗孵育过夜,洗涤15 min 3次,加入稀释好的二抗,孵育2 h,洗涤15 min 3次,定量分析蛋白表达情况。以GAPDH为内参,重复试验3次。
1.3 统计学方法
采用SPSS 25.0统计学软件进行数据分析。计量资料以均数±标准差(x±s)描述,多组间比较采用F检验,两组间比较采用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 四组miR-125a-3p表达量比较
与空白组相比,耐药组、沉默组miR-125a-3p表达量降低,过表达组miR-125a-3p表达量升高,差异有统计学意义(均P<0.05);与耐药组相比,沉默组miR-125a-3p表达量降低,过表达组miR-125a-3p表达量升高,差异有统计学意义(均P<0.05),与沉默组相比,过表达组miR-125a-3p表达量升高,差异有统计学意义(P<0.05),说明miR-125a-3p转染成功。见表1。
2.2 四组细胞化疗敏感性比较
与空白组相比,耐药组、沉默组化疗敏感性降低,过表达组化疗敏感性升高,差异有统计学意义均(P<0.05);与耐药组相比,沉默组化疗敏感性降低,过表达组化疗敏感性升高,差异有统计学意义(均P<0.05),与沉默组相比,过表达组化疗敏感性升高,差异有统计学意义(P<0.05)。见表2。
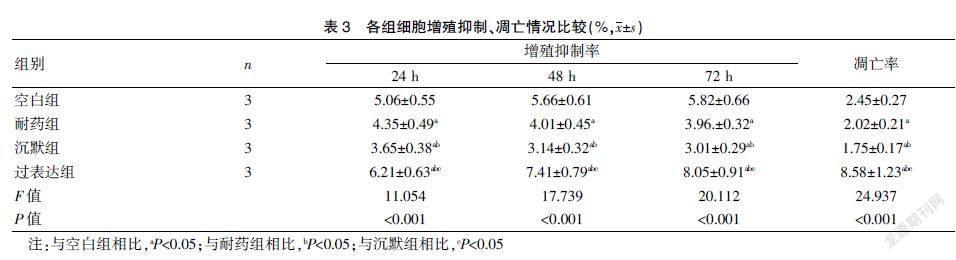
2.3 四组细胞增殖抑制、凋亡情况比较
与空白组相比,耐药组、沉默组细胞增殖抑制率降低,凋亡率降低,过表达组增殖抑制率升高,凋亡率升高,差异有统计学意义(均P<0.05);与耐药组相比,沉默组细胞增殖抑制率降低,凋亡率降低,过表达组细胞增殖抑制率升高,凋亡率升高,差异有统计学意义(均P<0.05);与沉默组相比,过表达组细胞增殖抑制率升高,凋亡率升高,差异有统计学意义(均P<0.05)。见表3、封三图2。
2.4 四组细胞DUSP1通路蛋白表达量比较
与空白组相比,耐药组、沉默组DUSP1蛋白表达量升高,p38、MAPK蛋白表达量降低,过表达组DUSP1蛋白表达量降低,p38、MAPK蛋白表达量升高,差异有统计学意义(均P<0.05);与耐药组相比,沉默组DUSP1蛋白表达量升高,p38、MAPK蛋白表达量降低,过表达组DUSP1蛋白表达量降低,p38、MAPK表达量升高,差异有统计学意义(均P<0.05);与沉默组相比,过表达组DUSP1蛋白表达量降低,p38、MAPK表达量升高,差异有统计学意义(均P<0.05)。见表4、图2。
3 讨论
白血病是因造血组织退化产生的异质性克隆障碍疾病,其发病主要原因为造血干细胞失去分化为正常细胞的能力,细胞增殖失控、凋亡受阻,造成未分化成熟的白细胞在骨髓或其他造血组织中呈肿瘤性异常增生,正常血细胞生成减少[5~7]。目前治疗急性髓性白血病的主要方式为化疗,对化疗药物的敏感性降低[8~10]。基于上述形式,本研究分析过表达miR-125a-3p及DUSP1信号通路对急性髓系白血病化疗敏感性的影响,为临床上研究化疗药物的敏感性提供参考。
微小RNA(miRNA)是存在于真核生物类的内源性非编码小分子RNA,在转录后通过与靶mRNA的碱基结合发挥其降解、抑制翻译的作用[11~13]。经上述作用后,miRNA参与机體一系列生理病理过程。研究表明,miR-125a低表达的亚型总体生存短、预后差,miR-125a-3p在肺癌、胃癌、前列腺癌多种恶性肿瘤组织中下调,异常的miR-125a-3p表达参与某些肿瘤获得耐药性,影响肿瘤细胞对化疗药物的敏感性[14,15]。结果提示,miR-125a-3p过表达在急性髓系白血病中发挥着重要作用,过表达其miR-125a-3p可改变上述异常情况,最终发挥其改善急性髓系白血病的作用。
研究表明,DUSP1与肺癌、乳腺癌、前列腺癌和白血病等肿瘤密切相关,并参与肿瘤的发生、发展和预后,DUSP1通过激活MAPK/ERK通路改善生存,且DUSP1是影响患者预后的独立危险因素,DUSP1还可抑制前列腺细胞中MAPK/p38诱导的凋亡[16~18]。研究表明,在ALL细胞中,DUSP1蛋白表达水平受Notch3调控,可通过激活DUSP1-p38通路增加其化疗敏感性[19,20]。
综上所述,miR-125a-3p过表达处理的急性髓系白血病细胞化疗敏感性明显增强,增殖率减少,其作用机制可能与激活DUSP1信号通路相关。
[参考文献]
[1] Wang F,Lv H,Zhao B,et al.Iron and leukemia:New insights for future treatments[J].J Exp Clin Cancer Res,2019,38(1):406.
[2] 赵晓甦,常英军.急性髓系白血病的规范化诊断和预后分层[J].中华内科杂志,2021,60(3):259-263.
[3] 张娟娟,李瑞玮,贺继刚,等.外泌体源miRNA在白血病发病机制中的作用[J].中国组织工程研究,2019,23(17):2776-2781.
[4] 杨媛,马晓玲,石馨,等. DUSP1/p38/MAPK通路在子宫内膜异位症中的表达及意义[J].中国妇幼保健,2019, 34(7):1654-1656.
[5] 武晓雷,王娅婕,李增政,等.巨核细胞与急性髓系白血病相互调控的研究进展[J].军事医学,2021,45(4):316-320,封3.
[6] 龚琴英,陈舒燕,张贞丽,等.H2H管理模式对白血病患者自我效能和心境状态的影响[J].国际医药卫生导报,2021,27(6):818-821.
[7] 祖璎玲,周健,张莉,等.髓系白血病异基因造血干细胞移植后髓外复发的危险因素分析[J].中华内科杂志,2021, 60(1):41-44.
[8] 姜艳红,焦扬,陈光意,等.不同血小板数量分层在儿童初治原发急性髓系白血病中的临床意义[J].中华实用儿科临床杂志,2021,36(3):204-209.
[9] 任亚方,白峰岩,田静,等.80例急性淋巴细胞白血病患儿的诊疗分析[J].癌症进展,2021,19(6):626-629.
[10] Kishtagari A,Levine RL,Viny AD.Driver mutations in acute myeloid leukemia[J].Curr Opin Hematol,2020,27(2):49-57.
[11] 黄凤霞,李海燕,苏媛媛,等.miRNA-107在急性髓系白血病中的表达及意义[J].标记免疫分析与临床,2019, 26(12):1988-1993.
[12] 胡秀娟,徐晓东.miRNA-600在急性髓系白血病中的表达及意义[J].中国临床研究,2020,33(1):69-72.
[13] 刘小高,胡燕宁,陈珍惜,等.微泡介导的miRNA在急性髓系白血病中的研究进展[J].实用医学杂志,2019, 35(6):1003-1005.
[14] 赵进,王昌敏.miR-125a-5p对人多发性骨髓瘤U266细胞增殖的影响及其与维生素D受体的关系[J].山东医药,2020,60(23):30-33.
[15] 杨章元,周正菊.血清外泌体中miR-125a-3p、miR-192、miR-223联合检测对早期结直肠癌的诊断价值[J].国际检验医学杂志,2020,41(24):3059-3061.
[16] Song M,Wang N,Li Z,et al. miR-125a-3p suppresses the growth and progression of papillary thyroid carcinoma cell by targeting MMP11[J].J Cell Biochem,2020,121(2):984-995.
[17] Xu Q,Liu Y,Pan H,et al. Aberrant expression of miR-125a-3p promotes fibroblast activation via Fyn/STAT3 pathway during silica-induced pulmonary fibrosis[J].Toxicology,2019,414(2):57-67.
[18] 曹亚伟,桂百卉.长链非编码RNA双特异性磷酸酶5假基因1对三阴性乳腺癌细胞生物学行为的作用[J].转化医学杂志,2020,9(1):12-16.
[19] 张春英,阴广维,尤鸣达,等.siRNA靶向沉默TAK1基因对甲状腺癌细胞增殖、迁移和p38MAPK信号通路的抑制作用[J].吉林大学学报(医学版),2021,47(1):110-117.
[20] 张卢舜,李育庄,李春辉.胃癌中NPR-A、P38MAPK及细胞骨架Tubulin-a的表达及意义[J].实用医学杂志,2019,35(16):2570-2574.
(收稿日期:2021-05-24)

