不同风格音乐对CUMS 抑郁大鼠行为的影响及机制研究
李懿,曾莉,何丽雯,谭冬梅,张倩,谭毅
(重庆医科大学实验动物中心,重庆 400016)
抑郁症是情感、情绪表达和调节紊乱的一类精神疾病,常伴有焦虑症状,有高患病率、高复发率、高致残率、高致死率等特点,严重危害人类身心健康[1]。 抑郁症的发病机制迄今尚未完全阐明,主要包括单胺递质失调、 下丘脑- 垂体- 肾上腺(hypothalamic-pituitary-adrenal axis, HPA) 激 素 紊乱、神经营养因子学说和炎症因子上调等学说。 目前抑郁症治疗方式主要包括药物治疗与心理治疗[2]。 然而,迄今为止,没有一种抗抑郁药能够覆盖临床的抑郁症状谱,且长期服用会造成一系列副作用。 因此,抑郁症的预防和治疗手段的优化正成为我国医疗卫生工作的重点之一。
国内外已有研究显示,音乐因具有调节生理和心理的双重功效而成为抑郁治疗的潜在方法[3-4],但仍存在很多挑战。 与常规治疗最大的区别在于音乐治疗所使用的媒介即音乐是不可定量的,以“聆听音乐的时间长短”作为音乐治疗的剂量没有科学依据,而且音乐的风格、节奏、音色、旋律等特征都可以影响个体的感知和治疗效果[5]。 音乐治疗具有一定程度的经验性和主观性,需要更加深入的实证研究来探索音乐中各种元素的效应。 因此,本研究利用抑郁症研究使用最广泛的CUMS 动物模型,通过采取不同风格的音乐进行干预,初步探讨音乐改善大鼠的抑郁样行为及其相关机制,为音乐治疗抑郁的临床应用奠定实验基础。
1 材料与方法
1.1 材料
1.1.1 实验动物
52 只 SPF 级雄性 SD 大鼠,6 ~ 8 周龄,体重220 ~280 g,购买并饲养观察于重庆医科大学实验动物中心【SCXK(渝)2018-003】【SYXK(渝)2018-0003】。 饲养环境:相对湿度40% ~ 70%,温度控制在(22 ± 3)℃。 光照周期为 12 h 明暗交替,自由采食、饮水。 实验方案已获得重庆医科大学医学伦理委员会审批通过(伦理审批号:2021047)。
1.1.2 主要试剂与仪器
山羊抗大鼠BDNF 多克隆抗体(PB9075,武汉博士德生物工程有限公司)、NT-3 多克隆抗体(BA1293,武汉博士德生物工程有限公司)、小鼠抗β-actin 单克隆抗体(AB8226,美国 Abcam)、过氧化物酶标记兔抗山羊二抗(ZB2303,北京中山金桥公司)、免疫组化试剂盒(PV9001,北京中山金桥公司)、大鼠5-HT ELISA 试剂盒(RX303050,莫纳生物科技生物有限公司)、大鼠 BDNF ELISA 试剂盒(RX302461R,莫纳生物科技生物有限公司),大鼠CORT ELISA 试剂盒(RX302425R,莫纳生物科技生物 有 限 公 司 )、 大 鼠 IL-1β ELISA 试 剂 盒(RX302869R,莫纳生物科技生物有限公司)。 R12U台式音箱(漫步者,中国)、液相色谱串联质谱(Agilent, 美 国 )、 Thermo 高 速 离 心 机 (Thermo Scientific,美国)、石蜡切片机(Leica,德国)、光学显微镜(Leica,德国)、凝胶成像仪(Gene,美国),行为学分析软件(Anymaze,美国)。
1.2 方法
1.2.1 音乐曲目的选取
根据音乐的风格类型,筛选出10 首音乐。 通过音乐的结构、和弦、乐理将音乐分为轻音乐组(Light)和古典音乐组(Classical),轻音乐组包含《龙猫》《能看见海的街道》《伴随着你》《晴朗的日子》《鸟人》《风之谷》曲目,古典音乐组包含《Piano Conceto No.23 in Major,K488(Ⅰ Ⅱ Ⅲ)》。 轻音乐组完整播放1 次26 min 38 s,古典音乐组完整播放1 次24 min 50 s。 轻音乐组中的6 首曲目列表循环播放。
1.2.2 CUMS 抑郁模型的建立方法
SD 大鼠于实验前适应性饲养1 周,依据SPT 结果剔除糖水偏好百分比小于80%的个体。 CUMS 刺激方式包括空笼盒(24 h)、潮湿垫料(24 h)、禁食(12 h)、禁水(24 h)、频闪(12 h)、4℃冷水游泳应激(5 min)、45℃热水游泳应激(5 min)、白噪音(24 h)、鼠笼倾斜 45°(24 h)、夹尾(1 min)、束缚(4 h)、明暗交替(12 h)、昼夜颠倒。 为避免大鼠对单一或有规律的刺激产生耐受性,每天随机选取两种刺激,且相同刺激不连续出现,持续刺激4 周。 刺激结束后,通过SPT 和FST 实验筛选出糖水偏好百分比降低与强迫游泳不动时间增加的CUMS 模型大鼠,共39 只。 对照组13 只大鼠不给予任何刺激。
1.2.3 音乐干预
抑郁模型大鼠随机分为模型组(Model)、轻音乐组(Light)、古典音乐组(Classical),每组 13 只。模型组每天继续给予刺激,轻音乐组、古典音乐组除了给予与模型组相同的刺激外,还每天分别给予轻音乐和古典音乐4 h(21:00 ~23:00,2:00 ~4:00),鼠笼距播放源1 m 左右,呈弧形散开,音量60~ 70 dB,持续 3 周。
1.2.4 行为学测试
(1)SPT:在第0 周(即环境适应后)、第4 周末(即造模结束后)和第7 周末(即音乐干预完成后)进行。 实验前进行4 d 的适应性训练,第1、2 天提供两瓶纯水,第3 天提供两瓶1%蔗糖水,第4 天提供纯水和1%蔗糖水各1 瓶。 正式实验时,白天禁食禁水12 h(8:00 ~20:00),随后给予纯水和1%蔗糖水12 h(20:00 ~8:00),记录12 h 溶液的消耗量。 糖水偏好百分比(%)= 蔗糖溶液饮用量(g)/[蔗糖溶液饮用量(g)+纯水饮用量(g)]× 100%。
(2)FST:在第4 周末和第7 周末进行。 每只大鼠在实验前24 h 进行15 min 的适应性游泳。 泳桶高80 cm,直径15 cm,水面高度30 cm,水温22 ~26℃左右。 实验持续6 min,用数码相机记录实验过程,any-maze 视频分析软件统计6 min 内小鼠不动总时间。
(3)O-maze:将大鼠放进迷宫中央的封闭臂中,any-maze 视频分析软件分析其行走路程、进入开放臂次数和在开放臂内的停留时间。
(4)OFT:将大鼠置于 100 cm × 100 cm × 40 cm的黑色旷场箱的中心,自由探索环境5.5 min,安装在旷场中心上方的摄像机记录大鼠的运动轨迹,前30 s 用于适应环境,后5 min 用于分析大鼠在旷场箱的运动情况,包括大鼠在旷场箱运动的总距离、进入中心区域(中心30 cm × 30 cm 的正方形区域)的次数和时间。 每次测试后,用75%的乙醇擦拭旷场箱的内壁和底面,以消除大鼠的气味。
1.2.5 取材
第7 周末行为学实验结束后,麻醉大鼠,经眼眶后静脉丛取血之后,二氧化碳过量吸入安乐死处死大鼠,分离头身。 在冰袋上剪开头皮,打开颅腔取出全脑。 每组取3 只大鼠全脑固定于4%多聚甲醛液中,其余大鼠脑组织分离海马组织,冰冻保存。
1.2.6 HE 染色
取多聚甲醛中固定的组织样本,经梯度乙醇脱水、二甲苯透明、浸蜡,制作石蜡包埋块,4 μm 切片并经过脱蜡水化后,将切片浸入苏木精染液染色5 min,缓流自来水冲洗3 min,再用1%盐酸乙醇溶液分色30 s,自来水冲洗后,浸入伊红染液染色2 min,经脱水封片后光镜观察。
1.2.7 免疫组化
将切片37℃烘烤30 min,二甲苯梯度脱蜡。 每个组织滴加3%过氧化氢,消除过氧化氢酶活性。抗原修复、封闭,与抗 BDNF 一抗(1 ∶500 稀释)4℃孵育过夜,清洗后与生物素标记的羊抗兔二抗孵育、DAB 显色、苏木素复染,封片。 光镜下观察海马CA1,CA3 和 DG 区神经元细胞中 BDNF 的表达情况,并进行图像采集。
1.2.8 Western Blot
按照1 ∶9(W/V)比例在匀浆管中加入冰冷的RIPA 裂解液(含 100 μg/mL PMSF),充分研磨,形成 10% 的组织匀浆液,4℃,11 200 r/min 离心10 min,取上清液,使用BCA 试剂盒测定蛋白浓度。使用SDS-PAGE 胶试剂盒配置PAGE 胶,在样品槽中加入5 × Loading Buffer 预处理的蛋白样本,恒压电泳后将蛋白转到PVDF 膜上,经封闭、TBST 清洗3 次后,与 BDNF 一抗(1 ∶1000 稀释)4℃ 孵育过夜,TBST 清洗3 次,加二抗(1 ∶5000)室温孵育 2 h后进行ECL 显色。 Image J 分析各条带灰度值,用光密度比值表示其相对表达。
1.2.9 ELISA
用ELISA 试剂盒测定血清 BDNF、CORT、5-HT和IL-1β 水平,检测灵敏度为 pg/mL。 同一指标的重复检测使用同一批次产品,以避免批间变异。
1.2.10 液相色谱串联质谱(LC-MS/MS)
按照1 ∶3(W/V)比例在匀浆管中加入冰冷的超纯水,充分研磨,形成25%的组织匀浆液,4℃,4600 r/min 离心 10 min,取上清液,按照 1 ∶9 比例加入冰冷的乙腈,混匀后4℃,15 000 r/min 离心10 min,取 60 μL 上清液,加入 110 μL 乙腈和 10 μL IS溶液,混匀后 4℃,15 000 r/min 离心10 min,取2 μL上清液上机检测。 所有蛋白均在正离子模式下扫描,实验数据用MassLynx(4.1)软件进行处理。
1.3 统计学分析
使用SPSS 23 进行统计学分析,所有测试计量资料以平均值± 标准误差()表示,每个实验至少重复3 次。 两组数据比较使用独立样本t检验。 多组数据比较采用单因素方差分析(One-way ANOVA),使用Levene 做方差齐性检验,事后两两比较,使用LSD 法进行检验,P<0.05 被认为具有统计学意义。
2 结果
2.1 音乐干预改善CUMS 模型大鼠的抑郁样行为
糖水偏好百分比和强迫游泳不动时间是评价抑郁模型快感缺失的有效客观指标。 实验结果表明:(1)模型组较对照组大鼠的糖水偏好百分比显著降低(P= 0.0023),模型组强迫游泳不动时间极显著延长(P<0.001),提示模型组大鼠保持了抑郁状态(图1A,1B)。 (2)轻音乐组与古典音乐组大鼠的糖水偏好百分比较模型组均明显增加,其差异均具有显著性(P=0.0060,P=0.0211)。 轻音乐和古典音乐组大鼠强迫游泳不动时间较模型组也均显著缩短(P=0.0017,P=0.0058)(图 1A,1B),提示轻音乐与古典音乐均能有效改善CUMS 模型大鼠的抑郁样行为。

图1 不同风格音乐干预对抑郁模型大鼠行为的影响Note. A. Percentage of sucrose preference test. B. Immobile time of forced swimming test. C, D. Times and staying time into the open arms of elevated O maze. E, F. Total moving distance and staying time in the central area in the open field test. Compared with model group,*P <0.05,**P < 0.01,***P < 0.001.Figure 1 Effects of different styles of music intervention on behavior of depressed rats
抑郁症常伴有焦虑等情绪改变,高架O 迷宫和旷场实验可进一步评价大鼠的焦虑和自主活动等状况。 音乐干预3 周后,与正常对照组相比,模型组大鼠进入O 迷宫开放臂的次数和停留时间均显著减少(P= 0.0109,P< 0.0001)(图 1C,1D),在旷场箱内移动的总距离减少(P= 0.0391)(图1E,1F),提示模型组大鼠伴有焦虑情绪,自主活动能力和探索能力均下降。 与模型组相比,轻音乐和古典音乐组大鼠进入O 迷宫开放臂次数(P= 0.0049,P= 0.0012)和停留时间(P= 0.0280,P= 0.0156)均显著增多(图1C,1D)。 同时,在旷场实验中,两两比较发现古典音乐组大鼠与模型组相比,在旷场箱内移动的总距离和在旷场中心区域停留的时间均显著增加(P= 0.0023,P= 0.0104)(图 1E,1F)。 提示轻音乐与古典音乐改善了抑郁大鼠的焦虑行为,古典音乐明显增强了大鼠的活动能力与探索行为。
此外,随着时间增长,大鼠体重均表现出明显增加:其中对照组增加明显,模型组增加缓慢。 与模型组相比,轻音乐组和古典音乐组大鼠的体重增加显著(P= 00065,P= 0.0057)。 轻音乐组增加幅度较古典音乐组较大,但相互之间差异无显著性(P>0.05)。 表1 提示轻音乐与古典音乐能拮抗CUMS 刺激导致的体重降低,使其恢复到正常水平。
表1 音乐干预后大鼠体重变化()Table 1 Effects of music intervention on weight gain and growth rate of rats()
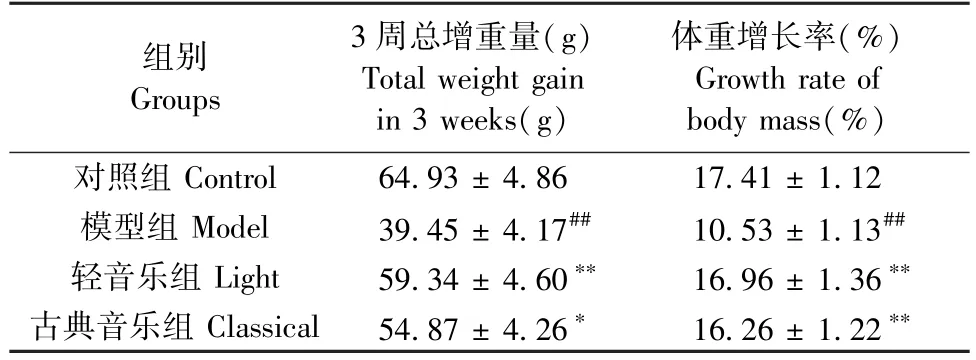
表1 音乐干预后大鼠体重变化()Table 1 Effects of music intervention on weight gain and growth rate of rats()
注:与对照组比,##P < 0.01;与模型组比,*P < 0.05,**P < 0.01。Note. Compared with control group, ##P < 0.01. Compared with model group, *P < 0.05, **P < 0.01.
组别Groups 3 周总增重量(g)Total weight gain in 3 weeks(g)体重增长率(%)Growth rate of body mass(%)对照组 Control 64.93 ± 4.86 17.41 ± 1.12模型组 Model 39.45 ± 4.17## 10.53 ± 1.13##轻音乐组 Light 59.34 ± 4.60** 16.96 ± 1.36**古典音乐组 Classical 54.87 ± 4.26* 16.26 ± 1.22**
2.2 音乐改善CUMS 抑郁大鼠行为的机制
2.2.1 音乐刺激对海马形态结构以及BDNF 的影响
大鼠脑组织的HE 结果显示,对照组海马锥体细胞排列整齐、密度较高、数量多、细胞核完整正常。 模型组海马锥体细胞出现排列不齐,呈松散状,胞体固缩、深染,胞质溶解。 音乐干预3 周后,轻音乐组与古典音乐组中海马神经细胞与对照组类似(图2A)。 免疫组化检测发现,模型组大鼠海马CA3 区神经细胞的BDNF 蛋白呈弱阳性,古典音乐组与轻音乐组则为中强度阳性(图2B)。 Western Blot 结果显示,与对照组相比,模型组BDNF 蛋白表达显著低于对照组(P= 0.001),经轻音乐和古典音乐干预后,BDNF 蛋白表达水平较模型组均明显回升(P= 0.0044,P= 0.0022)(图 2C,2D)。 以上结果说明,音乐一定程度改善了由于CUMS 造模带来的神经元损伤。

图2 不同风格音乐干预对海马形态与BDNF 表达的影响Note. A. HE staining. B. Immunohistochemical staining of BDNF. C. Western Blot of hippocampal BDNF. D. Semi-quantitative analysis of BDNF expression level.Figure 2 Effects of different styles of music intervention on hippocampal morphology and BDNF expression level
对照组和模型组的BDNF 浓度分别为(163.92± 4.68)pg/mL,(88.13 ± 6.40)pg/mL,其差异具有显著性(P=0.0001)。 经过音乐干预后,轻音乐组为(123.55 ± 9.93)pg/mL,古典音乐组为(124.31±5.72)pg/mL,与模型组比较,两组BDNF 含量均显著升高(P= 0.0055,P= 0.0035)。
2.2.2 音乐刺激对HPA 轴的影响
HPA 轴的CORT 变化是判断动物是否处于应激状况的常见指标。 表2 显示,较对照组,模型组血清与海马的CORT 含量均显著升高(P= 0.006,P= 0.0029)。 音乐干预后,轻音乐组的血清CORT含量较模型组无显著变化(P= 0.9278),但海马CORT 含量显著降低(P= 0.0023)。 古典音乐组血清和海马CORT 含量均显著降低(P= 0.045,P=0.0029)。 提示古典音乐减轻了抑郁大鼠的应激状态。
表2 大鼠CORT 含量比较(, n = 10)Table 2 Comparison of CORT content in hippocampus and serum(, n = 10)

表2 大鼠CORT 含量比较(, n = 10)Table 2 Comparison of CORT content in hippocampus and serum(, n = 10)
组别Groups海马CORT 含量(ng/mL)CORT content in hippocampus(ng/mL)血清CORT 含量(pg/mL)CORT content in serum (pg/mL)对照组 Control 45.57 ± 8.38 1915.54 ± 36.75模型组 Model 88.52 ± 10.86## 2069.47 ± 26.86##轻音乐组 Light 27.66 ± 6.79** 2096.31 ± 23.38古典音乐组 Classical 25.21 ± 4.63** 1944.73 ± 35.99*
2.2.3 音乐刺激对血清单胺类神经递质的影响
单胺类神经递质浓度水平下降是抑郁症的生物学基础之一。 表3 显示,与对照组相比,模型组大鼠血清的5-HT 含量降低(P= 0.0016)。 音乐干预后,轻音乐组较模型组的5-HT 含量显著增加(P=0.0033)。 各组大鼠血清 DA 含量无显著差异。 提升轻音乐提高了抑郁大鼠的单胺神经递质的水平。
表3 大鼠血清单胺神经递质含量比较(, n = 10)Table 3 Comparison of amine neurotransmitter content in serum(, n = 10)
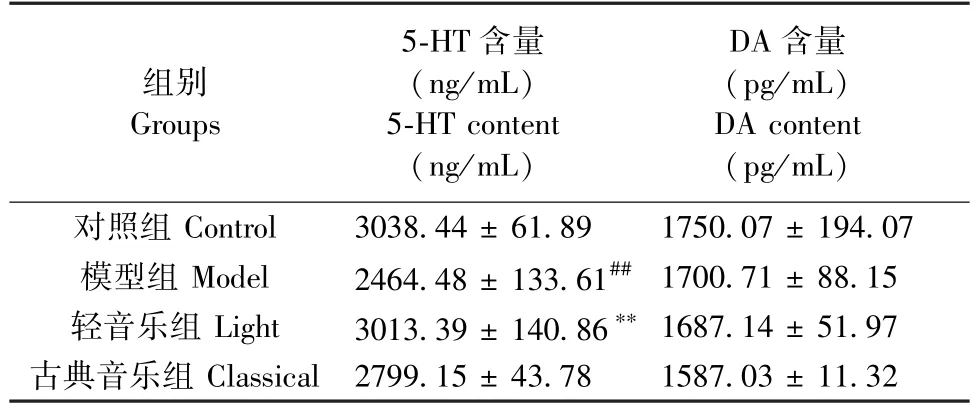
表3 大鼠血清单胺神经递质含量比较(, n = 10)Table 3 Comparison of amine neurotransmitter content in serum(, n = 10)
组别Groups 5-HT 含量(ng/mL)5-HT content(ng/mL)DA 含量(pg/mL)DA content(pg/mL)对照组 Control 3038.44 ± 61.89 1750.07 ± 194.07模型组 Model 2464.48 ± 133.61## 1700.71 ± 88.15轻音乐组 Light 3013.39 ± 140.86** 1687.14 ± 51.97古典音乐组 Classical 2799.15 ± 43.78 1587.03 ± 11.32
2.2.4 音乐刺激对血清炎症因子的影响
细胞炎症因子可通过调节细胞间相互作用,进而影响中枢神经系统。 根据检验结果发现模型组大鼠血清 IL-1β 含量为(22.86 ± 2.18)ng/mL,对照组的 IL-1β 含量为(6.88 ±1.25)ng/mL,两组差异有显著性(P= 0.0001)。 音乐干预后,轻音乐组与古典音乐组的血清 IL-1β 含量为(11.99 ± 1.99)ng/mL、(10.31 ± 2.48)ng/mL 均显著低于模型组(P= 0.0028,P= 0.0005)。 提示音乐可以调整机体的免疫平衡,减轻机体的炎症反应。
3 讨论
CUMS 抑郁模型是研究抑郁症的常见动物模型,可连续给予大鼠3 ~5 周的多种温和性应激因子,致其出现情绪低落、快感缺失、绝望无助和体重减轻等[6]人类抑郁症相似的表现,且这种症状会持续3 个月左右[7]。 本实验中,每天给予2 种不同的应激刺激,连续4 周后,CUMS 模型组的糖水偏好百分比显著下降、强迫游泳不动时间明显延长,与研究报道一致[8-10]。 证实CUMS 抑郁模型建模成功,随后3 周的音乐治疗阶段,除正常组大鼠外,其余组仍给予CUMS,第7 周的SPT 和FST 证实,模型组大鼠仍保持抑郁状态。
音乐可能通过即时性提高体内特定激素、调节神经内分泌系统活动,以调节人体节律并影响心理、情绪[11]。 音乐治疗在阿尔兹海默症[12]、疼痛减缓[13]、抑郁[14-16]、肿瘤[16]、癫痫[17]等临床疾病已有一些探索性实践。 但使用的音乐常为单曲,音乐风格各不相同。 大部分研究表明古典音乐对动物会产生积极影响。 其中莫扎特的作品在研究中应用较多,具有纯净、新鲜、明亮、节奏稳定、有独立周期性的特点,符合人体内部特有的生理规律,这种音乐结构可能是产生莫扎特效应的主要原因[18-19]。在本研究中,我们的研究结果与先前对古典音乐的研究结果一致,所筛选的古典音乐能明显改善CUMS 大鼠的抑郁和焦虑行为。 我们选择的另一组久石让的轻音乐具有结构小巧简单、节奏明快舒展、旋律优美动听、轻快、轻松和轻盈的特点,CUMS抑郁大鼠经3 周的干预后,抑郁和焦虑行为得到明显缓解。 体重减轻是抑郁动物常见的症状之一,有研究认为体重减轻可能是因为建模过程长时间禁食导致[20]。 课题组前期已证实,夜间禁食12 h 会极大降低大鼠体重,而白天禁食12 h 则不会,这与大鼠昼伏夜动的生活习性有关[21]。 本研究中采用白天禁食12 h 的策略,因此古典音乐和轻音乐干预后,大鼠体重较模型组明显增加,是音乐改善抑郁的证据之一。 此外,古典音乐还能增强大鼠的自主活动和探索能力。 不同风格的音乐对动物抑郁行为具有相同的效果,但在探索活动行为上效果不同。 有文献报道,在其他条件相同情况下,快节奏音乐比慢节奏音乐更能唤起兴奋情绪[22]。 所以我们推测这可能是导致音乐对动物产生不同行为反应的原因。
研究表明,大脑海马体对情绪有着至关重要的调节功能[23]。 抑郁症患者经常伴有海马体缩小、神经元形态改变等病变[24]。 BDNF 在神经元存活、分化及参与神经可塑性调节、改善学习记忆具有重要作用[25]。 动物实验证明,慢性应激会导致海马部位BDNF 表达减少[26],临床试验也发现抑郁症患者的海马和前额皮质BDNF 表达水平较正常人降低[27]。本研究中CUMS 模型大鼠的海马锥体细胞排列分布不均,出现明显的核固缩。 海马BDNF 含量较正常组明显下降,但经轻音乐与古典音乐干预后,海马的形态学病变得以改善,BDNF 含量明显高于模型组,提示音乐可直接对机体产生生理作用。 BDNF可通过5-HT 能神经系统调节5-HT 表达。 本研究中我们也发现模型组大鼠5-HT 的表达明显降低,与文献报道相符。 而轻音乐干预后,5-HT 的含量升高到正常组水平。 此外,模型组因为应激反应,海马和血清CORT 的含量较对照组均显著升高,古典音乐干预3 周后,二者含量均显著下降,而轻音乐组仅海马CORT 的含量下降,这可能与音乐风格差异有关[28]。 在应激状态时,IL-1β 活性增强以诱发神经炎症反应过度激活,使突触间隙单胺递质含量减少以及CORT 分泌增多,参与抑郁症的发生[29-30]。在应激状态下本研究中轻音乐与古典音乐干预明显降低了血清IL-1β 含量,提示音乐可以调节机体的免疫平衡,减轻机体的炎症反应,进而参与抑郁情绪的调节。
综上所述,本研究证实了轻音乐与古典音乐能够调节 BDNF、CORT、5-HT 和 IL-β 等多种抑郁相关因子的表达,改善大鼠焦虑和抑郁样行为,特定音乐可作为抑郁症机制和抑郁症治疗研究策略的新方向,为音乐治疗提供了一定的实验数据。 不过,音乐治疗应用于临床还需要广泛深入的研究,音乐的各个要素如节奏、频率、情绪等,以及音乐给予的时长和频率等方式都可能会影响音乐对特定疾病患者的干预效果。 同时,中枢神经系统感受音乐刺激的信号通路,以及音乐诱导情绪心理、行为及生理变化的分子机制都还值得深入研究。