超声影像技术对兔肝VX2改良种植瘤生长评估
张容亮 李进涛 王子龙 马艺斐 陆永萍*
1.云南大学附属医院/ 云南省第二人民医院超声科,昆明 650021;2.昆明医科大学实验动物学部,昆明 650500
肝癌(liver cancer)是临床常见三大恶性肿瘤之一,死亡率排在胃癌、食道癌之后,早期临床症状不明显,晚期主要表现为消瘦、肝痛、乏力、黄疸、腹水等[1]。世界各地肝癌发病率各不相同,非洲撒哈拉沙漠以南和亚洲沿海地区发病率较高,欧美等地区发病率则较低。流行病学调查及试验研究表明中国肝癌发病率高并呈现逐年增高的趋势,每年因患肝癌死亡人数大约11 万人,约占全球肝癌死亡人数的1/2[2]。肝癌已经成为我国人口致死的主因,严重影响我国公共健康问题,我国每年投入大量的人力、科研经费进行肝癌基础研究。有研究资料表明病毒感染(如丙型肝炎病毒HCV、乙型肝炎病毒HBV 等)、性激素、饮水污染、黄曲霉素、亚硝胺类物质、肝硬化、酒精、微量元素等都与肝癌发病相关。对于肝癌的早期诊断、治疗方案优化、新药研发等研究将成为广大医学研究工作者的首要任务,成功制备适宜的动物肝脏肿瘤模型并对其生长特征进行探索研究显得很有必要,其探究结果可以为临床肝癌的诊治奠定前期基础和提供有益的参考。传统的开腹瘤块种植法成模率不高,在一定程度上影响了肝癌动物模型试验研究的开展。本试验对开腹瘤块种植法进行了改良,以期建立一种更为有效且成模率高、能批量建模的种植方法。借助超声影像技术对改良的开腹瘤块种植法制作兔VX2 肿瘤模型进行观察和分析其生长特性,为下一步试验治疗研究奠定基础。
1 材料与方法
1.1 材 料
VX2 肝癌种瘤新西兰兔,购于南京市浦口区莱芙养殖场,生产许可证号SCXK(苏)2019-0005。试验用新西兰兔20 只,体重2.0~2.5 kg,3~4月龄,雌雄不限。由昆明医科大学实验动物学部提供和饲养观察,其生产许可证号为SCXK(滇)K2020-0004,使用许可证号为SYXK(滇)K2020-0006。开展的动物试验研究方案已通过昆明医科大学动物实验伦理审查委员会审查,其批准号为kmmu20211434。缝合线购于宁波医用缝针有限公司,APLI0500 TUSA0500 全数字化彩色多普勒超声诊断仪购于日本东芝公司,注射用六氟化硫微泡造影剂购于上海博莱科信谊药业有限责任公司,试验兔手术台购于苏州冯氏试验动物设备公司,陆眠宁、鹿醒宁均购于吉林省华牧动物保健品有限公司。
1.2 方 法
1)兔VX2 肿瘤块制作。将种瘤兔VX2 肝肿瘤剪成1.0 mm×1.0 mm×1.0 mm 块状接种于兔大腿部肌肉(同一个入口并以60°为边界朝3 个方向接种3 块肿瘤块),让接种肿瘤块生长14 d 左右,手摸有高致密的包块,使用陆眠宁(0.2 mL/kg)肌注麻醉后在无菌的条件下剥离出肿瘤,弃除肿瘤周围坏死组织和筋膜等结蹄组织,并用生理盐水冲洗肿瘤,用灭菌眼科剪剪取肿瘤组织边缘生长较好的鱼肉样组织,剪成大小约1.0 mm×1.0 mm×1.0 mm 小块放入加入抗生素的4 ℃生理盐水中待用。
2)试验分组和改良的种植操作。20 只新西兰兔,随机分为试验组和对照组2 组,每组10 只,术前予以禁食不禁水24 h。肌注陆眠宁麻醉后,固定四肢,用推剪推剃除胸腹部剑突周围的毛,手术区域常规消毒后铺手术巾。用碘酒消毒手术区域皮肤,剑突下稍微偏左侧切开2.0~2.5 cm 口,尽量避开血管钝性分离各层肌肉后暴露肝脏,用套有塑料软管的无齿镊将左肝的较大一叶向腹壁外牵拉并用灭菌的皮筋固定,用灭菌的不锈钢弯尖头镊子或者带针芯的肿瘤植入针(2.1*50)从同一个入口并以60°为边界朝3 个方向刺破肝组织建立窦道,接种3 块肿瘤块。用8 号缝合线缝合肝膜开口并按压止血,在缝合处涂上适量青霉素;缝合腹膜肌肉层并涂上适量青霉素;缝合皮肤后碘酒消毒并涂上适量青霉素和红霉素软膏。术前肌注青霉素80 万IU,手术后每天注射1 次,连续3 d。对照组采用改良的手术操作但不植入肿瘤块。
1.3 种植后观察和检测
1)观察并记录有无感染,如有感染及时处理。
2)肝功能生化指标测定,种植后14 d 时兔耳中央动脉采血分离血清送化验室检测丙氨酸氨基转移酶(又称谷丙转氨酶,ALT)、门冬氨酸氨基转移酶(又称谷草转氨酶,AST)活性。
3)种植后14 d 时采用全数字化彩色多普勒超声诊断仪并造影观察肝脏肿瘤生长情况。试验兔麻醉(种植肿瘤兔麻醉使用剂量为正常麻醉剂量的1/3~2/3,视具体状况而定)后仰卧位固定,用推剪推除观察区域的兔毛。超声探头扫描观察兔肝,观察各组试验兔肝肿瘤的形态、大小、肿瘤内部及周边回声、有无坏死及瘤体血供状况。经耳缘静脉快速注入0.2 mL 生理盐水稀释的注射用六氟化硫微泡,观察试验兔肝肿瘤造影特征。
4)种植后14 d 时处死试验兔,取出兔肝并用肉眼进行大体观察。取兔肝及肿瘤组织用10%甲醛溶液固定、包埋、常规HE 染色,光学显微镜下进一步观察确认是否具有肿瘤的组织学特征。
1.4 统计分析
试验数据以“平均值±标准差”(±s)表示,计数数据用百分率表示,2 组差异比较采用单因素方差分析,采用SPSS 软件对试验数据进行统计分析,P<0.05 为统计学有显著差异。
2 结果与分析
2 组试验兔手术后均无感染,精神状态良好,活动正常,采食、饮水及粪便正常,毛色有光泽,均无死亡。
2.1 种植后14 d 时2 组试验兔肝功能生化指标检测结果
由表1可知,试验组AST、ALT 均显著高于对照组。

表1 2 组试验兔种植后14 d 肝功能检测结果(n =10)
2.2 种植后14 d 时全数字化彩色多普勒超声诊断仪观察情况
彩色多普勒超声诊断仪观察可见肿瘤种植兔肝脏都有肿瘤生长,成模率为100%。二维超声可见内部不均质低回声,呈圆形或椭圆形,边界尚清,未见明显坏死的无回声区(图1)。彩色多普勒超声可见肿瘤内和肿瘤周边有点状、条状或环抱状血流信号(图2)。经耳缘静脉团注0.2 mL 六氟化硫微泡造影剂数秒后可见肿瘤组织周边出现点状增强并逐渐延伸至肿瘤内部,随后迅速消退,呈明显的“快进快出”特征(图3)。肿瘤种植14 d 时兔肝肿瘤最大直径a为(1.20±0.16)cm,最小直径b为(0.96±0.12)cm,体积V为(0.57±0.21)cm3(V=0.5ab2)。对照组未见异常变化。
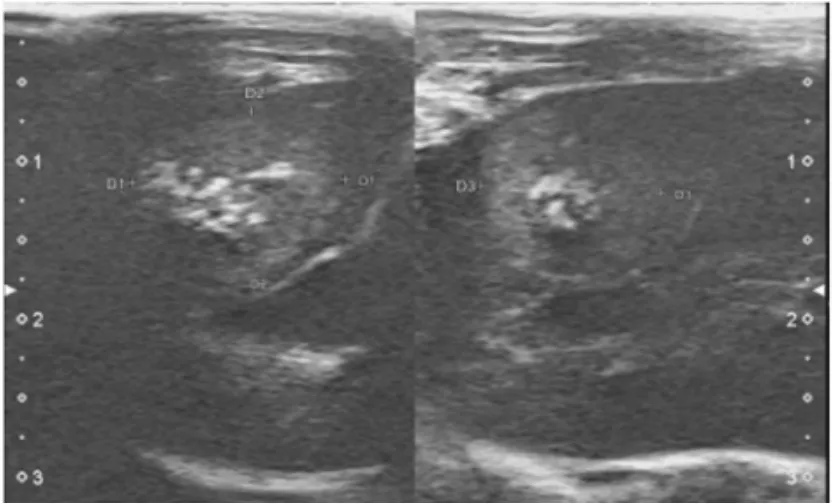
图1 二维超声提示不均质低回声,边界尚清

图2 彩色多普勒显示有血流信号

图3 超声造影后呈明显的“快进快出”特征
2.3 肿瘤种植兔肝的大体和病理观察
肉眼可见肿瘤种植兔肝实质内呈灰白色结节状,呈鱼肉样,质硬,无包膜(图4)。HE 染色后低倍镜下可见肝内多有癌巢,与周围肝实质边界不清晰,结缔组织较少。肿瘤细胞排列分散,肿瘤细胞间可见新生毛细血管(图5)。高倍镜下可见瘤细胞体积增大,形态不规整,细胞呈无序排列。胞浆丰富、淡红色,胞核肥大,瘤细胞大小及形态各异,染色不均匀,多见核分裂(图6)。对照组未见异常变化。
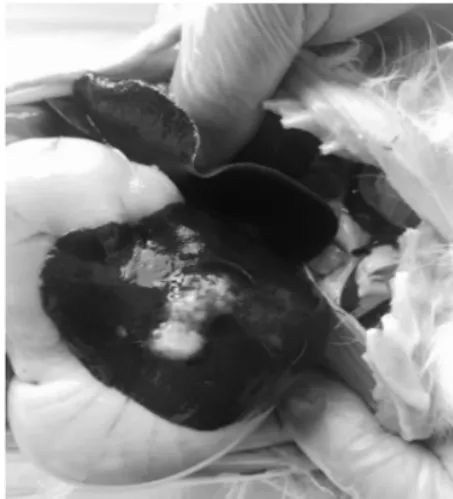
图4 兔肿瘤呈白色鱼肉样

图5 HE 染色后低倍镜病理观察

图6 HE 染色后高倍镜病理观察
3 讨 论
1)兔VX2 肝癌模型制备改良的探究很有必要。目前,常规的制备肝癌模型动物有大鼠、小鼠、兔、树鼩、土拨鼠、斑马鱼等,由于动物成本、饲养条件、外科手术和介入等条件因素的限制,比较常见的还是选用兔来制作肝癌模型[3]。兔VX2 肿瘤细胞株是由Shope 病毒诱发的兔乳头状瘤衍生的鳞状细胞癌,经过70 多次移植传代建立肿瘤细胞株。它是一种侵袭强可移植的肿瘤细胞株,可接种到兔的肌肉、肾脏、脑、肝脏、乳腺、子宫等组织器官内制备成种植性肿瘤动物模型。其中,种植接种兔VX2 肝癌模型比较类似于人的肝癌,经常将其应用于肝癌诊断、发病机制等的基础研究,是临床研究肝癌较为常用动物试验模型之一[4]。制作兔VX2 肝癌模型常用VX2 细胞悬液种植、肿瘤组织悬液种植及肝内肿瘤块移植3 种方法。随着现代科技的发展,肝内肿瘤块移植可在超声、CT、MRI、DSA 等引导下进行种植[5]。但是种植之后肿瘤块会经窦道口脱落而影响建模的成功率,建模的稳定性相对较差,难以满足大批量兔VX2 肝癌模型的应用研究需要。所以本试验对传统开腹肝内种植瘤块法进行了改良,为大批量稳定建模提供了保障。改良开腹肝内种植瘤块法是使用灭菌的不锈钢弯尖头或者带针芯的肿瘤植入针(2.1*50)从同一个入口并以60°为边界朝3 个方向刺破肝组织建立窦道,接种3 块肿瘤块。入口只是一个,对肝脏的机械损伤不大。同一个入口接种3块肿瘤块在一定程度上提高了种植肿瘤成活的机率。在接种3 块肿瘤块后在开口处用缝合线缝合肝包膜,可有效防止肿瘤块的脱出,很大程度上防止异位种植瘤的发生。改良法采用压迫止血,未使用明胶海绵止血,也降低因使用明胶海绵与腹壁发生粘连的概率。因此,试验采用改良开腹肝内同一口三点种植肿瘤块制备VX2 兔肝癌模型,具有操作简单、成模率高、可重复性好和可大批量建模的优点。
2)肝功能生化指标ALT 和AST 对肝细胞损伤与否及损伤程度有敏感的变化[6]。当肝细胞急性损伤时,血清ALT 升高反应最为灵敏。当肝细胞慢性损伤时,血清AST 升高反应超过ALT,因此AST 主要提示的是肝脏损伤程度。试验中兔VX2 肝癌模型ALT 和AST 都显著高于对照组,这与吴海东等[7]研究结果相接近。说明兔VX2 肿瘤细胞的生长破坏兔肝细胞,引起了肝细胞的损伤。
3)超声影像技术在兔VX2 肝癌模型观察中发挥重要的作用。本试验改良建立兔VX2 肝癌模型,因兔腹壁相对较薄,且肝左叶的厚度与人的甲状腺相当,故可充分利用超声高频探头在浅表器官显像上的特有优点,可对兔肝内种植瘤的生长情况进行观察,获得清楚的肿瘤声像图。在超声声像图上,种植瘤与人类原发性肝癌的表现相类似,呈低回声。本试验采用彩色多普勒超声诊断仪观察到肿瘤种植兔肝脏可见内部不均质低回声圆形或椭圆形结节,这与孙一欣等[8]研究结果一致。超声影像技术检查不用开创,可多次进行,对种植瘤内部的生长状态可作动态观察,而且利用全数字彩色多普勒血流成像技术,可观察肿瘤内外的血供情况。在试验中,我们应用超声影像技术观察肿瘤的动态生长情况,说明超声影像技术检查是一种简便、实时、准确观察兔VX2 肝癌影像学方法。
4)病理学检查是兔VX2 肝癌模型建模是否成功的重要指征之一。通过10%甲醛固定经过HE 染色制成病理切片,观察兔肝细胞和组织的形态结构变化,以确定病变性质,作出病理诊断。试验观察兔VX2 肝癌病理变化符合肿瘤的组织学病变特征。这与牛洪欣等[9]制备兔VX2 肝癌模型后取兔做肝病理组织学检查相一致。从病理变化的观察结果说明制备兔VX2 肝癌模型是成功的。
5)手术全程操作必须时刻贯穿无菌概念,包括推剪兔毛后皮肤消毒、肿瘤组织剪小后放在加有抗生素的生理盐水里、肝脏和各层肌肉缝合使用抗生素预防感染、最外层缝合碘酒消毒后涂擦抗生素、红霉素预防感染等,尽可能把感染的风险和几率降到最低,以免严重影响建模的成功率和试验进程。
6)麻醉剂选用应尽可能符合试验开展的需要。陆眠宁具有较好的镇痛、镇静和肌肉松弛作用、用药量少、麻醉效果好、麻醉维持时间长、安全范围广等优点[10]。稳定麻醉状态中降低了兔的呼吸幅度,这给超声检查带来便捷,但是陆眠宁麻醉剂量必须要控制好。正常兔使用剂量为0.2 mL/kg,兔VX2 肝癌模型建模后检查使用剂量为正常使用的1/3~2/3,视具体麻醉效果进行实时调整。在建模超声检查时前期预试验中按正常剂量麻醉引起VX2 肝癌兔的死亡,推测可能是VX2 肝癌兔建模后的抵抗力和免疫力下降所致。试验意外死亡致使前期试验工作成果毁于一旦,浪费了大量的人力物力财力和宝贵的时间。超声影像技术检查完成时及时使用鹿醒宁进行麻醉拮抗,使VX2 肝癌试验兔迅速恢复自主意识,尽可能减少试验兔的意外死亡,进而保证试验顺利开展。
7)兔VX2 肝癌模型生长发育可分为3 个时期即实质期(种植后2~3 周)、坏死期(种植后4~5 周)、囊变期(种植后6~7 周)[11]。药物试验、血管介入、射频消融、肿瘤移植等尽量选择实质期作为最佳时期进行,时间过早过迟试验效果均不佳。

