抑制miR-101对糖尿病肾病模型大鼠肾组织中FOXO1蛋白和自噬水平的影响
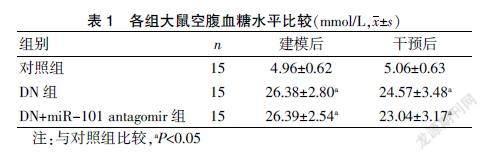
周科挺 金依依 赵华军
[摘要] 目的 探究抑制微小RNA(miR)-101對糖尿病肾病(DN)模型大鼠的影响以及对肾组织叉头状转录因子O1(FoxO1)和自噬的影响。方法 通过腹腔注射链脲佐菌素建立DN模型,随机选择30只DN大鼠分为DN组(n=15)和DN+miR-101 antagomir组(n=15),15只健康大鼠作为对照组。尾静脉注射miR-101 antagomir(300 μg)以抑制miR-101的水平。通过HE染色验证建模结果和抑制miR-101对肾组织的保护作用。检测和比较各组的肾功能指标、miR-101、FoxO1 mRNA和蛋白、自噬蛋白(Beclin1和LC3Ⅱ)表达量。结果 建模后和干预后,DN组和DN+miR-101 antagomir组的血糖水平比较,差异无统计学意义(P>0.05),且均显著高于对照组(均P<0.05)。三组大鼠的上述各项指标比较,差异均有统计学意义(均P<0.05)。DN组的24 h尿蛋白、肌酐和miR-101水平显著高于对照组,FoxO1的mRNA和蛋白、Beclin1和LC3Ⅱ表达量显著低于对照组(均P<0.05)。DN+miR-101 antagomir组的24 h尿蛋白、肌酐和miR-101水平显著低于DN组,FoxO1的mRNA和蛋白、Beclin1和LC3Ⅱ表达量显著高于DN组(均P<0.05)。结论 抑制miR-101可以缓解DN大鼠肾组织损伤保护肾功能,并提高FoxO1蛋白表达量,促进细胞自噬。
[关键词] 糖尿病;糖尿病肾病;微小RNA-101;叉头状转录因子O1;自噬
[中图分类号] R587.2 [文献标识码] A [文章编号] 1673-9701(2022)16-0030-03
Effect of inhibiting miR-101 on level of FOXO1 protein and autophagy in kidney tissue of rats with diabetic nephropathy
ZHOU Keting1 JIN Yiyi2 ZHAO Huajun1
1.School of Pharmacy, Zhejiang Chinese Medical University, Hangzhou 310053, China; 2.Department of Pharmacy, Ningbo First Hospital, Ningbo 315010, China
[Abstract] Objective To explore the effect of inhibiting microRNA (miR)-101 on diabetic nephropathy (DN) model rats, forkhead box O1 (FoxO1) and autophagy in kidney tissue. Methods A DN model was established by intraperitoneal injection of streptozotocin. A total of 30 DN rats were randomly divided into the DN group and the DN+miR-101 antagomir group (n=15), and 15 healthy rats were selected as the control group. MiR-101 antagomir (300 μg) was injected into the tail vein to suppress the level of miR-101. HE staining method was used to verify the modeling results and the protective effect of inhibiting miR-101 on kidney tissue. The renal function indicators, and expression levels of miR-101, FoxO1 mRNA and protein, and autophagy protein (Beclin1 and LC3Ⅱ) were detected and compared between the three groups. Results After modeling and intervention, there was no significant difference in blood glucose level between the DN group and the DN+miR-101 antagomir group (P>0.05), and both were significantly higher than that in the control group (all P<0.05). There were significant differences in the indicators mentioned above among the three groups (all P<0.05). The 24-hour urine protein, creatinine and miR-101 level in the DN group were significantly higher than those in the control group. The expression levels of FoxO1 mRNA and protein, and Beclin1 and LC3Ⅱ in the DN group were significantly lower than those in the control group (all P<0.05). The 24-hour urine protein, creatinine and miR-101 levels in the DN+miR-101 antagomir group were significantly lower than those in the DN group. The expression levels of FoxO1 mRNA and protein, and Beclin1 and LC3Ⅱ were significantly higher than those in the DN group (all P<0.05). Conclusion Inhibiting miR-101 can alleviate damage of kidney tissue in DN rats, protect renal function, and increase expression of FoxO1 protein to promote autophagy.
[Key words] Diabetes; Diabetic nephropathy; MicroRNA-101; Forkhead box O1; Autophagy
糖尿病肾病(diabetic nephropathy,DN)是由高浓度葡萄糖微环境引起的肾组织的纤维化和细胞凋亡,临床表现为肾功能逐渐下降[1]。近年来,研究显示免疫和自噬在DN进程中也起到关键作用[2],细胞的自噬过程可将由高糖引起损伤的细胞器降解为小分子并重新利用,从而保护肾功能[3]。据报道,在DN进展中,叉头状转录因子O1(forkhead box O1,FoxO1)与高糖诱导的肾小管细胞损伤有关[4];Fox O1还可从细胞水平缓解炎性反应[5]。此外,该研究还显示FoxO1的水平受到微小RNA(microRNA,miRNA)的靶向调控。最新研究发现miR-101参与糖尿病诱发的器官损伤,但miR-101在糖尿病肾病中的作用仍不清楚[6]。本研究主要讨论抑制miR-101对DN模型大鼠FoxO1蛋白表达量和自噬水平的影响,现报道如下。
1 材料与方法
1.1 主要材料和仪器
SD大鼠(SPF级,雄性,12周,210~250 g)。链脲佐菌素(Sigma公司,美国)。miR-101抑制剂(antagomir)(广州瑞博生物技术有限公司)。HE染色试剂盒(C0105S)和ELISA试剂盒(碧云天公司,中国)。生化分析仪器(SMT100V,南京电子医疗器械厂)。RNAspin Mini和miRNeasy Mini试剂盒(GE Healthcare,美国)。Bestar qPCR RT和BestarTMqPCR试剂盒(DBI Bioscience公司,德国)。TaqMan miRNA试剂盒(Thermo Fisher公司,美国)。ECL显色试剂盒(Thermo Fisher公司,美国)。抗体、一抗和山羊抗免疫球蛋白G(IgG)二抗(1∶1000稀释,#ab6721)(Abcam公司,美国)。硝酸纤维素膜(EMD Millipore,美国)。显微镜(Carl Zeiss公司,德国)。
1.2 大鼠分组、建模和干预方法
40 只大鼠构建DN模型[7],将链脲佐菌素溶解于pH 4.5的柠檬酸盐缓冲液中,大鼠接受一次性腹腔注射,剂量为60 mg/kg,对照组大鼠注射等量缓冲液。用生化试剂盒在注射后第72 h测量血糖,高于16.7 mmol/L提示建模成功。本研究建模成功率为90%(36/40)。4周后随机选择3只大鼠通过HE染色检测肾组织损伤情况和肾功能指标。采用随机数字表法将建模成功的30只大鼠分为DN组(n=15)和DN+ miR-101 antagomir组(n=15)。取注射等量缓冲液的大鼠15只作为对照组。DN+ miR-101 antagomir组大鼠每周尾静脉注射miR-101 antagomir以抑制miR-101的水平[8],每次300 μg,连续4周。本次动物实验经宁波市第一医院生物医学研究福利伦理委员会批准。
1.3 观察指标和检测方法
1.3.1 血清肾功能指标 采集尾静脉血,通过生化分析仪检测24 h尿蛋白和肌酐评估肾功能。
1.3.2 HE染色 大鼠通过吸入过量的CO2进行安乐死,然后取出肾组织,于室温下采用4%多聚甲醛固定6 h。对其进行HE染色。
1.3.3 RT-qPCR 使用RNeasy Mini试剂盒提取肾组织中的总RNA,然后使用Bestar qPCR RT试剂盒将其逆转转录为cDNA,使用Agilent Stratagene Mx3000P序列检测系统进行RT-qPCR分析。
1.3.4 Western blot 在室温下将膜浸入5%脱脂牛奶中2 h以封闭非特异性抗原。使用Quantum One软件分析灰度计算FoxO1蛋白、自噬相标志蛋白(Beclin1和LC3Ⅱ)相对于GAPDH的表达量。
1.4 统计学方法
使用SPSS 19.0统计学软件进行数据分析,计量资料以均数±标准差(x±s)表示,单因素方差分析(ANOVA)以评估组间差异,两两比较使用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠血糖水平比较
建模后和干预后,DN组和DN+miR-101 anagomir组的血糖水平比较,差异无统计学意义(P>0.05),但均显著高于对照组(均P<0.05),且>16.67 mmol/L。见表1。
2.2 抑制miR-101对DN模型大鼠肾功能指标的影响
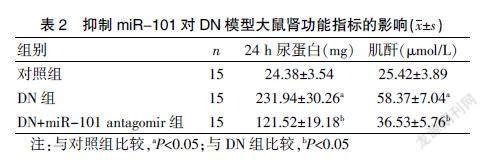
三组的肾功能指标比较,差异有统计学意义(P<0.05),其中DN组24 h尿蛋白和肌酐均显著高于对照组(均P<0.05);DN+miR-101 antagomir组24 h尿蛋白和肌酐均显著低于DN组(均P<0.05)。见表2。
2.3 抑制miR-101对DN模型大鼠肾组织损伤的影响
对照组的肾小球和肾小管一切正常;DN组细胞出现水肿,肾小球膨大;DN+miR-101 antagomir組肾小球结构基本完整,水肿有所缓解。见封三图1。
2.4 抑制miR-101对DN模型大鼠肾组织中miR-101、FoxO1表达水平的影响
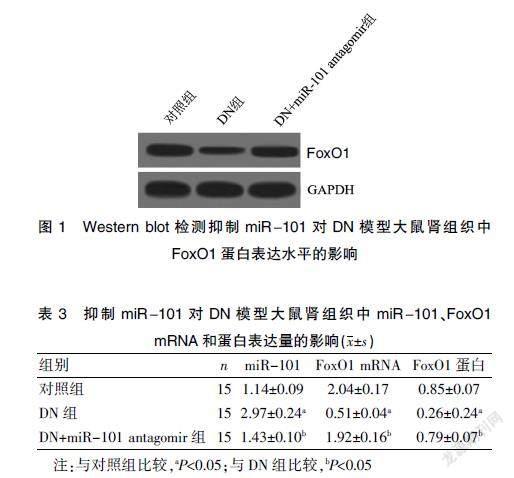
三组大鼠肾组织中miR-101、FoxO1 mRNA和蛋白表达量比较,差异有统计学意义(均P<0.05)。DN组的miR-101表达量显著高于对照组,FoxO1 mRNA和蛋白表达量显著低于对照组(P<0.05)。DN+miR-101 antagomir组的miR-101表达量显著低于DN组,FOXO1 mRNA和蛋白表达量显著高于DN组(P<0.05)。见图1、表3。
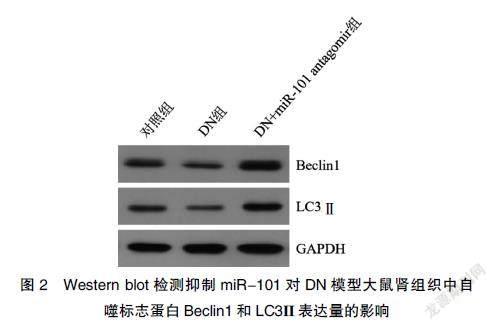
2.5 抑制miR-101对DN模型大鼠肾组织中自噬水平的影响
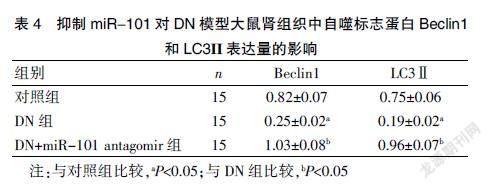
三组大鼠肾组织中自噬水平比较,差异有统计学意义(均P<0.05)。DN组的自噬标志蛋白Beclin1和LC3Ⅱ表达量显著低于对照组(均P<0.05)。DN+miR-101 antagomir组的Beclin1和LC3Ⅱ表达量显著高于DN组(均P<0.05)。见图2、表4。
3 讨论
据统计,全世界超过4亿人口患有糖尿病,每年造成370万人死亡[9]。DN是引发终末肾脏疾病的最常见原因[10]。在DN中,促炎性细胞因子升高,影响肾单位的转运蛋白和离子通道的功能[11]。
miRNA能够靶向抑制多种基因的mRNA并抑制蛋白质的最终翻译[12,13]。miR-320a可通过抑制MafB的表达引起足细胞损伤加重DN中的肾脏功能障碍[14]。在1型糖尿病中,循环miR-101的表达增加并参与糖尿病诱发的脏器损伤[15]。本次研究显示在DN大鼠模型中,肾组织中miR-101水平显著升高,而抑制miR-101能显著缓解肾组织损伤,保护肾功能,但其机制仍需要进一步研究。
研究显示在DN中,FoxO1水平降低,提高FoxO1水平能够缓解高糖引起的肾组织损伤、纤维化和细胞凋亡[16,17]。FoxO1受到miR-101的靶向调控,在乙肝病毒中,miR-101可通过抑制FoxO1蛋白水平调控其复制[18]。这提示miR-101可能通过抑制FoxO1参与DN。近年来研究显示,自噬是细胞在高糖等压力环境下自我保护的方式,其可通过将细胞中受损细胞器、活性氧自由基等送至溶酶体溶解[19]。研究显示诱导自噬可减轻DN大鼠肾组织损伤[20]。本研究结果显示抑制miR-101能够显著提高DN大鼠肾组织中FoxO1蛋白的表达,并促进自噬标志蛋白Beclin1和LC3Ⅱ的水平。Beclin1是自噬底物,其水平降低提示自噬开始,而LC3Ⅱ是自噬小体形成所必需的。据此可推测糖尿病引起的miR-101升高可能会导致FoxO1蛋白表达量的降低,并引起自噬通量的抑制。抑制miR-101可使FoxO1蛋白表达量升高,恢复自噬从而缓解DN引起的肾损伤,保护肾功能。
综上所述,抑制miR-101可缓解DN大鼠的肾组织损伤,保护肾功能,并提高FoxO1蛋白表达量,促进细胞自噬。但关于miR-101在DN中的意义仍需要临床研究证实,其调控FoxO1和自噬的分子机制也需要进一步分析。
[参考文献]
[1] Vasanth RVR,Tan SH,Candasamy M,et al. Diabetic nephropathy: An update on pathogenesis and drug development[J].Diabetes Metab Syndr,2019,13(1):754-762.
[2] 郝继伟,陈超然,杨长永.雷帕霉素对高脂血症小鼠的治疗效果及作用机理探讨[J].免疫学杂志,2020,36(2):124-127.
[3] 杜华,张宁,李玎玎,等.益肾颗粒通过调控LncRNA MALAT1和mTOR介导的自噬改善糖尿病肾病机制研究[J].中华中医药杂志,2020,35(5):2338-2343.
[4] Zhou L,Xu DY,Sha WG,et al. Long non-coding RNA MALAT1 interacts with transcription factor Foxo1 to regulate SIRT1 transcription in high glucose-induced HK-2 cells injury[J].Biochem Biophys Res Commun,2018, 503(2):849-855.
[5] Yang X,He Q,Guo Z,et al. MicroRNA-425 facilitates pat-hogenic Th17 cell differentiation by targeting forkhead box O1 (FoxO1) and is associated with inflammatory bowel disease[J].Biochem Biophys Res Commun,2018,496(2):352-358.
[6] 张婧怡.miRNA-101通过调控胎盘滋养细胞功能参与妊娠期糖尿病的发病[J].现代妇产科进展,2019,28(7):518-522.
[7] 帅瑜,张思泉,沈鑫,等.当归补血汤对糖尿病大鼠肾组织内质网IRE1α-JNK通路的抑制作用[J].中华中医药學刊,2018,6(6):1372-1375.
[8] Lin D,Cui B,Ma J,et al. MiR-183-5p protects rat hearts against myocardial ischemia/reperfusion injury through targeting VDAC1[J].Biofactors,2020,46(1):83-93.
[9] Umanath K,Lewis JB. Update on diabetic nephropathy: Core curriculum 2018[J].Am J Kidney Dis,2018,71(6):884-895.
[10] Typiak M,Piwkowska A. Antiinflammatory actions of llotho: Implications for therapy of diabetic nephropathy[J].Int J Mol Sci,2021,22(2):956-959.
[11] Papademetriou V,Alataki S,Stavropoulos K,et al. Pharmacological management of diabetic nephropathy[J].Curr Vasc Pharmacol,2020,18(2):139-147.
[12] Jiang ZH,Tang YZ,Song HN,et al. miRNA-342 suppresses renal interstitial fibrosis in diabetic nephropathy by targeting SOX6[J].Int J Mol Med,2020,45(1):45-52.
[13] Michlewski G,Cáceres JF. Post-transcriptional control of miRNA biogenesis[J].RNA,2019,25(1):1-16.
[14] He M,Wang J,Yin Z,et al. MiR-320a induces diabetic nephropathy via inhibiting MafB[J].Aging,2019,11(10):3055-3079.
[15] Santos AS,Cunha Neto E,Fukui RT,et al. Increased expression of circulating microRNA 101-3p in type 1 diabetes patients: New insights into miRNA-regulated pathophysiological pathways for type 1 diabetes[J].Front Immunol,2019,10(1):1637-1641.
[16] Huang C,Zheng Y,Chen Y,et al. miR-216a-5p promotes mesangial cell proliferation by targeting FoxO1 in diabetic nephropathy[J].Int J Clin Exp Pathol,2019,12(1):344-355.
[17] Huang F,Wang Q,Guo F,et al. FoxO1-mediated inhibition of STAT1 alleviates tubulointerstitial fibrosis and tubule apoptosis in diabetic kidney disease[J].EBioMed-icine,2019,48(1):491-504.
[18] Wang Y,Tian H. miR-101 suppresses HBV replication and expression by targeting FoxO1 in hepatoma carcinoma cell lines[J].Biochem Biophys Res Commun,2017,487(1):167-172.
[19] 肖超,張世忠,贾晓丽,等.活性维生素D3通过调节自噬活性发挥糖尿病大鼠足细胞保护作用[J].中华内分泌代谢杂志,2019,35(3):240-247.
[20] 齐宝宁,熊永爱,潘艳芳,等.大黄素调控miR-21介导细胞自噬减轻糖尿病肾病小鼠肾脏氧化性损伤机制研究[J].天然产物研究与开发,2020,32(12):35-42.
(收稿日期:2021-03-11)

