磷脂酰-N-乙酰氨基葡萄糖苷的合成及脂质体制备
李雪晗,张海洋,刘 琦,毛相朝*,2
(1.中国海洋大学 食品科学与工程学院,山东 青岛 266003;2.青岛海洋科学与技术试点国家实验室 海洋药物与生物制品功能实验室,山东 青岛 266237)
磷脂(phospholipids,PLs)是一类含磷的脂质的总称,多数是天然产物,少数通过人工合成获得。PLs中同时含有极性与非极性的部分,是一种重要的天然表面活性剂,在食品、医药及化妆品等领域应用广泛[1]。PLs极性的头基部分是磷脂分类的标准之一,其非极性部分的脂肪链长与饱和度用于划分磷脂的亚组分。
近年来,糖基作为磷脂头基的磷脂酰糖苷受到了广泛关注,其中,以磷脂酰葡萄糖苷(phosphatidylglucoside,PtdGlc)的 研 究 最 为 充 分。PtdGlc可从生物体中分离获得[2],其通过脂筏富集在质膜中形成结构域,以维持生物体稳态[3],随后PtdGlc及其衍生物亦被证明在胶质细胞发育与分化中具有重要的作用[4-5]。除此之外,多项研究表明,磷脂制备的脂质体作为靶向递送的载体,可以减少包封物对生物体产生的副作用[6],磷脂包埋还可以提高包封物透过细胞膜的能力[7]。此外,由于糖基中大量的羟基相互作用形成氢键,使得磷脂酰糖苷所制备的脂质体具备更好的稳定性,因此在靶向药物递送与缓释方面具有更为重要的应用前景。糖基的种类会对脂质体大小、聚集程度、脱水及复水稳定性等方面产生影响,例如,磷脂酰蔗糖苷的稳定性优于磷脂酰葡萄糖苷和磷脂酰棉子糖苷[8]。
GlcNAc作为葡萄糖的一种衍生物,在结构上由乙酰氨基取代了葡萄糖2位的羟基。GlcNAc广泛存在于自然界中,也是甲壳素与壳聚糖的主要组成单体。GlcNAc作为一种重要的功能性单糖,具有抗肿瘤及免疫调节活性[9],在临床中亦可有效治疗骨关节损伤与炎症[10],参与肝肾解毒[11]。此外,GlcNAc作为具有保湿补水功能的透明质酸单体更易被人体吸收,进而可被添加至化妆品和护肤品中[12],还可用于清除自由基并在一定程度上改善面部色素沉积[13]。
2008年,Greimel等利用PLD的催化作用,在双相反应体系中合成了磷脂酰-β-D-磷脂酰葡萄糖苷[14]。PLD特异性作用于磷脂的磷酸二酯键,一般可以催化两种反应[15]:在水解作用下,可将磷脂酰胆碱水解生成磷脂酸与胆碱;在转酯作用下,将糖基作为头基基团取代磷脂酰胆碱的胆碱部分,合成磷脂酰糖苷。双相反应体系包括含有糖基供体和酶粉缓冲溶液的水相以及含有磷脂酰胆碱的有机溶剂相。在新型反应体系中,离子液体由于其环保溶剂的性质,被认为是催化反应介质的另一种选择[16]。2012年,有研究者首次将离子液体应用于PLD介导的转酯反应中合成磷脂酰丝氨酸,发现离子液体对PLD的水解作用有强抑制作用,能够更高效地合成转酯产物,具有广泛的应用前景[17]。
为此,以PLD催化GlcNAc转酯合成PtdGlcNAc的反应作为基础,通过比较不同离子液体中酶的活性与反应参数的差异,优化转酯反应条件以高效制备PtdGlcNAc,利用合成的PtdGlcNAc制备脂质体并对其进行初步表征。
1 材料与方法
1.1 材料与试剂
PLD:由实验室保藏菌株发酵制备;GlcNAc(纯度99%):Solarbio公司产品;大豆卵磷脂(纯度95%):Avanti Polar Lipids公司产品;7种离子液体1-乙基-3-甲基咪唑六氟磷酸盐([EMIm][PF6])、1-丁基-3-甲基咪唑六氟磷酸盐([BMIm][PF6])、1-丁基-3-甲基咪唑四氟硼酸盐([BMIm][BF4])、1-丁基-3-甲基咪唑醋酸盐([BMIm][Ac])、1-丁基-3-甲基咪唑氯盐([BMIm][Cl])、1-丁基-3-甲基咪唑硝酸盐([BMIm][NO3])、1-己 基-3-甲 基 咪 唑 六 氟 磷 酸 盐([HMIm][PF6]):上海成捷化学有限公司产品;0.22 μm尼龙66有机滤膜、0.45μm水相滤膜:津腾公司产品;胆碱氧化酶、过氧化物酶:美国Sigma-Aldrich公司产品;其余分析纯试剂均为国药集团化学试剂有限公司产品。
1.2 实验仪器与设备
水浴摇床:上海知楚仪器有限公司产品;TGL16型离心机:长沙英泰仪器有限公司产品;LC-20AT型高效液相色谱仪、ELSD-16型蒸发光散射探测器:日本岛津公司产品;MULTISKAN FC型酶标仪、Q Exactive组合型四极杆Orbitrap质谱仪:赛默飞世尔科技公司产品;N-1300系列旋转蒸发仪:EYELA东京理化器械株式会社产品;HH-3A型水浴锅:常州智博瑞仪器制造有限公司产品;超声波细胞粉碎机:宁波新芝生物科技股份有限公司产品。
1.3 试剂配制
1.3.1 柠檬酸-柠檬酸钠缓冲溶液A:100 mmol/L一水合柠檬酸溶液(C6H8O7·H2O);B:100 mmol/L二水合柠檬酸钠溶液(Na3C6H5O7·2H2O)。A、B溶液以体积比3.8∶16.2充分混合,配置成pH 6.0的100 mmol/L柠檬酸-柠檬酸钠缓冲溶液,4℃保存备用。
1.3.2 PLD水解反应显色液将50 U胆碱氧化酶、100 U过氧化物酶、100 mg 4-氨基安替比林、50 mg苯酚、1.0 g曲拉通TristanX-100溶解至100 mL的1 mol/L Tris-HCl缓冲液中,超声混匀后分装,保存至-80℃冰箱中,用时提前取出,常温解冻。
1.4 实验方法
1.4.1 离子液体预处理PLD将1 U的PLD酶粉加至600μL离子液体中,将混合物置于水浴摇床中孵育1 h,控制温度为40℃。孵育结束后,用pH 6.0的0.1 mol/L柠檬酸-柠檬酸钠缓冲液300μL萃取酶粉两次。将所得的600μL离子液体与600 μL缓冲液直接加入后续转酯反应体系中。
1.4.2 PLD离子液体转酯反应体系实验在15 mL的棕色具塞螺口瓶中进行。在孵育后的水相中加入0.172 g GlcNAc,充分溶解后得到600μL含有GlcNAc与PLD的0.1 mol/L柠檬酸-柠檬酸钠缓冲液(pH 6.0)以及600μL孵育后的离子液体,最后加入含有10 mg PC的有机溶剂。将棕色具塞螺口瓶密封后置于水浴摇床中,控制转速为200 r/min,温度为40℃,反应时间为12 h。定期取样,将反应混合物在8 000 r/min下离心5 min后,吸取上层有机相溶液100μL用于后续高效液相色谱分析。
1.4.3 PLD水解活力的测定利用酶联比色法测定PLD的水解活力[18]。PLD水解PC产生的胆碱在胆碱氧化酶和过氧化物酶的作用下可生成红色显色物质,利用其在500 nm下的最大吸收峰来计算PLD的水解活力。称取不同质量浓度的氯化胆碱制作标准曲线。PLD水解活力定义为每分钟水解产生1μmol胆碱所需要的酶量为一个酶活单位。
1.4.4 离子液体的筛选取1-乙基-3-甲基咪唑六氟磷酸盐([EMIm][PF6])、1-丁基-3-甲基咪唑六氟磷酸盐([BMIm][PF6])、1-丁基-3-甲基咪唑四氟硼酸盐([BMIm][BF4])、1-丁基-3-甲基咪唑醋酸盐([BMIm][Ac])、1-丁基-3-甲基咪唑氯盐([BMIm][Cl])、1-丁基-3-甲基咪唑硝酸盐([BMIm][NO3])、1-己基-3-甲基咪唑六氟磷酸盐([HMIm][PF6])7种离子液体预处理PLD后测定PLD的水解活力与转酯生成PtdGlcNAc的产率,选取产率高的离子液体用于后续反应优化。
1.4.5 转酯反应条件单因素优化PLD转酯合成PtdGlcNAc的反应中,以产物产率为指标进行单因素实验设计。分别固定其他因素,依次评价转酯时间(2、4、6、8、10、12、14、16、18、20、22、24 h)、酶添加量(0.2、0.4、0.6、0.8、1.0、1.5、2.0、2.5 U)、底物PC与GlcNAc的物质的量比(1∶5、1∶10、1∶20、1∶30、1∶40、1∶50、1∶60、1∶70)、有机溶剂(乙醚、甲苯、环戊基甲醚、乙酸乙酯、乙酸丁酯、丁酸乙酯、二甲亚砜)、离子液体相与水相体积比 (0∶1、1∶4、2∶3、1∶1、3∶2、4∶1)对PtdGlcNAc产率的影响。此外,由于GlcNAc在水溶液中溶解度的局限性,故降低PC质量浓度后继续优化底物PC与GlcNAc的物质的量比(1∶20、1∶40、1∶60、1∶80、1∶100、1∶120)对PtdGlcNAc产率的影响。
1.4.6 高效液相色谱条件用HPLC-ELSD分析法测定PtdGlcNAc的产率。参照作者所在团队建立的检测方法[19]。检测所需硅胶柱为YMC DIOL(5μm,250 mm×4.6 mm)和ELSD检测器(SHIMADZU,日本)。ELSD的喷雾器压力保持在0.45 MPa,漂移管温度为40℃,氮气流量为3 L/min。流动相A:正己烷、异丙醇、醋酸、三乙胺体积比为81.42∶17∶1.5∶0.08;流动相B:异丙醇、水、醋酸、三乙胺体积比为84.42∶14∶1.5∶0.08。色谱分离采用线性梯度洗脱:从初始流动相B体积分数5%开始逐渐增加其占比,25 min时体积分数达到100%,后降低至初始水平。洗脱液总流量控制在1 mL/min。PtdGlcNAc的保留时间为16.5 min。用纯化的PtdGlcNAc制作标准曲线,从而对其进行定量检测,产物结构通过质谱(MS)分析确定。
1.4.7 转酯产物的质谱检测利用MS分析PtdGlcNAc的相对分子质量。将高流量的氮气通过样品,在保持产物稳定性的同时将原有的有机溶剂完全去除。用氯仿、甲醇体积比为1∶1的混合溶液将PtdGlcNAc复溶后进行一级质谱与二级质谱(MS与MS/MS)检测。电喷雾离子源(ESI),负离子扫描模式,扫描范围:m/z为80~1 200。
1.4.8 脂质体的制备首先,取转酯反应合成的磷脂酰糖苷800μL置于旋蒸茄形瓶中,200 hPa压力下,使物质混合均匀后调压至50 hPa除去混合体系中的有机溶剂,直至在茄形瓶底端形成一层薄膜。真空干燥30 min,充分除净体系内有机溶剂。然后加入5 mL去离子水,使薄膜完全溶解在水溶液中。在冰水浴环境下,超声破碎处理制得脂质体悬浊液,超声处理条件为:超声功率300 W,超声2 s,间歇2 s,处理时间10 min。最后将制得的脂质体(LipPNA)通过0.45μm水相滤膜,4℃保存备用。
1.4.9 脂质体的表征
1)粒径及Zeta电位表征 将新鲜制备的800 μL LipPNA加至样品池,测量条件为:仪器平衡120 s,温度25℃,检测角度90°,样品设置每组3个平行。采用马尔文激光粒度电位仪检测粒径与电位并进行记录[20]。
2)样品形态表征 将新鲜制备的LipPNA滴于200目的方华膜上,静置3 min,将方华膜移至烤灯下除去膜上多余水分,然后在干燥的方华膜上滴加一滴2%(体积分数)磷钨酸染液进行负染[21],静置3 min,用滤纸吸干膜上多余液体后放在烤灯下使方华膜液体蒸发。通过透射电子显微镜在80 kV的电压下观察样品的形态并拍照记录。
3)稳定性分析 将制得的LipPNA脂质体放置在4℃条件下,定期取样,记录粒径和电位的变化,以此为依据,判断其短期内的稳定性。
2 结果与讨论
2.1 离子液体的筛选
2.1.1 离子液体处理后PLD水解活力测定离子液体处理后的PLD,经pH 6.0的0.1 mol/L柠檬酸-柠檬酸钠缓冲液(300μL)萃取两次至水相中。用酶联比色法测定水相中PLD的水解活力,设定水解活力最高的实验组酶活为100%。所得结果见图1。[BMIm][PF6]处理后PLD的水解活力与未处理组相当,仅仅略高于未处理组。其次,[HMIm][PF6]和[EMIm][PF6]处理后的PLD水解活力约为[BMIm][PF6]处理后酶活的85%。而[BMIm][BF4]、[BMIm][NO3]、[BMIm][Cl]、[BMIm][Ac]离子液体处理之后导致PLD的水解活力受到很大的影响,[BMIm][BF4]处理组仅为[BMIm][PF6]处理后酶活的4.4%。从水解活力角度出发,探究不同离子液体处理后的PLD催化性能差异,可为转酯反应提供参考。

图1 不同离子液体处理前后PLD水解活力的变化Fig.1 Changes of PLD hydrolysis activity before and after pretreatment with different ionic liquids
2.1.2 离子液体处理后PLD转酯活力测定离子液体反应体系由三相构成:预处理PLD后的离子液体相、含有预处理后的PLD与GlcNAc的0.1 mol/L柠檬酸-柠檬酸钠缓冲液(pH 6.0)水相以及含有底物PC的有机相。转酯反应结束后,将有机相收集,利用HPLC-ELSD定量计算PtdGlcNAc产率,7种离子液体处理后的产物产率见图2(a)。其中,经[BMIm][PF6]孵育后的PLD实验组具有明显高于其他组分的产率。[HMIm][PF6]、[EMIm][PF6]和[BMIm][Cl]的产率次之,为[BMIm][BF6]产率的90%、84%以及42%。相反,经[BMIm][BF4]、[BMIm][NO3]、[BMIm][Ac]处理后,PtdGlcNAc几乎无法合成,可能是因为这3种离子液体的处理对PLD的结构造成了负向的改变,导致PLD的关键催化位点发生变化,抑制了PLD的转酯催化活性。通过比较图2(b)中结果发现,[BMIm][PF6]相较于其他离子液体反应副产物最少,使PC更高效率地向PtdGlcNAc方向合成。[BMIm][PF6]是一类疏水型的离子液体,当PLD在此环境中,离子液体倾向于保存蛋白质分子周围的基本水层[17],因此常用于催化不同脂肪酶。综上,由于[BMIm][PF6]参与的转酯反应产率最高,因此可以作为后续离子液体三相反应体系中对PLD的预处理试剂。

图2 不同离子液体预处理后PLD转酯活力的比较Fig.2 Comparison of transphosphatidylation activities of different ionic liquids after pretreatment of PLD
2.2 产物结构鉴定
对产物的结构确定至关重要,由于缺少产物标品,故无法通过液相直接确定产物种类。因此,将转酯反应产物溶解至氯仿、甲醇体积比为1∶1的溶剂中直接进样进行质谱检测。一级质谱如图3(a)所示,一系列优势峰中,[M-H]-分别对应898.546 23(相对分子质量899.55)和874.436 15(相对分子质量875.44),与PtdGlcNAc的相对分子质量完全一致。质谱结果出现较多的离子峰,是因为底物PC疏水端脂肪酸为混合物,故生成的产物亦为混合物。第一个主峰相对分子质量为899.55,此峰以GlcNAc为亲水头基,两条亚油酸残基(C18∶2)为疏水尾端;另一个优势峰相对分子质量为875.44,此峰以GlcNAc为亲水头基,一条亚油酸残基(C18∶2)和一条棕榈酸残基(C16∶0)为疏水尾端。此结果与底物PC中含有63%的亚油酸以及14.9%的棕榈酸结果相对应。分别对两个优势峰进行二级质谱检测,见图3(b)、图3(c)。以PtdGlcNAc(C16∶0,C18∶2)为例,会进一步碎裂成m/z为153.00、255.23、279.23、391.23、671.47、773.50等特异性碎片离子,其中m/z为153.00的离子来源于N-乙酰-D-氨基葡萄糖基,m/z为255.23的离子来源于棕榈酸残基,m/z为279.23的离子来源于亚油酸残基,m/z为391.23的离子来源于棕榈酸残基与磷酸基团,m/z为671.47的离子来源于两个脂肪酸残基与磷酸基团,m/z为773.50的离子来源于PtdGlcNAc的葡萄糖环碎片。由此可证明PLD催化成功合成了PtdGlcNAc。

图3 PtdGlcNAc质谱结果鉴定Fig.3 Characterization of phosphatidyl-N-acetylglucosamine(PtdGlcNAc)by mass spectrometry
2.3 离子液体三相反应体系与传统双相反应体系的比较
目前传统双相反应体系的研究最为充分与广泛,而离子液体反应体系在酶催化过程中的应用是近年来的研究趋势[22]。不同转酯时间下,PtdGlcNAc的产率见图4。两种反应体系随时间的变化趋势几乎一致,在0~4 h内,PtdGlcNAc产率呈快速升高的趋势;4~12 h内,PtdGlcNAc产率相较于前4 h增速趋于缓和;在12 h时达到最高产率;12 h后,产率维持在一定水平,证明在12 h时酶促反应达到平衡。最终,离子液体[BMIm][PF6]预处理PLD后,产物产率为60%,而传统双相反应体系下,产物产率仅为46%,在相同反应条件下,产率提升了将近25%。由此证明优化后的反应体系更有助于PtdGlcNAc的合成,为研究提供了必要性。综合考虑转酯时间与产物产率的关系,选择转酯时间为12 h。
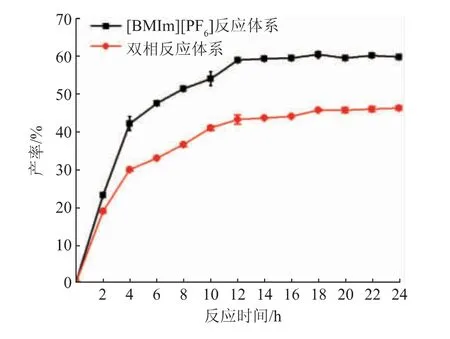
图4 [BMIm][PF6]三相反应体系与双相反应体系的产率比较Fig.4 Comparison of yield between[BMIm][PF6]three phase reaction system and biphase reaction system
2.4 离子液体三相反应体系条件优化
2.4.1 酶添加量固定其余反应参数,设置0.2、0.4、0.6、0.8、1.0、1.5、2.0、2.5 U的酶添加量梯度,以考察酶添加量对转酯反应的影响,结果见图5(a)。随着酶添加量的增加,GlcNAc的酯化速度不断加快,PtdGlcNAc的产率在1 U加酶量时达到59.5%。继续增加酶的添加量,产率维持在60%左右,为了充分发挥PLD的酶活,选择1 U为转酯反应的最优酶添加量。
2.4.2 底物PC与GlcNAc的物质的量比固定其余反应参数,PC与GlcNAc的物质的量比梯度设置为1∶5、1∶10、1∶20、1∶30、1∶40、1∶50、1∶60、1∶70,以考察不同物质的量比对PLD催化酯化反应的影响,结果见图5(b)。由于GlcNAc在水溶液中溶解度的局限性,故降低PC质量浓度至原先的50%后,设置1∶20、1∶40、1∶60、1∶80、1∶100、1∶120的实验组同时进行研究。随着GlcNAc物质的量增加,PtdGlcNAc产率逐渐升高。当PC初始质量浓度为16.67 mg/mL时,物质的量比在1∶60之前,反应产率快速增加,在1∶60时增速趋缓但仍未达到平衡。同样地,当PC初始质量浓度为8.33 mg/mL时,物质的量比在1∶120之前,产率一直处于快速增加的阶段。但是,这个水平已经达到GlcNAc在水溶液中的最大溶解度,物质的量比很难再继续增加。根据已有结论进行推测,继续在反应体系中加大物质的量比,产物转化率会继续增加从而达到平衡。其原因推测是,在高质量浓度的糖溶液存在时,糖会优先与PLD结合形成糖-PLD复合体,使糖成了优势的酰基供体,进而进行转酯反应;当糖质量浓度较低时,水分子会更易于与PLD形成复合体从而形成大量副产物磷脂酸(phosphatidic acid,PA),导致产物产率降低。在保证产率的条件下,考虑到实验的简易与便捷性,当PC初始质量浓度为16.67 mg/mL时,选择物质的量比为1∶60。
2.4.3 有机溶剂固定其余反应参数,从乙醚、甲苯、环戊基甲醚、乙酸乙酯、乙酸丁酯、丁酸乙酯、二甲亚砜中选择最适有机溶剂。不同有机溶剂对PLD转酯反应的影响见图5(c)。当有机溶剂为乙醚时,PtdGlcNAc产率最高达61.2%,环戊基甲醚中产率略低,为59.5%。除此之外,甲苯、丁酸乙酯、乙酸乙酯中的产率较低,分别为51.9%、40.9%和27.7%。使用乙酸丁酯和二甲亚砜作为有机相时则几乎无法合成目标产物。与环戊基甲醚相比,乙醚具有刺激性与急性毒性且致迷、致幻,而环戊基甲醚作为一种新型环保高性能疏水性醚类溶剂[23],可以降低醚类物质的毒性[24],是其他醚类物质的绿色替代品,在各类反应中被广泛应用。由此,选择环戊基甲醚作为后续转酯反应的有机溶剂。
2.4.4 离子液体相与水相体积比固定其余反应参数,设置梯度为0∶1、1∶4、2∶3、1∶1、3∶2、4∶1的离子液体相与水相体积比,以优化离子液体添加量,结果见图5(d)。实验结果表明,在少量离子液体预处理PLD时会对酶造成抑制作用,随着离子液体相体积的增加,产物PtdGlcNAc产率逐渐增加。在体积比为2∶3时,产率为38.3%略低于未经离子液体处理的44.5%,但在体积比为1∶1时,产率增加至61.5%,随着离子液体相体积的逐渐增加,产率在体积比4∶1时达到最高为79.7%。根据结果表明,离子液体的加入能抑制水解副产物PA的生成。综合实验结果,选择离子液体相与水相体积比为4∶1。

图5 转酯反应条件的优化Fig.5 Optimization of transphosphatidylation reaction conditions
2.5 纳米脂质体的表征
2.5.1 粒径分析脂质体粒径测定结果见图6(a)。LipPNA的平均粒径为(64.2±1.6)nm,平均多分散性指数(PDI)为0.296±0.002。根据前人的研究指出,当PDI的数值小于0.3时,制备的样品具有更高的稳定性,不易分层与变质[20]。此项结果证明,制备的LipPNA比较成功。
2.5.2 Zeta电位表征Zeta电位可表征带电粒子间的排斥作用,其表面的电荷越大,稳定性也越高[19]。根据前人的研究指出,当电位的绝对值大于30 mV时,体系稳固,不易发生破裂,保存时间大大增加[21]。如图6(b)所示,LipPNA带负电荷,其Zeta电位为(-46.3±2.5)mV,绝对值大于30 mV,说明制备的样品具有良好的稳定性。这可能与GlcNAc糖基上存在的多个羟基之间形成了稳定的氢键有关,由此增强了LipPNA的结构稳定性。
2.5.3 透射电子显微镜(TEM)分析新鲜制备的LipPNA的TEM成像见图6(c)。LipPNA呈不规则的圆形结构,大小相对均一,具有良好的分散性。
2.5.4 稳定性评价脂质体的稳定性是一个非常重要的评价指标。因此,对制得的脂质体在15 d内进行了定期的粒径与电位测量,以此考察其短期内的稳定性。如图6(d)、图6(e)所示,在4℃条件下放置过程中,脂质体的粒径与电位变化不显著,说明该方法制备的脂质体稳定性较好。
3 结 语
将离子液体-水-有机溶剂三相反应体系应用于PLD转酯合成磷脂酰糖苷类化合物的反应中,提升了酶促转酯反应的性能。结果表明,PLD在[BMIm][PF6]中孵育后具有更高的活性与稳定性。离子液体的存在也抑制了PLD水解反应副产物PA的生成,驱动反应向转酯酰化反应方向进行,显著提高了PtdGlcNAc的产率。此外,离子液体容易回收,可以重复利用,具有环保性。该研究为磷脂酰糖苷脂质体的高效制备和应用提供了理论依据。

图6 LipPNA的表征Fig.6 Characterization of LipPNA

