菜芙蓉多糖对秀丽隐杆线虫抗氧化作用的研究
杜星芳 贾艳丽 韩紫薇 仇燕



摘要:为进一步研究菜芙蓉多糖(AMP)的体内生物学作用,系统探究其抗氧化机理,以秀丽隐杆线虫(Caenorhabditis elegans)为模型,分析了正常生长条件及氧化应激条件下,空白对照组(0 mg/mL)、低剂量组(25 mg/mL)、中剂量组(50 mg/mL)、高剂量组(100 mg/mL)AMP对线虫生理指标、生化指标及细胞凋亡的影响。结果表明,正常生长条件下AMP可延长线虫寿命、降低生殖能力、提高运动能力,降低线虫体内MDA和ROS含量、提高SOD,CAT和GSH-Px 的酶活性。在200 μmol/L胡桃醌氧化应激条件下,AMP可提高线虫存活率,并能有效清除体内ROS、降低MDA含量,提高线虫体内SOD,CAT和GSH-Px 的酶活性,抑制细胞凋亡。AMP可通过提高线虫体内抗氧化防御系统酶活性及清除自由基提高氧化应激抵抗力,因此AMP有潜力成为一种新的抗氧化天然多糖。
关键词:多糖生物化学;菜芙蓉多糖;秀丽隐杆线虫;抗氧化;活性氧基团
中图分类号:R284文献标识码:A
DOI:10.7535/hbkd.2022yx03011
Study on antioxidantactivity of Abelmoschus manihot (L.) medic polysaccharide on Caenorhabditis elegans
DU Xingfang,JIA Yanli,HAN Ziwei,QIU Yan
(School of Food Science and Biology,Hebei University of Science and Technology,Shijiazhuang,Hebei 050018,China)
Abstract:In order to study the biological roles of Abelmoschus manihot (L.) medic polysaccharide (AMP) in vivo and the underlying mechanism,C.elegans was used as a model to analyse the influence of ck(0 mg/mL),low dose group (25 mg/mL),medium dose group (50 mg/mL) and high dose group (100 mg/mL) AMP on physiological indexes,biochemical indexes and apoptosis of nematodes.The results show that AMP could prolong the life span of C.elegans,reduce the reproductive capacity,improve the motor capacity,lower the content of MDA and ROS,and increase the activities of SOD,CAT and GSH-Px under normal growth conditions.Under the condition of 200 μmol/L juglone oxidative stress,AMP can improve the survival rate of nematodes,effectively eliminate ROS,reduce the content of MDA,increase the activities of SOD,CAT and GSH-Px and inhibit cell apoptosis.AMP can enhance the resistance of C.elegans to oxidative stress by increasing the enzyme activities of antioxidant defense system and scavenging free radicals.AMP has the potential to be a new kind of natural polysaccharide with antioxidant activity.
Keywords: polysaccharide biochemistry;Abelmoschus manihot(L.) medic polysaccharide;Caenorhabditis elegans (C.elegans);antioxidation;reactive oxygen species
衰老是器官系統发生的渐进退化性变化,细胞因过度应激而损伤,导致机体免疫反应衰退和代谢障碍[1]。代谢过程中产生的活性氧基团(reactive oxygen species,ROS)是导致衰老与年龄相关疾病的主要因素之一。过量的ROS会破坏脂质、蛋白质和DNA等主要生物大分子,造成线粒体功能障碍甚至会引起细胞的凋亡,从而引发阿尔茨海默症、帕金森氏病和亨廷顿病等老年退行性疾病[2-3],严重影响老年人的生活质量。如何延缓衰老、增进健康长寿成为生物医学领域研究的热点。
多糖是由多个相同或不同的单糖分子经脱水、聚合,通过糖苷键连接形成的高分子化合物[4]。多糖结构复杂,在抗氧化、抗病毒、抗肿瘤、抗炎、降血糖和降血脂等方面具有显著活性,对化学、物理及生物来源的多种活性氧具有清除作用[4-5],近年来已成为食品保健和医学领域研究的热点。王雪等[6]的研究表明,昆布多糖、羊栖菜多糖和海蒿子多糖 3 种海藻多糖具有显著的体外抗氧化活性,均能有效清除羟基自由基、超氧自由基及DPPH自由基,并且海藻多糖可显著延长线虫寿命。此外,邵新月[7]报道了葛根水溶性多糖在热应激条件下可提高线虫体内SOD活性,降低MDA含量,并能有效清除活性氧自由基,抵抗氧化应激,延缓线虫衰老。蒙雨丹等[8]报道植物提取物等生物活性物质的抗衰老作用机制涉及细胞激酶和NF-κB /MAPK/PI3K-Akt/AMPK/ERS等相关信号转导通路途径,进而产生抗炎、移植肠道菌群、清除衰老细胞、减少应激反应和抗氧化等作用。
菜芙蓉(Abelmoschus manihot(L.)medic),别名金花葵、野芙蓉,是锦葵科秋葵属植物,具有清利湿热、解毒消肿的功效[5,9-10]。近年来,针对菜芙蓉花黄酮类物质活性的研究较多,而对于菜芙蓉花多糖的研究鲜见报道。有研究结果表明菜芙蓉多糖(Abelmoschus manihot(L.) medic polysaccharide,AMP)主要由鼠李糖、葡萄糖、阿拉伯糖、岩藻糖组成,且含有O—H,C—H,—CHO—,C=O,C—O—C,C—O—H等多糖类结构,并且能够有效清除·O,ABTS·,DPPH·,·OH,NO·,抑制DNA的氧化损伤等[5]。ZHENG等[11]分离出的黄蜀葵多糖组分AMPS-a可抑制SMMC-7721,HepG2肝癌细胞和MGC-803,MKN-45胃癌细胞的增殖。但是,目前有关菜芙蓉多糖体内的抗氧化研究未见报道。因此,本实验以秀丽隐杆线虫为模式生物,研究正常生长条件下AMP对线虫自然衰老的延缓作用,并进一步探究AMP在胡桃醌氧化应激条件下对线虫的保护作用。
1材料与方法
1.1主要材料
菜芙蓉多糖的制备过程如下菜芙蓉产地为河北井陉,菜芙蓉花多糖的制备参照文献[5]。将菜芙蓉花粉末经80%乙醇提取黄酮后所得的残留物,经抽滤、干燥作为多糖的提取原料。准确称取400 g原料,按照料液比为1∶10(g∶mL)加入蒸馏水,80 ℃加热、浸提4 h,重复抽滤3次,收集合并滤液。将滤液在旋转蒸发器中于60~70 ℃减压浓缩至原体积的1/3(呈糖浆状),加入3 倍体积的95%乙醇进行沉淀,4 ℃静置过夜,抽滤收集沉淀物。将沉淀物依次用无水乙醇、丙酮、乙醚洗涤后收集沉淀。称取5 g 沉淀溶于100 mL水,加入三氯乙酸至终浓度为150 g/L,4 ℃静置过夜除蛋白,4 000 r/min离心10 min,收集上清液,加入体积分数为20%的双氧水和质量分数为1%的活性炭除色素,透析。将透析液置于50 ℃恒温箱中进行干燥,获得白色菜芙蓉粗多糖晶体。准确称取1 g粗多糖晶体溶于50 mL蒸馏水,经DEAE-52纤维素层析柱(2.5 cm×40 cm)依次用水、NaCl梯度洗脱,收集主峰洗脱液进行浓缩冻干获得菜芙蓉多糖AMP。
秀丽隐杆线虫N2、尿嘧啶缺陷型大肠杆菌OP50(Escherichia Coli,E.Coli OP50)由中国农业大学提供。
1.2试剂及仪器
试剂:BCA蛋白质浓度检测试剂盒、胡桃醌,购自北京索莱宝试剂公司;总超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒、过氧化氢酶(catalase,CAT)检测试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)检测试剂盒、丙二醛(malonaldehyde,MDA)检测试剂盒,均购自南京建成生物工程研究所有限公司;活性氧族物质(Reactive Oxygen Species,ROS)荧光探针,购自大连美仑生物技术有限公司;吖啶橙(分析纯),购自上海如吉生物科技发展有限公司。KHPO,NaHPO,NaCl,MgSO等试剂,均为分析纯。
主要仪器:RE-52旋转蒸发器,上海亚荣生化仪器厂提供;SHP-1500生化培养箱,上海精宏实验设备有限公司提供;SpectraMAX i3x酶标仪,MolecularDcvices美国美谷分子仪器有限公司提供;IX51荧光倒置显微镜,Nikon日本尼康仪器有限公司提供;ST6012-ST1体视显微镜,上海涵今仪器仪表有限公司提供。
1.3溶液
M9缓冲液:准确称取3 g KHPO,6 g NaHPO和5 g NaCl,加入1 mL MgSO,加去离子水溶解并定容至1 L,于121 ℃灭菌20 min。
NGM固体培养基:准确称取0.75 g NaCl,0.625 g胰蛋白胨和4.25 g琼脂,加去离子水溶解至250 mL,于121 ℃灭菌20 min。待培养基冷却至55 ℃,加入已灭菌的0.25 mL 1 mol/L CaCl,0.25 mL 5 mg/mL胆固醇乙醇溶液,0.25 mL 1 mol/L MgSO和6.25 mL 1 mol/L KPO,混匀,备用。
线虫裂解液:准确称取4 g NaOH,溶解于5 mL NaClO中,加去离子水定容至100 mL。
1.4秀丽隐杆线虫的培养及同期化
将线虫接种培养至涂布E.Coli OP50的NGM固体培养基上,20 ℃恒温培养。线虫同期化采用碱-次氯酸钠裂解法,用M9缓冲液冲洗處于产卵高峰期的线虫,1 200 r/min离心2~3 min,弃上清,收集沉淀并加入1 mL裂解液,于漩涡混匀器剧烈震荡5 min,1 200 r/min离心2~3 min,弃上清液。用M9缓冲液反复冲洗沉淀2~3次至pH值为中性,弃上清液,收集沉淀。将沉淀涂布于NGM固体培养基,20 ℃恒温培养2 d至L4期,获得同期化线虫。
1.5正常生长条件下AMP对线虫抗氧化活性的影响
准确称取150 mg AMP,用OP50菌液溶解AMP,获得100 mg/mL AMP母液,依次稀释得到终浓度为50 mg/mL和25 mg/mL的AMP溶液,并均匀涂布于NGM培养基,分别为高(100 mg/mL)、中(50 mg/mL)、低(25 mg/mL)剂量实验组,空白组为只涂布OP50菌液(OD=0.4~0.6)。
1.5.1寿命检测
将同期化线虫培养至L4期后,挑取生长状态良好的线虫,置于不含或含不同浓度AMP的NGM培养基中,每平四30条线虫,20 ℃恒温培养箱培养,此时记为0 d。每隔2 d将线虫转移到新的NGM培养基上并记录线虫存活状况,直至线虫全部死亡。接种针反复触碰线虫无任何反应判断其死亡,由操作失误导致的线虫死亡、线虫钻入培养皿或爬到皿壁干燥死亡、囊代虫、幼虫在体内孵化等造成线虫死亡的均不计入总数[11]。
1.5.2生殖能力检测
将同期化线虫培养至L4期后,挑取生长状态良好的线虫,置于不含或含不同浓度AMP的NGM培养基中,每平皿1条线虫[7],20 ℃恒温培养箱培养。每天将线虫转移到新的NGM培养基,并统计产卵量至线虫不再产卵,各平皿产卵量加和即为总产卵量[12]。
1.5.3运动能力检测
将同期化线虫培养至L4期后,挑取生长状态良好的线虫,置于不含或含不同浓度AMP的NGM培养基中,每平皿30条线虫,20 ℃恒温培养箱培养24 h。平皿中加入M9缓冲液冲洗线虫,使其运动1 min,分别记录1 min内线虫身体的弯曲次数(身体弯曲是指线虫身体长轴方向上一个波长的移动)和30 s内线虫的头部摆动次数(头部摆动为线虫头部从一侧摆向另一侧再摆回来计为1次)[13]。
1.5.4ROS含量及抗氧化指标检测
将L4期线虫置于不含或含不同浓度AMP的NGM培养基中,每平皿约2 000条线虫,20 ℃恒温培养箱培养3 d,用生理盐水冲洗收集线虫。将线虫放入玻璃匀浆器,冰上研磨5 min,4 ℃,4 000 r/min离心取上清液,即为蛋白匀浆。黑色96孔板中加入50 μL 蛋白匀浆和50 μL 100 μmol/L DCFH-DA(2′,7′-二氯荧光黄双乙酸盐)荧光探针,使DCFH-DA终浓度为50 μmol/L。每组设置3个复孔,用酶标仪在激发波长为485 nm、发射波长为538 nm条件下检测反应溶液的荧光强度。用BCA蛋白浓度试剂盒检测蛋白匀浆的浓度。SOD,CAT,GSH-Px和MDA抗氧化指标,均使用南京建成试剂盒进行检测。
1.5.5细胞凋亡检测
利用吖啶橙染色法检测线虫细胞凋亡情况。将线虫置于不含或含不同浓度AMP的NGM培养基3 d后,用M9缓冲液冲洗干净,加入25 μg/mL吖啶橙溶液染色2 h(避光操作),用生理盐水浸泡洗去浮色,滴1滴咪唑溶液于琼脂平面中央,将线虫置于咪唑溶液中,盖上盖玻片,于荧光倒置显微镜蓝色激发光下观察线虫细胞的凋亡情况[14]。
1.6氧化应激条件下AMP对线虫抗氧化活性的影响
配制含200 μmol/L胡桃醌的NGM培养基,将培养至L4期线虫置于不含或含不同浓度AMP的NGM培养基平皿中,每平皿30条线虫,20 ℃恒温预培养24 h。将预先培养的线虫用M9缓冲液洗净后,转移至含200 μmol/L胡桃醌培养基上,5 h后记录线虫的死亡数,计算存活率。期间应避开产卵期,氧化应激会造成产卵期线虫的死亡[13]。
将线虫在不含或含不同浓度AMP的NGM培养基上预培养3 d,用M9缓冲液冲洗线虫后,置于含200 μmol/L胡桃醌的NGM培养基上,氧化应激反应5 h后收集线虫,提取蛋白匀浆。ROS含量和SOD,CAT,GSH-Px,MDA抗氧化指标检测方法同1.5.4,细胞凋亡检测同1.5.5。
1.7统计学分析
本研究数据统计均基于3次独立重复实验,采用GraphPad Prism制作生存曲线,Origin 2018进行绘图,SPSS进行单因素方差分析,Duncan多重比较法进行显著性差异分析, p<0.05,有显著性差异,p<0.01,有极显著性差异。
2结果与讨论
2.1正常生长条件下AMP对线虫寿命、生殖与运动能力的影响
寿命长短是衡量机体是否健康的重要标准,可反映毒物接触的长期影响[15]。与对照组相比,AMP组线虫平均寿命均有所提高(见图1 a))、生存曲线均向右移动(见图1 b)),表明低、中、高3种剂量浓度的AMP均可延长线虫寿命。其中25 mg/mL组线虫寿命延长效果最显著,为38.2%(p<0.01),而50 mg/mL和100 mg/mL 2组线虫寿命延长率分别为14.8%和5.4%。生殖功能的衰退与寿命衰老存在直接相关性[13],本实验根据线虫产卵数来检测其生殖能力(见图1 c)),对照组线虫产卵数为265.33±12.22,而AMP处理组产卵量均低于对照组,100 mg/mL组线虫产卵数最低,为215.33±11.06(p<0.05)。以上结果表明,AMP可能是通过降低线虫的生殖能力来延长寿命。研究发现,随着AMP浓度的升高,线虫寿命的延长率下降。同时AMP能够降低线虫的产卵量,当质量浓度为100 mg/mL时,产卵量显著低于空白对照组,这可能是由于高质量浓度的AMP对线虫产生了一定的毒性作用。即AMP可降低产卵量延长线虫寿命,与吕婷[16]研究的香水莲花根部水提取物可能通过降低生殖能力延长线虫寿命的结果一致。LÓPEZ-LLUCH[17]认为长寿与生殖力间的一种“利弊权衡”机制可以解释这一现象,即两者呈负相关,机体可通过降低繁殖能力来延长寿命。
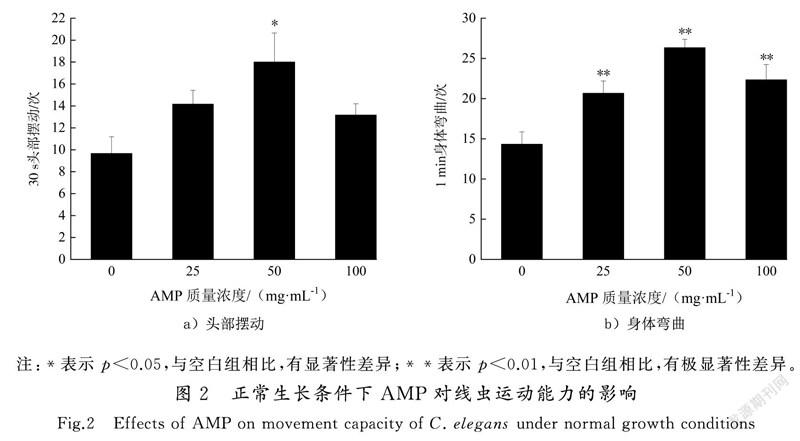
线虫的运动行为能力作为神经系统的基本功能指标,可反映其神经系统的功能和状态,并间接反映出线虫的寿命及生存状态[14,18]。本实验分别记录线虫在30 s内头部摆动次数和1 min内身体弯曲次数。如图2所示,与对照组相比,AMP组线虫头部摆动次数和身体弯曲次数均升高,其中50 mg/mL处理组较对照组头部摆动次数提高了83.74% (p<0.05),而25 mg/mL和100 mg/mL处理组与对照组无统计学差异(见图2 a))。25,50和100 mg/mL处理组身体弯曲依次为(20.67±1.52),(26.33±1.04)和(22.23±1.89)次(p<0.01),50 mg/mL處理组较对照组提高了86.14%(见图2 b))。由此可见,AMP可提高线虫的运动能力,尤其是50 mg/mL AMP处理组线虫身体弯曲次数和头部摆动次数最多,而100 mg/mL AMP处理组较其他处理组线虫身体弯曲次数和头部摆动次数有所下降,线虫通过降低运动频率,减少对有毒物质的吸收来保证基本生存能力。王晗等[18]发现壳寡糖在50~200 mg/L质量浓度范围内能提高线虫的吞咽和移动频率,但400 mg/L的壳寡糖可能存在一定的毒性,导致线虫的吞咽和移动频率降低,与本文研究结果一致。本研究通过寿命检测、生殖能力检测和运动能力检测发现,这可能是一种广泛存在的生物学效应-毒物兴奋效应,当处理因素或有毒物质在低水平和低剂量时可能会诱导生物体的应激抵抗机制,增强生物体的抵抗力和生存能力,反之高水平和高剂量处理会造成相反的双相剂量效应从而表现出一定的毒性[19]。因此,AMP对线虫寿命、生殖能力及运动能力均有不同程度的影响。
2.2正常生长条件下AMP对线虫抗氧化能力的影响
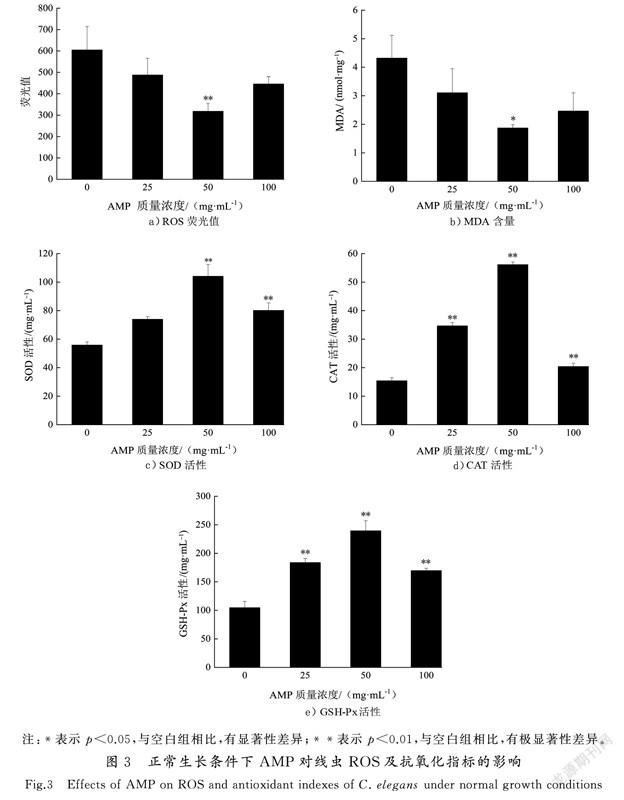
线虫寿命较短,只有20~30 d,药物作用3 d已经能够发挥作用,因此选择药物作用3 d时进行抗氧化指标检测。为探究AMP对线虫体内ROS含量的影响,本研究使用DCFH-DA荧光探针检测ROS含量水平,且荧光值与细胞内活性氧水平成正比。如图3 a)所示,线虫细胞的ROS积累量、AMP处理组ROS荧光值较对照组均有所下降,其中50 mg/mL处理组ROS荧光值最低,为318.15±36.25(p<0.01),比对照组降低了47.39%,25 mg/mL和100 mg/mL处理组与对照组无统计学差异,表明50 mg/mL AMP可显著抑制ROS的产生。研究显示,外界环境刺激、脂肪酸及线粒体均可产生过氧化氢、羟自由基和超氧阴离子等各种过氧化因子,从而触发过氧化反应,诱导细胞内物质发生过氧化及细胞凋亡[12]。多糖作为一种抗氧化剂,可捕捉脂质过氧化链式反应中产生的ROS,从而缩短脂质过氧化反应链的长度,阻断或减缓脂质过氧化直接清除ROS;而多糖环上的OH可与产生OH·所必需的Fe,Cu等金属离子络合,导致不能产生启动脂质过氧化的OH·等,间接抑制产生ROS[20]。
MDA是生物體内自由基攻击生物膜中的多不饱和脂肪酸,引发脂质过氧化而形成的脂质过氧化物,常用来评价机体的脂质过氧化程度及氧化损伤程度,MDA越多说明机体氧化损伤越严重[21]。如图3 b)所示,不同AMP处理组均可降低MDA含量,其中50 mg/mL处理组MDA含量为(1.87±0.11) nmol/mg(p<0.05),较对照组显著降低了56.67%,表明AMP可降低线虫体内脂质过氧损伤程度。SOD,CAT和GSH-Px是线虫体内重要的抗氧化防御系统酶,可提高机体氧化应激能力,减少氧化损伤。与对照组相比,AMP处理组SOD(图3 c)),CAT(见图3 d))和GSH-Px(见图3 e))活性均显著增强,其中50 mg/mL处理组SOD,CAT和GSH-Px 3种酶的活性分别提高了86.29%,264.32%和128.89%,具有极显著差异(p<0.01)。
有研究表明,多糖能刺激机体内抗氧化反应元件(ARE),提高内源性抗氧化物质的表达或抑制氧化酶的表达[22]。SOD作为第1道防线,可将超氧化物阴离子自由基转化为H2O2。CAT和GSH-Px将HO转化为水。SOD,CAT和GSH-Px等抗氧化酶及非酶抗氧化物质,如,抗坏血酸(维生素C)、α-生育酚(维生素E)和还原型谷胱甘肽(GSH)等对机体的氧化与抗氧化平衡起着至关重要的作用[23]。本研究表明AMP在正常生长条件下可增强线虫体内SOD,CAT和GSH-Px 3种抗氧化酶的活性,降低MDA含量的同时有效清除ROS,说明AMP能够增强线虫抗氧化防御能力,延缓衰老。这与张佳婵等[24]报道的沙棘粕醇提取物SBSE在正常生长条件下,可提高线虫体内SOD,CAT和GSH-Px 酶的活性的研究结果一致。
2.3正常生长条件下AMP对线虫细胞凋亡的影响
细胞凋亡是指为维持内环境稳定,生物体细胞在基因控制下的有序自主死亡,凋亡细胞因染色质固缩或断裂为大小不等的片段,形成凋亡小体[25]。细胞凋亡体系常被用于评估天然产物作为药品和食品生物活性物质的抗氧化性研究。吖啶橙可以与凋亡细胞的DNA相结合,在蓝色激发光下,凋亡细胞形成致密浓染的黄绿色荧光或黄绿色碎片颗粒。如图4所示,对照组黄绿色荧光强度最强,AMP组均比对照组荧光强度有所降低,其中50 mg/mL组荧光强度最低,表明50 mg/mL处理组抑制线虫细胞凋亡的保护作用最强(见图4 c)),与AMP提高线虫抗氧化酶活力、降低MDA和ROS水平的结果相互印证,同时与王力等[26]研究的牡蛎多肽能够降低线虫的细胞凋亡,从而延长线虫寿命的结果一致。细胞凋亡途径的异常调节与神经退行性疾病、自身免疫病和癌症等多种人类疾病有关。线虫的凋亡核心通路与哺乳动物及人类具有相当高的保守性。当体内积累过量ROS时会造成机体氧化损伤,诱导细胞凋亡,导致DNA分子中5-甲基胞嘧啶发生改变,造成DNA分子断裂[27]。
2.4氧化应激条件下AMP对线虫存活率、抗氧化能力的影响
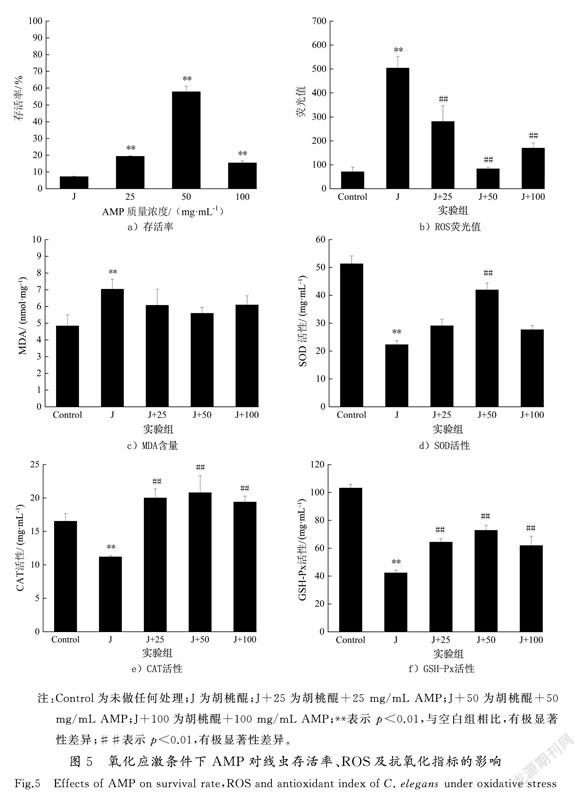
应激反应是指机体对外界或内部各种刺激所产生的非特异性应答,当生存环境变化对线虫产生危害时,可诱导线虫产生应激抵抗反应。本实验利用200 μmol/L胡桃醌(J)作为促氧化剂,探究氧化应激条件下AMP对线虫的影响。图5 a)显示,氧化应激5 h后对照组线虫存活率为(7.20±0.33)%,与对照组相比,AMP处理组存活率均显著升高,25,50和100 mg/mL处理组存活率分别为(19.36±0.31)%,(57.77±3.33)%,(15.45±1.19)%(p<0.01),其中50 mg/mL组线虫存活率最高,为胡桃醌处理组的8倍。
胡桃醌氧化应激条件下,胡桃醌组ROS水平为空白对照组的7倍(p<0.01)(见图5 b)),MDA含量较空白对照组提高了45.40%,为7.03±0.60 nmol/mg(p<0.01)(见图5 c))。而与胡桃醌组相比,AMP处理组MDA和ROS含量均显著下降,25,50和100 mg/mL组MDA含量分别降低了13.66%,20.50%和13.39%(p<0.01),ROS水平分别降低了44.16 %,83.50 %和66.29 %(p<0.01)。机体内抗氧化酶活性增强导致抗氧化能力增强,氧化损伤减少。如图5 d)—图5 f)所示,胡桃醌组SOD,CAT和GSH-Px 的酶活性相比空白对照组均呈现下降趋势,而经AMP处理后的线虫体内这3种酶的活性均呈现升高趋势,其中50 mg/mL升高效果最为显著,SOD,CAT和GSH-Px酶活性较胡桃醌组分别提高了88.21%,85.65%和72.10%(p<0.01)。以上结果表明,在氧化应激条件下,AMP可通过提高线虫体内抗氧化酶活力、降低ROS及MDA水平来增强线虫抗氧化损伤能力。
胡桃醌通过形成半醌自由基,将O2还原成超氧自由基,作用于细胞会产生大量ROS,引起氧化应激,机体自身抗氧化能力下降,未能清除过多的活性氧自由基,氧化能力远超出抗氧化清除能力,导致氧化与抗氧化能力失衡[13]。胡桃醌处理后SOD,CAT和GSH-Px活性顯著下降,MDA和ROS含量升高,线虫处于氧化胁迫。而经AMP处理的3种酶活性较胡桃醌组显著增强且MDA和ROS含量降低,AMP减弱了线虫氧化应激损伤,说明AMP对线虫有一定的保护作用。这与李玉英等[13]研究连翘花黄色素FFYP可降低氧化应激条件下线虫体内ROS含量,并提高体内SOD,CAT酶活性和GSH含量的结果一致。总之,不论是在正常生长条件下还是在胡桃醌氧化应激条件下,AMP可通过增强抗氧化酶活性,降低MDA含量,并且有效清除自由基,抵抗压力,延缓衰老。
2.5氧化应激条件下AMP对线虫细胞凋亡的影响
线虫的细胞凋亡是低水平外源性物质暴露的敏感指标[28]。如图6所示,与空白对照组相比,胡桃醌组黄绿色荧光强度明显增强,这是由于胡桃醌作为氧化剂会造成线虫体内产生大量ROS,诱导线虫氧化损伤,加剧了线虫体内细胞凋亡程度。AMP处理组线虫荧光强度与胡桃醌组相比均有不同程度的降低,说明AMP可抑制胡桃醌氧化损伤造成的线虫细胞凋亡。50 mg/mL AMP处理组线虫荧光强度降低最为显著(见图6 d)),这与氧化应激下50 mg/mL可提高线虫存活率、增强抗氧化能力结果一致。氧化应激条件下,胡桃醌组ROS含量升高,DNA断裂增加,荧光强度增强,经50 mg/mL AMP预处理的线虫荧光强度明显变暗,说明AMP可抑制胡桃醌诱导的线虫细胞凋亡。唐晓明[15]通过吖啶橙染色线虫实验表明香豆素能够降低秀丽隐杆线虫的细胞凋亡。而AMP在正常生长和氧化应激条件下通过提高线虫抗氧化能力,降低ROS水平,抑制线虫细胞凋亡,起到一定的保护作用以延长其寿命。
3结语
以秀丽隐杆线虫为模式生物,探究在正常生长条件下和胡桃醌氧化应激条件下,AMP的体内抗氧化作用。在正常生长条件下,AMP可降低生殖能力,提高运动能力,增强线虫体内SOD,CAT和GSH-Px酶活性,并降低MDA和ROS含量,以增强线虫抗氧化能力,延长寿命。在胡桃醌氧化应激条件下,AMP能够提高线虫存活率,增强SOD,CAT,GSH-Px酶活性,降低MDA和ROS含量,有效抵抗胡桃醌引起的氧化应激,对线虫具有一定的保护作用。综上所述,在正常生长和氧化应激条件下,AMP均可提高线虫体内抗氧化酶的活性,有效清除活性氧自由基,抑制细胞凋亡。因此AMP具有较好的抗氧化能力。研究结果为AMP在功能食品、保健食品和药品等领域的开发应用提供理论依据,同时也为抗氧化物质的选择提供了新的思路。
鉴于AMP对线虫的生理、生化指标的影响,今后还应对线虫抗氧化基因(daf-16,hsp-16.2,sod-3的表达及胰岛素/胰岛素样生长因子I信号转导通路(IIS)的调节进行更加深入的研究,揭示AMP的抗氧化机制。
参考文献/References:
[1]丁明孝,王喜忠,张传茂,等.细胞生物学[M].5版.北京:高等教育出版社,2020.
[2]吕振宇,孟姣,孙传鑫,等.枸杞对秀丽隐杆线虫寿命和产卵的影响及其抗氧化作用[J].食品科学,2019,40(5):183-188.LV Zhenyu,MENG Jiao,SUN Chuanxin,et al.Effect of Goji berries (Lycium barbarum) on lifespan and spawning of Caenorhabditis elegans and its antioxidant capacity[J].Food Science,2019,40(5):183-188.
[3]PANDEY S,TIWARI S,KUMAR A,et al.Antioxidant and anti-aging potential of Juniper berry (Juniperus communis L.) essential oil in Caenorhabditis elegans model system[J].Industrial Crops and Products,2018,120:113-122.
[4]AHMAD M M.Recent trends in chemical modification and antioxidant activities of plants-based polysaccharides:A review[J].Carbohydrate Polymer Technologies and Applications,2021,2:100045.DOI:org/10.1016/j.carpta.2021.100045.
[5]杜星芳,贾艳丽,仇燕.菜芙蓉多糖的表征与生物活性[J].精细化工,2020,37(6):1204-1211.DU Xingfang,JIA Yanli,QIU Yan.Characterization and bioactivity of polysaccharide from Abelmoschus manihot (L.) Medic[J].Fine Chemicals,2020,37(6):1204-1211.
[6]王雪,兰丽,原晶莹,等.3种海藻多糖抗氧化及其抗衰老活性的初步研究[J].药物生物技术,2020,27(1):29-32.WANG Xue,LAN Li,YUAN Jingying,et al.Preliminary studies on antioxidant and anti-aging activity of three seaweed polysaccharides[J].Chinese Journal of Pharmaceutical Biotechnology,2020,27(1):29-32.
[7]邵新月.葛根水溶性多糖的生物学效应及热应激下延长线虫寿命的机制研究[D].合肥:中国科学技术大学,2020.SHAO Xinyue.Biological Effects of Water-soluble Polysaccharide from Pueraria Lobata and the Mechanism of Extending C.Elegans Lifespan under Heat Stress[D].Hefei:University of Science and Technology of China,2020.
[8]周佳雯.衰老機制及其干预研究进展[J].医学研究生学报,2021,34(5):524-529.ZHOU Jiawen.Research progress on aging mechanism and its intervention[J].Journal of Medical Postgraduates,2021,34(5):524-529.
[9]蒙雨丹,吴诗惠,龚晓丽,等.衰老病理机制与川产道地药材黄连的抗衰老效应研究进展[J].世界中医药,2020,15(2):208-213.MENG Yudan,WU Shihui,GONG Xiaoli,et al.Pathogenesis of aging and research progress on anti-aging effects of Rhizoma coptidis from Sichuan Daodi herbs[J].World Chinese Medicine,2020,15(2):208-213.
[10]仇燕,李俊英,刘畅,等.菜芙蓉总黄酮纯化及其体内抗氧化性[J].河北科技大学学报,2016,37(6):587-593.QIU Yan,LI Junying,LIU Chang,et al.Purification of total flavonoids of Abelmoschus manihot(L.)medic and its antioxidant properties in vivo[J].Journal of Hebei University of Science and Technology,2016,37(6):587-593.
[11]ZHENG Xiao,LIU Zhihui,LI Shuang,et al.Identification and characterization of a cytotoxic [JP2]polysaccharide from the flower of Abelmoschus manihot[J].International Journal of Biological Macromolecules,2016,82:284-290.
[12]ZHANG Mohan,YANG Xin,XU Wan,et al.Evaluation of the effects of three sulfa sweeteners on the lifespan and intestinal fat deposition in C.elegans[J].Food Research International,2019,122:66-76.
[13]李玉英,张东丹,李娇,等.连翘花黄色素对秀丽隐杆线虫在氧化应激下的保护作用[J].中国生物化学与分子生物学报,2019,35(4):436-445.LI Yuying,ZHANG Dongdan,LI Jiao,et al.Yellow pigment from forsythia flower promotes resistance to oxidative stress in Caenorhabditis elegans[J].Chinese Journal of Biochemistry and Molecular Biology,2019,35(4):436-445.
[14]李祥,张泽生,汤新慧,等.紫薯提取物对秀丽隐杆线虫寿命的影响[J].现代食品科技,2017,33(10):1-6.
LI Xiang,ZHANG Zesheng,TANG Xinhui,et al.Effects of purple sweet potato extract on the lifespan of Caenorhabditis elegans[J].Modern Food Science & Technology,2017,33(10):1-6.
[15]唐晓明.香豆素对秀丽隐杆线虫抗氧化作用研究[D].长春:长春理工大学,2012.TANG Xiaoming.Study on the Antioxidation of Coumarin to Caenorhabditis Elegans[D].Changchun:Changchun University of Science and Technology,2012.
[16]吕婷.利用模式生物秀丽隐杆线虫对植物提取物抗衰老的研究[D].南京:南京师范大学,2014.
[17]LÓPEZ-LLUCH G.Mitochondrial activity and dynamics changes regarding metabolism in ageing and obesity[J].Mechanisms of Ageing and Development,2017,162:108-121.
[18]王晗,米生权,孙雅煊,等.壳寡糖对秀丽隐杆线虫寿命的影响[J].食品科学,2015,36(1):229-233.WANG Han,MI Shengquan,SUN Yaxuan,et al.Effect of chitooligosaccharides on lifespan of Caenorhabditis elegans[J].Food Science,2015,36(1):229-233.
[19]刘天天,靳洪涛,王爱平.毒物兴奋效应及其对毒理学和医药研究的影响[J].毒理学杂志,2016,30(1):78-83.
[20]赵芷芊,王敏,张志清.植物多糖的提取及抗氧化功效的研究进展[J].食品工业科技,2018,39(13):337-342.ZHAO Zhiqian,WANG Min,ZHANG Zhiqing.Research progress of antioxidation efficacy and extraction of plant polysaccharide[J].Science and Technology of Food Industry,2018,39(13):337-342.
[21]迟东泽,何源,刘芳芳,等.鹿鞭醇提物对秀丽隐杆线虫衰老的影响[J].食品工业科技,2021,42(10):327-335.CHI Dongze,HE Yuan,LIU Fangfang,et al.Effect of ethanol extracts of penis cervi on anti-aging in Caenorhabditis elegans[J].Science and Technology of Food Industry,2021,42(10):327-335.
[22]刘玉婷,李井雷.多糖体外抗氧化活性研究进展[J].食品研究与开发,2019,40(6):214-219.LIU Yuting,LI Jinglei.Advances in research on antioxidant activity of polysaccharides in vitro[J].Food Research and Development,2019,40(6):214-219.
[23]林春秀,林伊梓,沈少丹,等.苦瓜青钱柳复合茶对秀丽线虫的抗氧化作用[J].食品与发酵工业,2020,46(23):178-183.LIN Chunxiu,LIN Yizi,SHEN Shaodan,et al.Antioxidant effect of a compound Momordica charantia and Cyclocarya paliurus tea on Caenorhabditis elegans[J].Food and Fermentation Industries,2020,46(23):178-183.
[24]張佳婵,王昌涛,刘瑶,等.沙棘粕醇提取物对秀丽隐杆线虫的抗衰老功效及其机制[J].食品科学,2017,38(23):141-148.ZHANG Jiachan,WANG Changtao,LIU Yao,et al.Anti-aging effect and its mechanism of ethanol extract from sea buckthorn seed meal in Caenorhabditis elegans[J].Food Science,2017,38(23):141-148.
[25]许光敏.神经酰胺参与辐射诱导的线虫生殖腺细胞凋亡的机制研究[D].合肥:中国科学技术大学,2019.XU Guangmin.The Mechanism of Ceramide Mediated Radiation-induced Germ Cell Apoptosis in Caenorhabditis Elegans[D].Hefei:University of Science and Technology of China,2019.
[26]王力,肖嵋方,陈弘培,等.牡蛎多肽组分OE-Ⅰ抗氧化活性及其对秀丽隐杆线虫抗衰老作用[J].食品科学,2022,43(3):152-160.WANG Li,XIAO Meifang,CHEN Hongpei,et al.Antioxidant activity of oyster peptide fraction OE-Ⅰ and its anti-aging effect on Caenorhabditis elegans[J].Food Science,2022,43(3):152-160.
[27]黄润庭,李宗军,谭雅,等.湘西香醋对秀丽隐杆线虫体内抗氧化作用[J].食品科学,2016,37(7):208-212.HUANG Runting,LI Zongjun,TAN Ya,et al.In vivo antioxidant activity of Xiangxi vinegar:A study in Caenorhabditis elegans[J].Food Science,2016,37(7):208-212.
[28]YIN Jiechen,LIU Ran,JIAN Zihai,et al.Di (2-ethylhexyl) phthalate-induced reproductive toxicity involved in DNA damage-dependent oocyte apoptosis and oxidative stress in Caenorhabditis elegans[J].Ecotoxicology and Environmental Safety,2018,163:298-306.

