Cr(III)和Cr(VI)的表观遗传毒性分析
王琴,何云翔,龚贵东,杨斌,王楠,张曜耀,顾健*
(1. 西南民族大学药学院,四川 成都 610225;2. 四川大学轻工科学与工程学院,四川成都 610065;3.四川大学华西第二医院妇产科生殖医学中心,四川成都 610041)
1 引言
自然界中,铬广泛存在于土壤、空、水及动植物体内。1797 年,法国科学家在研究西伯利亚铁矿时首次发现铬元素的存在,由此拉开了铬广泛应用于工业生产的序幕。电镀行业中,铬电镀工艺简单及具有良好耐腐蚀性和硬度,往往在镀板的后续钝化处理中使用铬增加耐用性。在电催化领域,铬可作为催化剂载体提高电子转移速率和活性位点。钢铁制造中铬的加入常用于制作不锈钢、耐热钢,可提高制品的抗冲击能力和耐压强度。此外,制革工业是我国轻工业重要产业之一,铬鞣在制革过程中给予皮革优良的理化性能,比如柔软丰满性,极高的收缩温度,耐水洗和耐储存性等,且操作方法简便、过程易于控制,因而铬鞣剂在制革工业中占据着重要的地位。
铬具有多种氧化价态,主要以Cr(III)和Cr(VI)这2 种形式存在。由于自然界总体上是一个还原性的环境,Cr(VI)作为强氧化剂通常很不稳定易还原为Cr(III),因而Cr(III)是最稳定的存在形式。Cr(III)难以穿过细胞膜,但其作为人体必需的微量元素可参与调控体内糖、脂肪和蛋白质的代谢,并且在调控氧化应激及炎症细胞因子分泌等方面也发挥着保护机体健康的重要的作用[1-2]。与铅、镉和砷等重金属暴露可多系统性、多器官性的对机体造成损伤不同,Cr(III)对人体几乎没有毒性。目前,市场上多种Cr(III)配合物如吡啶甲酸铬(Chromium Picolinate,美国GNC),酵母铬(铬酵母片,汤臣倍键),铬素营养片(美国安利纽崔莱)等已用于糖尿病的辅助治疗。
与Cr(III)不同的是,Cr(VI)是已知的人类致癌物。人类流行病学研究表明,Cr(VI)可以诱发多种类型的癌症,包括肝癌、肾癌、前列腺癌、膀胱癌、皮肤癌、脑癌和胃癌等[3]。肿瘤的发生与发展是一个多基因和多因素综合作用的复杂过程,它的重要特征之一是基因表观遗传调控紊乱导致基因表达异常。表观遗传学的概念最早由生物学家Waddington 提出,即在没有细胞核DNA 序列改变的情况下,基因功能的可逆、可遗传的改变。主要的表观遗传修饰包括DNA 甲基化、组蛋白修饰、染色体重塑和非编码RNA 调控等,通过对基因转录和翻译过程的调控,影响基因功能[4]。在过去的数十年中,大量证据显示表观遗传修饰的失调,会造成细胞产生基因表达的多样性,在复杂的生物进程中使得原本正常细胞异常生长,最终导致疾病的发生[5]。近年来,基因的表观遗传学修饰和基因失活研究成为热点[6]。研究发现,环境中Cr(VI)暴露可对DNA 甲基化、组蛋白修饰、染色体重塑和非编码RNA 调控等表观遗传模式进行调控。本文从生理学和遗传学角度对Cr(III)与Cr(VI)在人体中不同的调控作用进行了探讨,对充分认识三价铬的生物学功能和六价铬的表观遗传毒性有重要的意义。
2 Cr 的理化性质
铬(Chromium),元素符号Cr,最初由法国科学家尼古拉斯·路易斯·沃克林于1797 年发现[7]。铬处于元素周期表第4 周期d 区VIB 族,原子序数为24,原子量为51.996,是一种蓝白色过渡金属元素。在自然界中,铬广泛存在于土壤、空气、水和动植物体内。铬的化合价从-2 价到+6 价,其中主要以三价铬[trivalent chromium, Cr(III)]和六价铬[hexavalent chromium, Cr(VI)]这2 种价态存在。Cr(III)通常以Cr3+、CrO2-形式存在,容易被吸附固定。Cr(VI)则以Cr2O72-和CrO42-形式存在,其活性较强,容易发生迁移。由于自然界总体上是一个还原性的环境,Cr(VI)作为强氧化剂通常很不稳定,容易被还原为Cr(III),因而我们通过饮用水、食物和空气等接触的铬一般以Cr(III)为主。
3 Cr(III)的生物学功能
Cr(III)作为人体的必需微量元素,具有较强的形成配位结合物的能力,在生物体内可以与有机或无机配位体结合进而发挥生理调控作用,其营养功能引起了大家的广泛关注。1980 年,美国国家研究委员会将Cr(III)认定为营养补充剂,并提出成年男性每日推荐剂量为35 μg,成年女性每日推荐剂量为25 μg。2013 年《中国居民膳食营养素参考摄入量》推荐Cr(III)的成人每日推荐摄入量为30 μg,并且未规定可耐受的最高摄入量。如表1 所示。

表1 中美居民膳食中铬的推荐摄入量Tab. 1 Recommended intake (RNI) of chromium in the diet of Chinese and American residents
3.1 Cr(III)的体内代谢
Cr(III)在人体内分布范围很广,但含量极低,其中脑部含量为43 ng/g,骨骼含量为101~324 ng/g,肾脏含量为3~11 ng/g,肝脏含量为5~71 ng/g[8]。1973年,CHEN 等最初揭示了Cr(III)的主要吸收部位在小肠,其中吸收能力最强的节段为空肠,其次为十二指肠和回肠[9]。Cr(III)难以大量通过细胞膜扩散,研究推测主要以吞噬作用和被动转运少量进入细胞。随着年龄的增加,人体对Cr(III)的吸收能力逐渐下降。Cr(III)进入血液循环后,能够与转铁蛋白相互作用,在与细胞膜上的转铁蛋白受体结合后,Cr(III)转运进入细胞内并释放[10-11]。血清中大部分Cr(III)可运送到肝脏和胰腺中,通过增强胰岛素在体内的作用参与控制血糖水平。同时Cr(III)也参与脂肪代谢,通过降低血液中胆固醇的含量预防动脉硬化和冠心病等心脑血管疾病[12]。体内的Cr(III)主要通过尿液排出体外,因而尿液中排出的Cr(III)可用于反映Cr(III)的代谢和消耗。此外,部分Cr(III)还可经汗液、胆汁、粪便和泌乳排出,毛发脱落也会损失微量的Cr(III)。铅、镉等其它重金属接触可损伤肾组织细胞,引起肾毒性,而Cr(III)在肾脏中不能被重吸收,因而其不会在体内积累,没有肾脏毒性。
3.2 Cr(III)的生理学功能
1955 年,科学家首次发现通过给糖尿病大鼠喂食啤酒酵母或者猪肾粉,可改善其糖耐量损伤。随后,SCHWARZ 等解析了啤酒酵母和猪肾粉中具有生物活性物质为葡萄糖耐量因子(glucose tolerance factor, GTF),其结构上主要含有Cr(III)、烟酸、谷氨酸、半胱氨酸和甘氨酸[13]。Cr(III)作为胰岛素的辅助因子可促使胰岛素A 链与细胞膜上胰岛素受体的硫氢基形成二硫键,促进胰岛素与受体结合,并通过激活酪氨酸激酶活性、抑制磷酸酶活性进而诱导胰岛素受体发生磷酸化,最终增强机体的胰岛素敏感性,达到维持机体内正常的葡萄糖耐量的目的。在高糖条件下培养的脂肪细胞中还发现,Cr (III)可以促进葡萄糖转运蛋白4(glucose transporter 4,GLUT4)从细胞内转位至细胞膜表面,进而提高细胞对葡萄糖的摄取,调控糖代谢[14]。此外研究发现,在糖尿病大鼠模型中,利用Cr(III)处理7 周后,大鼠体内炎性细胞因子TNF-α 和IL-6 表达水平均降低,并且氧化应激也得到缓解[15]。程南征等对24 名正常人和83 名II 型糖尿病患者进行血铬的测定,结果显示糖尿病患者的空腹血铬显著低于正常人,并且血铬含量与患者病情严重程度成反比[16]。因而,Cr(III) 可以提高二型糖尿病患者的胰岛素敏感性,改善其胰岛素耐受,并且具有减轻机体氧化应激的作用,可辅助疾病的治疗[17-18]。
Cr(III)在维持机体脂肪的正常代谢中也起着重要作用。研究发现,Cr (III) 处理脂肪细胞3T3-L1后,可使得细胞核内SREBP1 蛋白含量增加,减少细胞膜上的胆固醇含量[19]。在高脂饮食KK/H1J 小鼠模型中,Cr(III)的添加可下调小鼠体内甘油三酯和胆固醇含量,并减轻肝重,具有肝脏保护作用[20]。Cr(III)可能通过两个机制调节脂类代谢:一方面,Cr(III)可增强胰岛素活性,胰岛素有助于调节脂类代谢,从而改善血脂状况;另一方面,Cr(III)增加血浆卵磷脂胆固醇酰基转移酶和肝内皮细胞酶活性,从而促进高密度脂蛋白(HDL)生成。Cr(III)通过调节各种脂蛋白含量和胆固醇代谢,还可对体脂蓄积进行有益的调节和改善[21]。
此外,Cr(III)还能通过调控胰岛素的功能提高细胞对氨基酸的吸收能力,从而促进蛋白质的合成,提高肌肉质量[22]。随着对Cr(III)研究的不断深入,发现其在提高免疫力、改善胴体品质、缓解精神抑郁和提高家畜繁殖性能等方面均有很好的功效。
3.3 Cr(III)的安全性分析
Cr(III)在自然界中比较稳定,不易穿过生物膜,与铜、碘、锌、锰和硒等金属的毒性相比较低,而且各种动物对Cr(III)的耐受量较高,因此正常情况下畜禽日粮中添加少量的Cr(III),一般认为不会引起动物发生中毒现象。
Campbell 等在大鼠日粮中添加5%Cr2O3,持续饲喂800 d,没有发现引起毒性反应[23]。对健康大鼠每天喂吡啶酸铬15 mg/kg,持续5 个月,检测肝脏中Cr(III)含量大约750 μg/kg,肾脏中Cr(III)含量大约30 mg/kg,并未发现产生任何组织学和生化的毒性。Anders 等研究也证实,动物摄入吡啶甲酸铬超过20周可引起Cr(III)在肝、肾的少量蓄积,但并未观察到任何有害效应[24]。生殖毒性方面,饲料中添加2 mg/kg 和20 mg/kg 剂量吡啶酸铬对母鼠的生殖机能和胎鼠的生长发育均无明显影响,并且对胎鼠不产生致畸作用,只有200 mg/kg 高剂量吡啶酸铬才会对胎鼠骨骼发育有一定影响。因而,在给机体补充Cr(III)时,合理剂量是需要考虑的重要因素。
然而,LIU 等研究发现长期添加超过2500 mg/kg 的高剂量Cr(III)会破坏机体对Cr(III)的调节能力和贮存能力,使得血液中Cr(III)含量高于正常值,进而干扰其他微量元素的吸收[25]。ZHIJIA 等研究发现高剂量铬可能通过静电作用干扰DNA 碱基对的堆积,致使DNA 发生损伤[26]。以上数据表明,Cr(III) 只有在摄取量极高的情况下才会危害机体健康,通过控制合理剂量,Cr(III)对机体是没有毒性的。曾经,人们对制革过程中Cr 的使用缺乏科学的认识,并由此产生了错误的理解。实则皮革加工过程中使用的是Cr(III),并且在含铬皮革碎渣中的Cr也是Cr (III),固定在胶原纤维中的Cr (III) 只有50~500 mg/kg 可被萃取出来。制革过程中Cr(III)的合理使用不会对人体健康造成威胁。
4 Cr(VI)的毒性
Cr(III)是人体的必需微量元素,然而Cr(VI)却被世界卫生组织国际癌症研究机构归类为I 级致癌物。Cr(VI)暴露可导致机体炎症的发生,严重甚至出现多器官功能衰竭。在职业暴露的工人中,Cr(VI)主要通过吸入和皮肤接触进入人体。在非职业暴露的人群中,Cr(VI)进入人体的主要方式为食用暴露于铬污染的蔬菜、水果、粮食和肉类,铬通过食物链的传递最终在人体内肝脏、肾脏和生殖系统蓄积[27-28]。Cr(VI)半衰期长且排泄率低,当其浓度在人体内超过5 mg/L 时,新陈代谢将会受到影响,随着铬摄入的增多,最终产生严重的消化系统、生殖系统和循环系统毒性[29-30]。
与Cr(III)相比,Cr(VI)极易通过细胞膜,其吸收率是Cr(III)的3~5 倍。Cr(VI)主要以非特异性的硫酸盐和磷酸盐阴离子转运体形式进入细胞膜,随后Cr(VI)与DNA 及谷胱甘肽GSH、抗坏血酸Asc、半胱氨酸 Cys 和组氨酸 His 等配体结合产生GSH-Cr-DNA、Asc-Cr-DNA、Cys-Cr-DNA 和His-Cr-DNA 耦合物,最终将Cr(VI)还原为Cr(III),在此过程中诱导机体氧化应激,并通过调控DNA 甲基化、组蛋白修饰、染色体重塑和非编码RNA 调控等表观遗传模式发挥细胞毒性,甚至导致肿瘤的发生,如图1 所示[31-34]。

图1 细胞内Cr(VI)还原过程Fig.1 Schematic representation of intracellular Cr (VI) reduction
4.1 Cr(VI)与DNA 甲基化的关系
DNA 甲基化主要指在甲基转移酶(DNA methyl-transferases,DNMTs)的催化下,DNA 中胞嘧啶-磷酸-鸟嘌呤(CpG)的胞嘧啶被选择性添加甲基,形成5-甲基胞嘧啶(5mC)的过程[35]。哺乳动物中,当基因转录调控区域的CpG 岛发生5mC 修饰时,可招募序列特异性甲基化结合蛋白(MeCP)与甲基化的CpG 岛结合,通过级联控制,最终抑制基因的表达[36-37]。
2002 年,首次报道Cr(VI)暴露可引起哺乳动物细胞系G12 中DNA 甲基化水平改变,抑制报告基因GPT 的表达[38]。WANG 等研究发现,环境中的Cr(VI)暴露可直接调控全基因组的甲基化水平,对实验组SD 大鼠的饮水加入重铬酸钾,结果显示实验组大鼠体内谷胱甘肽过氧化物酶表达下调,并且全基因组DNA 呈现低甲基化修饰[39]。TSUBOI 等研究发现,Cr (VI) 暴露也可导致细胞中错配修复基因MLH1 的启动子区域出现高甲基化,从而沉默该基因的表达,最终可导致肺癌的发生[40]。Cr(VI)也可通过诱导启动子区域高甲基化沉默抑癌基因P16(INK4a)的表达[41]。此外,日本曾对处于铬暴露患有肺癌的工人进行检测发现DNA 修复基因HOGG1、MGMT 和RAD53 启动子区域的甲基化均上调[42]。Cr(VI)上调基因启动子区域的甲基化可使组蛋白去乙酰化并且染色体处于紧缩状态,接着阻碍转录因子与顺式作用元件的结合,使DNA 组装成核小体后不能启动转录,从而下调相关编码基因的表达,如图2 所示。除了Cr(VI)直接参与基因的表达调控外,研究还发现Cr(VI)进入人体细胞后被快速还原为Cr(III),在双氧水存在下,通过芬顿反应可释放大量的羟基自由基等活性氧(reactive oxygen species, ROS),ROS 可催化5mC 氧化转化为5- 羟甲基胞嘧啶(5-hmC),并且调节DNMT 与DNA 序列的结合,从而改变基因甲基化模式[43-45]。

图2 Cr(VI)对DNA 甲基化的调控Fig.2 Regulation of DNA methylation by Cr (VI)
4.2 Cr(VI)与组蛋白修饰的关系
组蛋白修饰是表观遗传的重要组成部分。真核生物中,核小体由DNA 和组蛋白H1、H2A、H2B、H3 和H4 构成。组蛋白的N-末端常发生翻译后修饰,目前已知的组蛋白修饰包括:乙酰化、甲基化、泛素化、磷酸化、糖基化和ADP 核糖基化等,其中组蛋白的乙酰化修饰是当前表观遗传学研究的热点领域[46-47]。组蛋白乙酰化是由两个酶家族调节的动态过程:组蛋白乙酰基转移酶(histone acetyltransferase,HATs)和组蛋白脱乙酰酶(histone deacetylases,HDACs)[48]。以乙酰辅酶A 为辅因子,HATs 催化乙酰辅酶A 的乙酰基转移至核心组蛋白氨基末端特定赖氨酸残基上,引起染色体解聚,从而激活基因转录。
环境中的Cr(VI)暴露可通过调控染色体组蛋白的乙酰化修饰程度影响基因的表达。XIA 等使用Cr(VI) 处理人类支气管上皮细胞16-HBE 后,细胞中HDAC1、HDAC2 和HDAC3 表达水平均显著升高[49]。HDACs 的上调可导致组蛋白H3K18、H3K27 乙酰化(H3K18/27ac)水平下降,在癌蛋白SET 的参与下Cr(VI)抑制H3K18/27ac/53BP1 级联过程并促进恶性细胞转化[50]。CHEN 等使用铬酸钾(K2CrO4)处理人类支气管上皮细胞BEAS-2B,Cr(VI)通过下调组蛋白H4K16 乙酰化水平,诱导癌基因NUPR1 高表达,NUPR1 则进一步下调乙酰转移酶MOF 使得H4K16乙酰化水平更低,这一恶性循环加速肺癌的发生、发展[51]。这提示着在职业暴露的制革工人中,Cr(VI)可能通过呼吸系统进入人体从而诱发肺癌。
4.3 Cr(VI)与染色体重塑的关系
作为表观遗传调控的重要方式,染色质重塑主要指在DNA 转录过程中,染色质重塑复合物通过水解ATP 提供能量使核小体相位发生调整,组蛋白末端碱性氨基酸残基所带正电荷降低,导致核小体与DNA 结合力减弱,最终促使染色质由致密的超螺旋结构变为疏松结构从而影响基因的表达。此外,组蛋白修饰和DNA 甲基化也可对染色质重塑起调控作用[52]。
ANDREW 等发现Cr(VI)通过调整核小体的相位可靶向性破坏转录因子CTCF 和激活蛋白AP-1的结合,进一步对AP-1 下游信号通路内相关基因的转录进行调控[53]。通过对不同浓度Cr(VI)暴露下的小鼠肝癌细胞HEPA-1C1C7 进行检测,也发现转录因子BACH2、CTCF 结合位点处靶基因染色质结构域开放程度与Cr(VI)浓度存在密切联系,靶区基因表达水平随Cr(VI)浓度的变化而变化[54]。此外,在Cr(VI)处理人类支气管上皮细胞BEAS-2B 的实验中,NUPR1 下调乙酰转移酶MOF 影响组蛋白H4K16 乙酰化水平的同时,NUPR1 自身发生的染色质重塑也是Cr(VI)诱导肺癌发生的主要机制[51]。
4.4 Cr(VI)与非编码RNA 调控的关系
人类基因组中,具有编码蛋白质能力的基因占比不到2%,剩下约98%的基因转录为非编码RNA(Non-coding RNA,ncRNA)并在RNA 水平上发挥生物作用。ncRNA 主要包括长链非编码RNA (long noncoding RNA, lncRNA)、微小RNA (microRNA,miRNA)、环状RNA(circular RNA, circRNA)及小干扰RNA(small interfering RNA,siRNA)等[55]。
MicroRNA-21(miR-21)是肿瘤发生过程的关键调控因子。研究表明,Cr(VI)处理人支气管上皮细胞BEAS-2B 后,可诱导miR-21 表达显著增加,miR-21 靶向下调抑癌基因PDCD4 的表达,发挥致癌活性。在BEAS-2B 细胞中稳定敲低miR-21 或过表达PDCD4 可显著抑制Cr(VI)诱导的癌变进程[56]。此外,慢性Cr(VI)暴露也可通过下调MicroRNA-494(miR-494)水平,增加原癌基因c-Myc 表达,促进Cr(VI)诱导的肿瘤干细胞样转化和肿瘤发生[57]。HE 等研究发现Cr (VI) 可通过下调MicroRNA-143(miR-143) 增加胰岛素样生长因子1 受体(IGF-1R)和胰岛素受体底物1 (IRS1) 的表达,进而激活ERK/HIF-1α/NF-κB 信号通路促进细胞异常增殖,导致肿瘤的发生,如图3 所示[58]。以上揭示了miRNA 在Cr(VI)发挥致癌活性中起着重要作用。
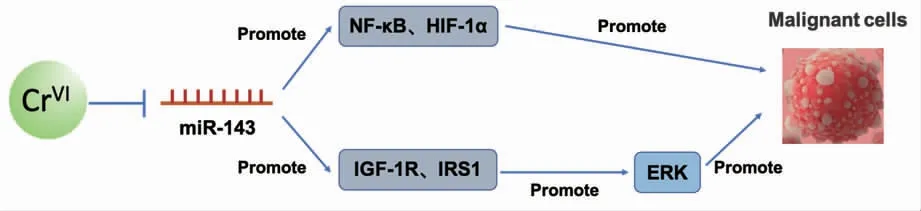
图3 Cr(VI)诱导的miR-143 相关信号通路Fig.3 Cr(VI)-induced miR-143 related cell signaling pathway
此外,研究发现10.00 μmol/L Cr(VI)处理人支气管上皮细胞16HBE 后,1868 个lncRNA 显著上调,2203 个lncRNA 显著下调,形成复杂的调控网络与免疫应答、细胞周期、DNA 损伤和修复等密切相关[59]。最新的研究对暴露于不同Cr(VI)浓度(0.2、0.6 和1.8 μmol/L)24 h 的BEAS-2B 细胞进行全基因 组 测 序, 结 果 显 示 lnc-NCS1-2 ∶1 和lnc-FOXK1-4∶1 均呈现显著性差异,揭示了Cr(VI)暴露通过调控非编码RNA 的表达对细胞周期进行干预的机制[60]。
5 结论
Cr(III)是一种机体不可缺少的微量元素,过量摄入Cr(III)可能对健康造成威胁,但在限量标准内的Cr(III)摄入不仅可作为胰岛素作用的辅助因子在糖、脂类、蛋白质、核酸代谢等过程中起重要作用,并且在减少应激、提高免疫力、改善胴体品质和提高繁殖性能等方面均有很好的功效。值得注意的是,Cr(VI)则是一种致癌物,可在分子水平上通过干扰DNA 甲基化、组蛋白修饰、染色体重塑和非编码RNA 调控等表观遗传修饰改变基因的转录和翻译,影响基因功能,严重威胁人类健康。在实验室环境下,Cr(III)和Cr(VI)的相互转化是非常容易实现的,应当正视Cr(VI)的接触风险,合理选择生产路线和储存条件,减少Cr(VI)的产生。不过由于Cr(VI)具有强氧化能力,即使少量的Cr(VI)释放入自然环境中,也将立即和环境中的许多有机组分进行氧化反应而转化为安全的Cr(III)。

