方格星虫三肽对黑色素瘤A375 细胞的增殖抑制作用
戚 怡,陈起周王艺瑾,叶子秋,吴科锋,叶 华,罗 辉,欧阳茜茜*
(1.广东医科大学海洋医药研究院,广东湛江 524000;2.南方海洋科学与工程广东省实验室(湛江),广东湛江 524000;3.广东湛江海洋医药研究院,广东湛江 524000)
恶性黑色素瘤是一种源于皮肤黑素细胞的高转移、快侵袭、高死亡率的恶性肿瘤[1-3],发病机制尚不明确,手术、化疗、放疗等传统治疗方法存在患者耐受性差、预后差等问题[4-5]。目前靶向治疗和免疫治疗已在临床中取得一定进展,提高了恶性黑色素瘤患者的生存率,突破了传统治疗局限[6-7],但这些治疗方法依然存在患者耐药性、治疗无普遍性、药物不良反应大等问题[8-9]。因此,寻找低毒、高效的抗肿瘤药物或辅助抗肿瘤药物是恶性黑色素瘤治疗的研究方向之一。水产品生存环境极端,其蛋白质组成独特,水解产生的生物活性肽具有特殊氨基酸[10],具有神经保护、镇痛、抗病毒等生物活性[11]。目前对鱼虾类生物活性肽的研究较多,水生软体动物源的生物活性肽尚未被广泛研究。方格星虫(Sipunculus nudus)俗称沙虫或海肠子,除极地水域外,分布于全球各地;在我国,主要生长于广东、广西、海南及福建地区[12],它被沿海居民称为“海洋冬虫夏草”,具有滋阴降火、清肺补虚、活血强身的功效,滋补五脏,在食用和药用方面均有广阔的应用前景[13]。方格星虫中可提取出大量营养物质及天然活性产物,如游离氨基酸、脂肪酸、多糖、矿物元素、甾醇类、核苷类和酶类等[14-15]。方格星虫三肽是从方格星虫多肽中分离出的可人工合成的具有活性的低聚肽,本研究发现其对黑色素瘤细胞A375 具有一定的抑制作用,可为后续抗癌辅助药物的研究奠定基础。
1 材料和方法
1.1 实验材料
方格星虫三肽(实验室合成,纯度为99%),分子量为358.59 Da,氨基酸序列为丝氨酸-精氨酸-脯氨酸(SRP);人黑色素瘤细胞A375 细胞株;人永生化角质细胞HaCaT 细胞株;青霉素-链霉素混液、胰蛋白酶、二甲基亚砜DMSO(索莱宝公司);胎牛血清(美国Gibco 公司);高糖DMEM 培养基(Hyclone 公司);CCK-8(碧云天公司);活性氧(ROS)试剂盒、乳酸脱氢酶(LDH)试剂盒(索莱宝公司)。
1.2 方法
1.2.1 细胞培养 配制含10 %胎牛血清、1 %青霉素-链霉素混液的DMEM 培养基,在5 %CO2、37 ℃培养箱中进行人黑色素瘤细胞A375 细胞株的培养,待细胞处于对数生长期,取细胞进行实验。在实验过程中,空白组(方格星虫三肽浓度为0 g/L)细胞加入不添加胎牛血清的DMEM 培养基,实验组分别添加1、1.25、1.5、1.75、2 g/L 方格星虫三肽溶解于无血清DMEM 培养基。
1.2.2 CCK-8 法检测A375 细胞活力 制备细胞悬液,将A375 细胞、HaCaT 细胞以5 000 个/孔的接种密度分别接种于96 孔板。设置空白组,每组设置6 个重复。将 96 孔平底板置于 5% CO2、37 ℃培养箱中,待细胞贴壁12 h 后各实验组分别加入药物培养24 h,弃含有药物的培养基,加入CCK-8 继续培养3 h。采用酶标仪在 490 nm 波长检测各组吸光度(A)值,计算细胞活率,实验重复3 次。细胞活率(%)=(A1/A0)×100%,其中A1 代表实验组吸光度值,A0 代表空白组吸光度值。
1.2.3 transwell 细胞迁移实验 将小室放入24 孔板,并在小室上层加入300 μL 混有1×105 个细胞的无血清培养基(加药),放入培养箱孵育4~6 h,在小室下层加入750 μL 10 %FBS 培养基,放入培养箱继续孵育24 h。弃小室上层培养基,PBS 洗2 次,3.7 %多聚甲醛室温固定细胞15 min,弃多聚甲醛,PBS 清洗2 次,结晶紫避光染色15 min,洗去结晶紫,棉棒擦去小室上层未迁移的细胞,显微镜下拍照,随机选取3~5 个视野计数。实验重复3 次。
1.2.4 细胞克隆形成实验 取对数生长期的A375 细胞,制成细胞悬液并梯度稀释至300 个/孔,加入6 孔板吹打分散培养,贴壁后加入药物培养基处理24 h,弃去药物培养基后继续加入有血清培养基,待培养至群落肉眼可见,整个过程2~3 周。弃上清液,PBS 浸洗2次,4%多聚甲醛固定细胞15 min,弃固定液,加入稀释为0.1 %的结晶紫染色60 min,PBS 冲洗,风干,计数拍照后用10%的冰乙酸溶解,492 nm 测定吸光值,实验重复3 次。
1.2.5 ROS 检测 A375 细胞分组处理后,弃药物,加入含10 μmol/L DCFH-DA 的无血清培养基孵育20 min,用无血清培养基洗涤细胞3 次,多功能微孔板检测系统(BIOTEL CYTATION5)拍照并检测荧光强度。
1.2.6 LDH 检测 A375 细胞分组处理后,收集细胞,按照ELISA 检测试剂盒说明进行操作,检测LDH活性。
1.3 统计学处理
使用Graph-pad prism5.0 及image J 软件分析数据和图像处理,计量资料采用单因素方差分析及q 检验,以P<0.05 表示差异有统计学意义。
2 结果
2.1 方格星虫三肽对A375 细胞的毒性实验
使用CCK-8 法检测方格星虫三肽对A375 细胞的毒性影响,发现所设5 个浓度均对A375 细胞有明显的抑制作用(P<0.01),且与空白组相比,随着浓度的升高A375 细胞活率降低,IC50 值为1.955 g/L 。见图1。

图1 方格星虫三肽对人黑色素瘤细胞A375 的细胞毒性实验
2.2 方格星虫三肽对正常细胞的毒性实验
与空白组相比,方格星虫三肽在浓度为1 g/L 时有较明显的促角质细胞生长的作用(P<0.05);1.25、1.5 g/L 时,对细胞无明显影响;2 g/L 时有明显的抑制作用(P<0.01)。IC50 值为2.611 g/L。见图2。
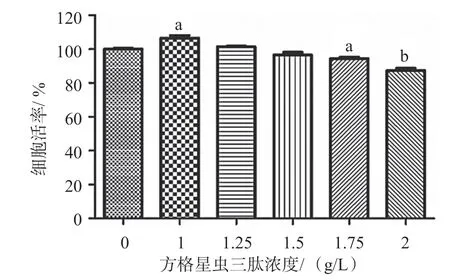
图2 方格星虫三肽对人角质层细胞HaCaT 的细胞毒性实验
2.3 克隆形成实验
不同浓度的方格星虫三肽(1、1.25、1.5、1.75、2 g/L)处理细胞后,其克隆形成能力受到抑制,当给药浓度为2 g/L 时,与空白组比较差异有统计学意义(P<0.01),说明2 g/L 方格星虫三肽可有效抑制A375细胞的增殖。见图3。
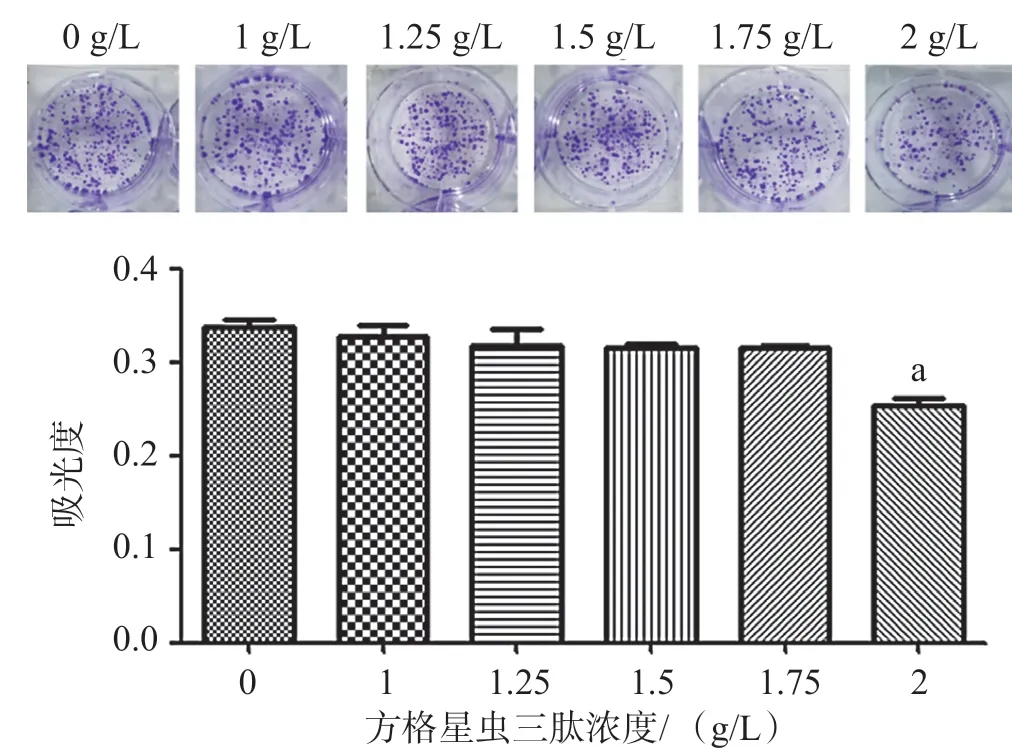
图3 方格星虫三肽对人黑色素瘤细胞A375 的克隆形成实验
2.4 方格星虫三肽对A375 细胞的迁移影响
细胞迁移实验结果发现,方格星虫三肽处理24 h后与空白组相比,不同浓度的方格星虫三肽均有抑制黑色素瘤细胞迁移的作用,且其迁移能力随着方格星虫三肽的浓度升高而降低,其中1.5、1.75、2 g/L 方格星虫三肽处理后细胞迁移水平与空白组相比显著减少(P<0.05)。见图4。

图4 方格星虫三肽对人黑色素瘤细胞A375 的细胞迁移实验
2.5 ROS 检测
不同浓度的方格星虫三肽处理A375 黑色素瘤细胞后可发现,1、1.25、1.5、1.75 g/L 的药物可使黑色素瘤细胞内ROS 含量明显增加(P<0.05 或0.01),表明方格星虫三肽抑制A375 黑色素瘤细胞增殖的作用与细胞内ROS 水平有关。见图5。

图5 方格星虫三肽对人黑色素瘤细胞A375 ROS 的影响
2.6 LDH 检测
不同浓度的方格星虫三肽处理A375 黑色素瘤细胞后,LDH 的变化趋势均减少,与空白组相比LDH 酶活性明显降低(P<0.01)。见图6。

图6 方格星虫三肽对人黑色素瘤细胞A375 的LDH 影响
3 讨论
本研究通过细胞增殖实验、克隆形成实验说明经方格星虫分离、酶解、人工合成的方格星虫三肽能在一定浓度内抑制恶性黑色素瘤细胞A375 的增殖;同时,通过对人永生化角质细胞HaCaT 进行细胞增殖实验发现方格星虫三肽不会对正常细胞产生毒性作用,说明该食物源生物活性肽比常规抗癌药物具有更高的安全性。transwell 细胞迁移实验考察方格星虫三肽处理后恶性黑色素瘤细胞A375 的细胞迁移情况,结果显示,经过一定浓度的(1.5、2 g/L)方格星虫三肽处理后,肿瘤细胞的迁移数明显减少,表明方格星虫三肽可在一定浓度下抑制恶性黑色素瘤细胞A375 的迁移能力,进一步减少其增殖。本研究对方格星虫三肽处理后恶性黑色素瘤细胞A375 的ROS 变化及LDH 进行检测,结果显示当方格星虫三肽药物浓度较高时,ROS 含量与空白组比较明显升高,与之前的CCK-8 结果相对应,这是由于肿瘤细胞的快速生长使得肿瘤内部处于缺氧环境[16-18]。在低到中等水平上,ROS 可通过诱导DNA突变和基因组不稳定性来作为加速肿瘤细胞增殖、生存和转移的信号分子促进肿瘤的发展[19-20];另一方面,肿瘤细胞中ROS 的增加可以诱导肿瘤细胞自噬、凋亡等,从而抑制其增殖及逆转耐药[21]。本研究中,不同浓度的方格星虫三肽作用于恶性黑色素瘤细胞后,抑制了肿瘤细胞的生长速度,从而使ROS 在给药细胞中的表达高于空白组;但是可能由于方格星虫三肽药物浓度过高,A375 细胞受渗透压影响,当药物浓度高达2 g/L 时,药物对给药肿瘤细胞的ROS 表达影响不明显。同时,肿瘤细胞的特点之一是其能量代谢发生改变,对于恶性肿瘤细胞来说,在日常代谢中更倾向于通过糖酵解获取能量[22],从而满足肿瘤细胞快速增长繁殖的需求。其在代谢中产生的代谢产物乳酸又有利于肿瘤生长微环境的形成,进而促进肿瘤细胞的进展和远处转移。LDH 作为参与肿瘤细胞代谢的一种酶,被发现与多种肿瘤的发生、发展及预后密切相关[23]。本研究中使用不同浓度的方格星虫三肽处理恶性黑色素瘤细胞后,肿瘤细胞的增殖受到抑制,经过进一步检测LDH 发现,不同浓度的方格星虫三肽抑制了肿瘤细胞LDH 的释放。
综上所述,方格星虫三肽体外抗肿瘤活性较好,其抑制A375 细胞增殖的作用机制可能与抑制肿瘤细胞的能量代谢有关。方格星虫三肽可作为一种辅助的抗肿瘤药物继续深入研究。

