基于肠道菌群的2型糖尿病发病机制及防治策略
罗艺,汪菲,曾强
中国人民解放军总医院第二医学中心健康医学科,国家老年疾病临床研究中心,北京 100853
糖尿病(DM)属于慢性代谢性疾病,按其发病机制分为1型糖尿病(T1DM)和2型糖尿病(T2DM)。T1DM继发于自身免疫介导的β细胞功能丧失,占糖尿病患者的5%;T2DM主要是由于胰岛素抵抗,见于95%的糖尿病患者[1]。2019年版国际糖尿病联合会(IDF)糖尿病地图提示糖尿病患病人数逐年增加,在2045年全球将达到7亿人,其中65岁及以上人群占总患病人数的20%[2]。在近十年来,肠道菌群的作用引起学术界广泛关注。肠道菌群可以通过不同的潜在机制影响代谢紊乱,包括调节炎症、肠道通透性、葡萄糖代谢、能量消耗、脂肪酸氧化和合成[3]。几项系统评价和荟萃分析,评估了通过影响肠道菌群治疗T2DM的各种方法的有效性[4-6]。了解肠道菌群和糖尿病的相互作用,将为探讨糖尿病新的治疗方法提供依据。本文重点探讨肠道菌群对T2DM发病机制的影响,及基于肠道菌群干预的治疗措施。
1 肠道菌群与T2DM关系
约80%以上的T2DM患者超重,这被认为是T2DM的最大危险因素[7]。美国国立卫生研究院在2007年开展了“人类微生物组计划”[8],人们对于肠道菌群的认识逐渐提高。研究表明,肠道微生物在T2DM的发生、发展过程中起着重要作用[9]。
一项针对345名中国人肠道微生物群的全基因组关联研究表明,T2DM患者存在中度的肠道菌群失调[10],有23个肠道菌群标记物发生变化,尤其是产丁酸细菌在T2DM患者肠道中占比有所减低。回顾性分析42项肠道菌群与T2DM关系的研究[11]发现,一些细菌属与T2DM发病存在一定的关联性。与T2DM呈负相关的菌群有双歧杆菌属、拟杆菌属、粪杆菌属、艾克曼菌属(Akk),与T2DM呈正相关的有鲁米诺球菌、蓝藻属等。并且在不同的地域当中,均发现了2型糖尿病患者的肠道菌群发生了显著变化,提示通过调节肠道菌群可改变T2DM防治策略。
2 肠道菌群在T2DM发病机制中的作用
肠道菌群的代谢物通过不同的信号通路影响各种疾病的进展(图1)。大量研究证明,短链脂肪酸(SCFAs)、胆汁酸(BA)、支链氨基酸(BCAAs)、丙酸咪唑(ImP)和脂多糖(LPS)是T2DM病程中的重要调节因子。

图1 肠道微生物群和2型糖尿病之间的关系
2.1 SCFAs SCFAs是肠道细菌分解各类膳食纤维产生的代谢物,包括乙酸盐、丙酸和丁酸盐等[12]。SCFAs通过影响胰岛素敏感性和葡萄糖代谢,对糖尿病的病理过程产生影响;核心机制包括:(1)SCFAs可作为能量调节信号分子刺激肠道激素分泌,直接结合肠L细胞表面的游离脂肪酸受体(FFAR2或FFAR3),刺激结肠L细胞分泌肠肽YY(PYY)和胰高血糖素样肽-1(GLP-1)。它们负责延缓胃排空,降低食欲,促进胰岛素分泌和减少胰高血糖素分泌[13-14]。(2)能量供应,SCFAs占正常结肠总能耗的5%~10%,尤其是丁酸盐[15]。(3)增加肠道糖异生,通过环磷酸腺苷(cAMP)依赖机制帮助丁酸盐增加肠道糖异生基因表达。(4)维持肠道屏障的完整性,T2DM患者的肠道屏障被促炎成分破坏;丁酸盐通过增加由转录因子特异性蛋白1(SP1)与紧密连接蛋白-1(Claudin-1)启动子区域中的特异性修饰之间的相互作用介导Claudin-1表达来增强肠道屏障的完整性,导致紧密连接蛋白ZO-1在细胞膜上的重新分布[16];在膳食纤维不足的情况下,宿主分泌的黏液糖蛋白可以被肠道菌群作为营养来源,并降解结肠粘液屏障[17]。(5)增强免疫力,T2DM患者与慢性炎症有关[18],患者的部分临床症状可以通过抑制炎症来缓解。丙酸盐可以改变小鼠骨髓的造血功能,增加巨噬细胞和树突状细胞的产生[19];丁酸盐通过促进调节性T细胞的产生、减轻炎症反应,具有抗炎作用[20]。
2.2 BA 肝脏合成初级胆汁酸并分泌至肠道,由肠道微生物群转化为次级胆汁酸,次级胆汁酸除通过作用于法尼溪酰X受体(FXR)调节体内葡萄糖代谢外,还可以激活硫醇鸟苷受体-5(TGR-5),促进肌肉能量消耗和肠L细胞分泌GLP-1,改善胰岛素抵抗和异常葡萄糖代谢[21]。肠道微生物群介导的异常胆汁酸代谢会影响胆汁酸在葡萄糖代谢调节中的作用[22]。研究表明,胆汁酸刺激肠嗜铬细胞释放5-羟色胺,导致胰岛素分泌减少和胰高血糖素分泌增强[23]。
2.3 LPS 血清LPS主要由革兰氏阴性菌产生,它增加了肠壁毛细血管通透性,并导致外周循环中的LPS升高。LPS在CD14的帮助下识别血清Toll样受体4(TLR4),导致巨噬细胞聚集和核因子κB炎症信号通路激活,炎症因子升高,发生胰岛素受体底物的异常磷酸化和胰岛素抵抗[24]。LPS引起β细胞受损,抑制胰岛素分泌,胰腺和十二指肠中PDX1基因表达下调[25]。炎症或者肠黏膜屏障受损、肠道菌群紊乱导致革兰阴性菌比例增加、肠道菌群移位,LPS释放入血进而促进胰岛素抵抗的发展[26-27]。
2.4 BCAAs BCAAs是人体必需的氨基酸,主要包括亮氨酸、异亮氨酸和缬氨酸,只能从饮食中获得,主要由肠道微生物群代谢产生[28]。血支链氨基酸水平升高是T2DM的危险因素[29]。饮食中支链氨基酸的摄入量增加会促进T2DM和胰岛素抵抗的发展[30]。支链氨基酸诱导的胰岛素抵抗机制与雷帕霉素靶蛋白复合物(mTORC)信号通路密切相关。支链氨基酸可阻断胰岛素信号的正常传导,增加游离脂肪酸的氧化,激活磷脂酰肌醇3激酶(PI3K),进一步诱导胰岛素抵抗[31]。
2.5 ImP ImP是由组氨酸产生的重要微生物代谢物。Koh等[32]报道,丙酸咪唑可能通过激活p38γ/p62/mTORC1途径来损害葡萄糖耐量和胰岛素信号传导。ImP通过激活p38γMAPK,在胰岛素受体底物水平上抑制胰岛素信号传导,从而促进p62磷酸化并随后激活mTORC1。有研究表明,糖尿病前期和T2DM受试者中ImP增加,与葡萄糖代谢紊乱和全身炎症呈正相关[33]。ImP可能有助于胰岛素抵抗的发展,并最终导致T2DM的发生。
3 基于肠道菌群机制下的糖尿病防治方式
多种因素,如肠道菌群总体丰度减低、慢性低度炎症增高、内毒素增多、短链脂肪酸水平的改变等,均可以引起肠道菌群失调,进而导致胰岛素抵抗和糖代谢异常。如何调节肠道菌群来阻止糖尿病的发生发展是近期研究的热点。目前的调控手段包括益生菌、益生元、合生元、膳食纤维、肠道菌群移植、微生态制剂与糖尿病药物的联合作用、饮食、运动、减肥手术、抗菌药物、维生素K2(Vit K2)、人造甜味剂及传统中药等(图2),其改善糖尿病的机制主要是通过调节免疫功能、改善肠道屏障、抑制病原体、生成有机酸、调节微生物组结构、宿主及其菌群相互作用等来实现[34-35]。益生菌和益生元、中医和天然化合物,以及某些非药物疗法[如减肥手术、肠道菌群移植(FMT)、饮食和运动],可以重塑肠道微生物群以治疗T2DM。
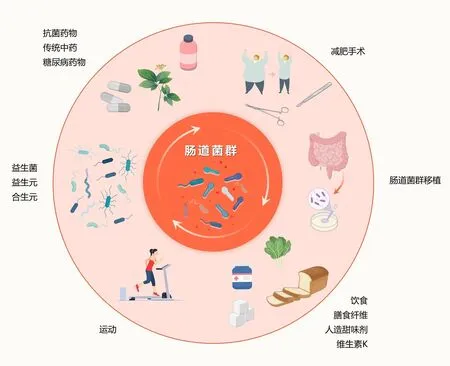
图2 针对肠道微生物群的各种防治糖尿病常见干预措施
3.1 益生菌制剂 益生菌为能够对宿主健康产生有益作用的活的微生物制剂[36]。肠道菌群具有可变性和可调控性,通过调节肠道菌群,可以改善系统炎症状态和代谢水平。研究发现摄入富含益生菌的酸奶制品,可减少炎症标志物,提高抗炎脂肪组织巨噬细胞水平[37]。部分益生菌如枯草杆菌、乳酸菌可以使肠道紧密连接蛋白的表达上调,增强肠道屏障完整性,减少肠道细菌毒性产物的扩散,减轻肠道和全身性炎症。益生菌并没有显著性地改变粪便菌群的组成,其对糖尿病的保护作用是通过维持肠道菌群的稳态,影响了肠道菌群的生理功能实现的。
3.2 益生元 益生元是不可消化的碳水化合物,由肠道中的微生物发酵;通过调节肠道菌群和其代谢产物对T2DM的管理具有潜在的积极影响。益生元除了来自食物,也可以是非碳水化合物,并能作用于全身各个部位[38]。益生元的有益作用主要是通过抵抗病原体侵袭、调节免疫、抑制炎性反应、改善肠道功能、影响血糖代谢等机制实现的[39-41]。低聚糖类是常用的益生元,包括低聚果糖、低聚半乳糖、菊粉等。一项随机对照试验显示,在T2DM患者中,补充菊粉型果聚糖6周可显著提高 T2DM患者的双歧杆菌、总SCFAs、乙酸和丙酸水平[42]。有证据显示,联合使用益生元与益生菌比单独使用益生元有更大的抗炎作用[43]。
3.3 合生元 合生元是益生菌和益生元的混合物。两者的结合可能具有改善肠道健康的协同作用[44]。同时,已经观察到合生元对血浆炎症的影响比单独使用益生菌更显著[45]。Kassian等[46]发现,合生元治疗改善了空腹血糖和空腹胰岛素水平。然而,使用合生元的缺点是很难预测每种成分的选择性和特异性以及由此产生的作用机制。
3.4 膳食纤维 膳食纤维是多糖类物质,不易被人体消化,主要来源于植物。不仅有通便的效果,还能增强肠道屏障功能、维持肠道免疫平衡、降低肠腔内氧化应激的作用,对肥胖和糖尿病等炎症相关疾病有益[47]。膳食纤维的代谢终产物如SCFAs既能够为宿主提供能量,也发挥免疫调节和肠-脑信号传导作用[48]。
3.5 FMT FMT是将健康供体的微生物组移植到患者体内,以试图替换或纠正与病理学相关的微生物组。FMT可通过调节体内的肠道菌群结构,恢复优势有益菌的丰度,改善胰岛素敏感性,从而达到改善糖尿病患者高血糖的效果。对患有代谢综合征的肥胖受试者移植瘦人供体的粪便微生物群,可提高患者胰岛素敏感性、粪便丁酸盐浓度、微生物多样性以及与主要产丁酸菌(罗氏菌属)的相对丰度[49],并且对于减轻体重,减少腰围有一定的帮助。因此粪便菌群移植是一种新的治疗T2DM的潜在选择。但是,FMT可能成为额外的危险因素。有报道,移植后出现耐药性致病菌感染,导致严重的菌血症[50],提示供者的筛选需要格外谨慎。
3.6 微生态制剂与糖尿病药物的联合作用 联合应用益生菌(动物双歧杆菌)与益生元(葡聚糖),能够促进糖尿病小鼠实验中西格列汀的降糖效果,显著降低空腹血糖,提高胰岛素敏感性和GLP-1水平[51]。二甲双胍能促进肠道菌群的代谢产物SFCAs,特别是丙酸和丁酸盐的水平升高,并且甘氨酸,色氨酸等与血糖相关的氨基酸的代谢率也得到提高[52]。因此,糖尿病药物与微生物组的相互作用成为微生物组学研究的新方向。
3.7 饮食 饮食可以调节肠道菌群,并通过预防肠道生态失调在DM的管理中发挥作用[53]。水果和蔬菜含有多酚,可以增加有益的菌群,如粘液酸A粘液,乳酸杆菌和双歧杆菌[54]。不平衡的膳食摄入会影响肠道菌群的结构和丰度,这可能在糖尿病的发展中发挥作用[55]。
3.8 运动 运动对于提高胰岛素敏感性,降低血糖和抑制炎症至关重要[56]。肠道微生物群的研究为运动调节糖尿病的机制提供了新的视角。运动不仅可以增加肠道菌群的多样性,还可以增加运动员肠道菌群中粘液杆菌的丰度,这与肥胖和T2DM呈负相关[57]。累积的研究表明,运动训练后拟杆菌的丰度增加,而梭状芽胞杆菌属和蓝藻的丰度降低[58],提示运动可通过肠道微生物群降低糖尿病患者的血糖水平。
3.9 减肥手术 近年来研究发现,减肥手术会改变宿主体肠道菌群的组成,明显降低肠道厚壁菌门的数量。一项荟萃分析[59]纳入了2008—2016年间共22篇文献,发现减肥手术后大多数患者术后厚壁菌丰度较低,拟杆菌含量明显增加,从而验证了之前的假设,也为肠道菌群的变化与术后减肥疗效和T2DM治疗效果的关联性提供了依据。
3.10 抗菌药物 Membrez等[60]发现,当用诺氟沙星和氨苄西林治疗饮食诱导肥胖小鼠时,血糖得到控制,空肠中肿瘤坏死因子α水平降低,表明抗生素调节肠道菌群可以降低炎症水平并增加葡萄糖耐量。基于上述思路,可以通过口服抗菌药物来调节糖尿病患者的肠道菌群,降低机体的炎症水平,改善T2DM。值得注意的是,口服抗菌药物可以抑制肠道中的有害细菌,降低机体的炎症水平;也可能对肠道中的有益细菌造成损害,导致肠道菌群失衡,对糖尿病患者产生不利影响。
3.11 维生素K(Vit K) Vit K是一种脂溶性维生素,Vit K1(叶绿醌)和Vit K2(甲萘醌)是2种天然形式。Vit K1主要存在于绿叶蔬菜中,特别是菠菜、西兰花、橄榄油以及大豆油,而Vit K2存在于鱼、鸡肉、牛奶、肝脏、奶酪、黄油、蛋黄、发酵大豆(纳豆)和蔬菜中,但仅少量存在。Vit K在调节血糖状态方面也具有特定的功能[61-62]。最近一项使用孟德尔随机化方法的研究表明,Vit K1的高循环水平与较低的T2DM风险有关[63]。Vit K作用广泛多样,可能是通过调节肠道菌群来介导其对人体多种多样的生理作用。近年来,前瞻性观察性研究和临床试验的证据表明,补充Vit K2可降低T2DM风险。研究表明,每日摄入360μg Vit K2以MK-7的形式持续12周可降低T2DM患者的空腹血糖和糖化血红蛋白[64];Vit K2给药可通过诱导OC基因表达改善2型糖尿病大鼠的血糖状态[65]。
3.12 人造甜味剂 人造甜味剂是无热量的糖替代品,可能通过影响肠道微生物来诱导葡萄糖不耐受。在一项用糖精喂养的小鼠的动物研究中,显示拟杆菌的增加和罗伊氏乳杆菌的减少导致菌群生态失调和葡萄糖不耐受[66]。减少人造甜味剂的摄入,可能也会对控制血糖有帮助。
3.13 中医药 中医通过影响胰岛素抵抗来改善T2DM患者的生活质量[67]。因此,《中国2型糖尿病防治指南》以中药作为T2DM治疗的辅助药物。中药的许多成分不会进入血液,但它具有明显的效果。越来越多的数据表明,其疗效可能由肠道微生物群介导[68]。
4 展望
肠道菌群是T2DM重要的可调控因素。随着微生物组学和宏基因组学技术的发展,越来越多的对宿主健康有影响的肠道微生物代谢产物被鉴定出来,这些代谢物为T2DM的预防和治疗提供了新的策略。该领域从基础研究到应用于临床还有许多需要解决的问题:首先,大部分结果来自临床前实验,关于微生物代谢物对T2DM影响的人类临床研究很少;啮齿动物和人类可能具有不同的微生物代谢物,如胆汁酸等,需要更多高质量的临床试验来有效评估肠道微生物代谢物在T2DM中的关键作用。其次,肠道微生物及其代谢物和T2DM之间的因果关系尚未得到充分阐明;肠道微生物与宿主之间的相互作用非常复杂,受到许多因素的影响,例如遗传背景、饮食、生活习惯或其他共存的微生物等。因此,结合糖尿病患者自身基因和微生物基因组的特异性,致力于精准化和个体化的干预策略,具有深远的意义。

