养阴清肺口服液对大鼠放射性肺损伤的保护作用
方选,刘鹏,王晓雯
(1.青岛市食品药品检验研究院安评中心,山东 青岛 266071;2.青岛市海慈医疗集团肿瘤科,山东 青岛 266033)
放射性肺损伤是胸部放疗最常见的并发症[1],严重影响了患者的生存质量及放疗效果[2]。目前放射性肺损伤的治疗主要以糖皮质激素为主,但疗效不佳,长期使用不良反应严重。因此寻求一种有效且毒副作用小的理想药物是当今研究热点。养阴清肺口服液的主要成分是地黄、川贝母、麦冬、白芍、玄参、薄荷、牡丹皮、甘草,具有清热润肺、散结消痈、消炎抗菌、提高免疫力等功效。本研究通过建立大鼠放射性肺损伤模型,观察养阴清肺口服液对放射性肺损伤的保护作用及其机理,为临床治疗提供可靠的实验依据。
1 材料与方法
1.1 仪器
电子直线加速器(美国瓦里安公司,21EX);酶 标 仪(Bio-Rad 公 司,xMark);Bio Rad 电 泳仪及电泳槽(北京东方恒伟科技开发公司,DY-6D);病理图文报告系统(江苏捷达科技发展有限公司,JD-801);流式细胞仪(美国BD 公司,BD FACSAria Ⅱ)。
1.2 试药
养阴清肺口服液(呼伦贝尔松鹿制药有限公司,批号:20190506);地塞米松片(广东华南药业集团有限公司,批号:H44024469);大鼠血清IL-1、TNF-α、TGF-β1酶联免疫试剂盒(批号:138429035、138429035、137181017,均购自eBioscience 公司);蛋白marker(北京索莱宝公司,批号:20200623);TNF-α 抗体(武汉博士德公司,批号:BST16458763);TGF-β1(武汉博士德公司,批号:BST17094185);FITC anti-Rat CD3(批号:553682),APC anti-Rat CD4(批号:564835),RPE anti-Rat CD8(批号:554763)均购自BD 公司。
1.3 动物
SPF 级雄性SD 大鼠60 只,体重160~180 g,购于青岛市实验动物和动物实验中心,实验动物生产许可证号:SCXK(鲁)2014 0001,实验动物使用许可证号:SYXK(鲁)2014 0002。本研究经青岛市食品药品检验研究院实验动物福利伦理委员会批准,编号F2019001。
1.4 分组、造模、给药
60 只大鼠按体重分为空白组、模型组、地塞米松组和养阴清肺口服液低、中、高剂量组,每组10 只。除空白组外,其余大鼠均用6MV-X 线全胸单次照射,总剂量20 Gy[3]。参考《药理实验方法学》第4 版人与大鼠等效剂量折算法[4],养阴清肺口服液低、中、高剂量组大鼠用药分别为人每日用量的2.5 倍、5 倍、10 倍,成人(60 kg)每日用量为0.2 g/kg,养阴清肺口服液低、中、高剂量组大鼠每日给药量分别为0.5、1、2 g/kg。地塞米松组为0.5 mg/kg,按10 ml/kg 体重灌胃。空白组及模型组同时给予等量生理盐水灌胃。各组均于照射后第1 天开始灌胃,每日1 次,连续给药8 周。
1.5 观察指标
①比较血清IL-1、TNF-α、TGF-β1水平:采血后3 000 r/min 离心15 min,取血清用ELISA 法检测IL-1、TNF-α、TGF-β1水平。②比较肺组织TNF-α、TGF-β1蛋白表达:采用Western blot 法,取肺组织剪碎加入RIPA 裂解液,冰浴中电动匀浆器匀浆20 s,4 ℃ 12 000×g 离心15 min,收集上清液用BCA 法测定上清液蛋白含量。取等量蛋白样品进行聚丙烯酰胺凝胶电泳,转膜,封闭,加入1 ∶400 稀释的一抗,4 ℃过夜,再加入用杂交液稀释的二抗(1 ∶1 000),室温1 h,ECL 染色,用Quantity One 软件进行半定量分析。③比较外周血T 淋巴细胞亚群:采血后肝素抗凝,以细胞分离液分离淋巴细胞,用流式细胞仪检 测CD3+、CD4+、CD8+、CD4+/CD8+各 淋 巴细胞亚群水平。④肺组织病理变化:摘取右肺中叶,以10%中性甲醛固定,常规脱水、浸蜡、包埋、切片,经HE 染色后光镜下观察肺组织病理改变。
1.6 统计方法
用SPSS 22.0 软件进行分析,符合正态分布的计量资料用(±s)表示,组间比较均采用单因素方差分析。以P<0.05 表示差异有统计学意义。
2 结果
2.1 各组血清中IL-1、TNF-α、TGF-β1 水平比较
与空白组比较,模型组血清IL-1、TNF-α、TGF-β1水平均显著升高(P<0.01);与模型组比较,地塞米松组、养阴清肺口服液中、高剂量组血清IL-1、TNF-α、TGF-β1水平均显著降低(P<0.01);与地塞米松组比较,养阴清肺口服液高剂量组血清TNF-α、TGF-β1降低(P<0.05),见表1。
表1 大鼠血清IL-1、TNF-α、TGF-β1 的含量[(±s),pg/ml]

表1 大鼠血清IL-1、TNF-α、TGF-β1 的含量[(±s),pg/ml]
注:与空白组比较,aP<0.01;与模型组比较,bP<0.01;与地塞米松组比较,cP<0.05
组别 例数 IL-1 TNF-α TGF-β1空白组 10 65.34±5.45 381.51±59.23 401.32±29.33模型组 10 150.92±8.24a 863.43±66.01a 915.21±56.74a地塞米松组 10 85.84±6.68b 570.72±54.75b 674.38±55.72b养阴清肺口服液高剂量组 10 96.57±7.24b 396.37±59.22bc 558.43±51.31bc养阴清肺口服液中剂量组 10 106.68±7.51b 558.41±63.14b 687.32±45.63b养阴清肺口服液低剂量组 10 151.57±6.35 803.57±55.36 902.28±39.57
2.2 各组肺组织TNF-α、TGF-β1 蛋白表达比较
Western blot 检测结果显示,模型组肺组织TNF-α、TGF-β1蛋白表达水平均高于空白组(P<0.05)。与模型组、地塞米松比较,养阴清肺口服液中高剂量组TNF-α、TGF-β1蛋白表达水平降低(P<0.05),见表2。
表2 大鼠肺组织TNF-α、TGF-β1 的蛋白表达水平(±s,n=10)
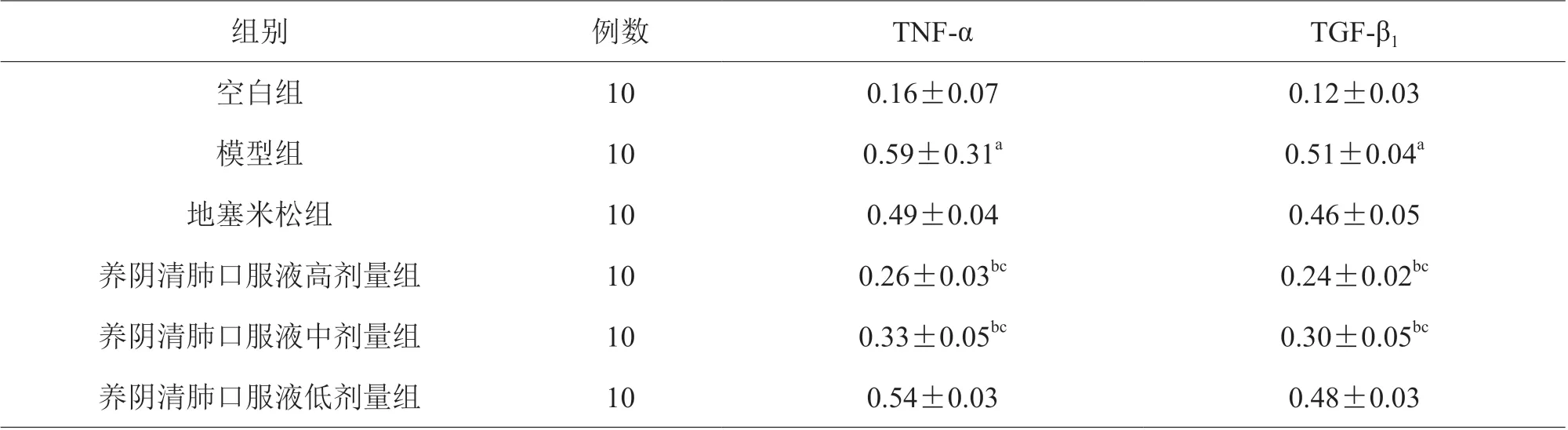
表2 大鼠肺组织TNF-α、TGF-β1 的蛋白表达水平(±s,n=10)
注:与空白组比较,aP<0.05;与模型组比较,bP<0.05;与地塞米松组比较,cP<0.05
组别 例数 TNF-α TGF-β1空白组 10 0.16±0.07 0.12±0.03模型组 10 0.59±0.31a 0.51±0.04a地塞米松组 10 0.49±0.04 0.46±0.05养阴清肺口服液高剂量组 10 0.26±0.03bc 0.24±0.02bc养阴清肺口服液中剂量组 10 0.33±0.05bc 0.30±0.05bc养阴清肺口服液低剂量组 10 0.54±0.03 0.48±0.03
2.3 各组外周血中不同T 淋巴细胞亚群百分率比较
与空白组比较,模型组大鼠外周血CD3+、CD4+、CD4+/CD8+水平均显著降低,CD8+水平显著升高(P<0.05);与模型组比较,养阴清肺口服液中高剂量组外周血CD3+水平显著升高(P<0.01),高剂量组CD4+、CD4+/CD8+水平均显著升高,CD8+水平显著降低(P<0.01);地塞米松组较模型组CD3+、CD4+、CD4+/CD8+水平均降低,CD8+水平升高(P<0.01),见表3。
表3 大鼠外周血CD3+、CD4+、CD8+、CD4+/CD8+ 的水平(±s)

表3 大鼠外周血CD3+、CD4+、CD8+、CD4+/CD8+ 的水平(±s)
注:与空白组比较,aP<0.05;与模型组比较,bP<0.01
组别 例数 CD3+(%) CD4+(%) CD8+(%) CD4+/CD8+空白组 10 45.86±2.45 30.85±2.32 18.89±2.26 1.63±0.22模型组 10 33.19±3.21a 24.54±3.25a 24.31±1.95a 1.01±2.32a地塞米松组 10 30.48±1.13 22.27±1.33 25.26±3.12 0.88±2.32养阴清肺口服液高剂量组 10 48.02±3.34b 29.32±3.24b 20.76±0.18b 1.42±2.32b养阴清肺口服液中剂量组 10 45.15±2.26b 25.81±1.33 21.42±0.27 1.20±2.32养阴清肺口服液低剂量组 10 40.92±0.34 24.74±1.23 21.66±0.14 1.14±2.32
2.4 各组肺组织病理变化
空白组肺泡结构清晰,无充血、纤维化。模型组肺泡塌陷,炎细胞大量浸润,肺间质纤维化严重;地塞米松组肺泡结构疏松紊乱,密集的炎细胞浸润区减少,散在的浸润区增多,出现局灶纤维化;养阴清肺口服液高剂量组肺泡结构正常,间质见少量炎细胞浸润,间质纤维化较少,纤维化程度明显轻于模型组;养阴清肺口服液中、低剂量组肺间质纤维化有所改善,见图1。
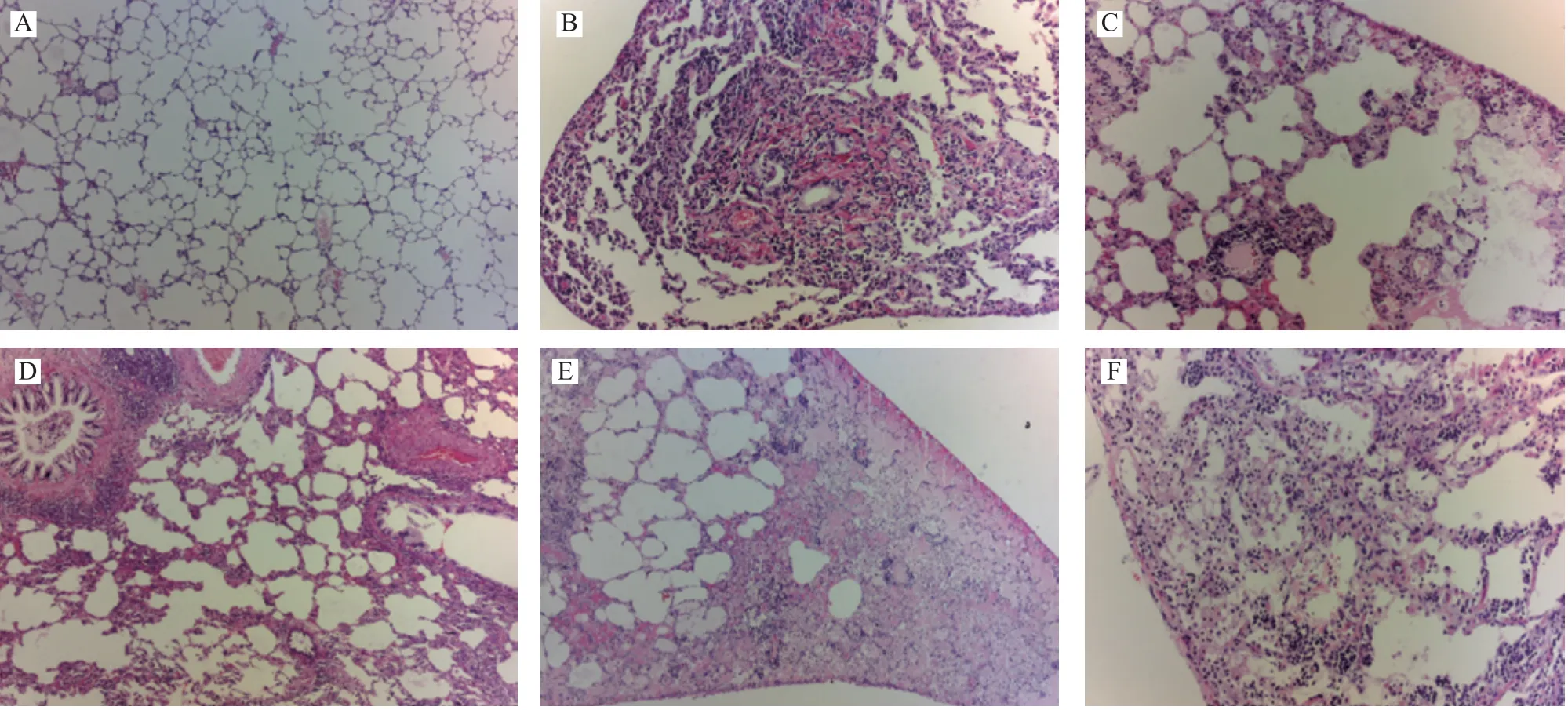
图1 大鼠肺组织病理学改变(HE,×200)
3 讨论
3.1 放射性肺损伤的病理机制
放射性肺损伤是肺组织受电离辐射引起间质及肺泡水肿,释放多种致炎、致纤维化细胞因子,引起肺炎性反应及纤维化[5]。其中,IL-1 介导炎性反应及纤维化,调节T 淋巴细胞活性及机体的炎症及免疫反应[6]。TNF-α 是细胞因子调节网络的启动因子,在组织炎症的发生发展中起重要作用[7]。TGF-β1不仅参与早期炎性细胞启动放射性肺损伤发生,还进一步刺激成纤维细胞增生,是诱发放射性肺损伤关键因素[8]。放疗后血清TGF-β1可作为放射性肺炎的预测因子[9],抑制其表达可推迟器官纤维化进程[10]。
3.2 放射性肺损伤的治疗原则
中医认为放射线为火热邪毒,灼伤肺阴,且癌症患者本身存在外周血淋巴细胞亚群表达异常[11],放疗后免疫功能进一步降低。不同T 细胞亚群是细胞免疫功能的主要承担者,其中CD3+,CD4+,CD8+T 细胞亚群数量和比例的稳定和平衡是维持机体正常免疫功能的基础[12]。因此放射性肺损伤治疗应以养阴清肺、清热解毒、活血化瘀、调节机体免疫功能为主。养阴清肺口服液中地黄、川贝母、麦冬、玄参、薄荷、甘草具有清热解毒、消肿散结、祛痰平喘、消炎抗菌的功效,地黄、麦冬、白芍、薄荷、牡丹皮可调节T 淋巴细胞亚群平衡,提高机体免疫力[13]。
3.3 养阴清肺口服液的保护作用
本研究结果显示,模型组大鼠血清IL-1、TNF-α、TGF-β1水平均显著升高,肺组织TNF-α、TGF-β1蛋白表达升高;组织病理学见肺泡壁断裂,肺间质充血、水肿,肺泡腔粒细胞浸润等炎症反应及纤维化反应,同时外周血CD3+,CD4+,CD4+/CD8+比值明显降低,CD8+显著升高,表明放射线照射可影响大鼠外周血T 淋巴细胞亚群,导致免疫功能异常,促进细胞炎性因子大量释放,说明放射性肺损伤大鼠模型建立成功。养阴清肺口服液高剂量组大鼠CD3+,CD4+,CD4+/CD8+T 淋巴细胞水平较模型组明显升高,CD8+水平显著降低,地塞米松组较模型组CD3+,CD4+,CD4+/CD8+水平均降低,CD8+水平升高,说明养阴清肺口服液能有效调节T 淋巴细胞亚群,提高机体细胞免疫功能,抑制细胞炎性因子分泌。地塞米松长期使用对免疫指标有抑制作用。与模型组比较,养阴清肺口服液中高剂量组大鼠肺泡结构正常,间质仅少量纤维增生,且纤维化程度低于地塞米松组;能显著降低血清IL-1、TNF-α、TGF-β1水平及肺组织TNF-α、TGF-β1蛋白表达。与地塞米松组比较,养阴清肺口服液高剂量组TNF-α、TGF-β1水平更低,提示放疗早期应用养阴清肺口服液能抑制急性炎症所致毛细血管通透性亢进,改善微循环,促进炎症吸收,抑制肺组织纤维化,阻止放射性肺损伤发展。
综上所述,养阴清肺口服液可调节T 淋巴细胞亚群平衡,改善免疫功能,抑制放射性肺泡炎性反应及肺纤维化进程,疗效优于地塞米松,对大鼠放射性肺损伤具有良好的保护作用。

