地参总黄酮的提取及抗氧化活性研究*
汤承浩,胡秀虹,文廷珊
(凯里学院大健康学院,贵州 凯里 556011)
地参(LycopuslucidusTurcz.)属唇形科(Labiatae)多年生草本植物,别名虫草参、地蚕子、草石蚕,因其形状、营养成分与人参相似而得名。植株主要分布于云南、江西、江苏、四川、湖南、湖北、贵州等地[1]。地参全草均可以入药,具有利尿、活血、滋阳、利关节同时还有多种生物活性,如增强免疫功能,抗氧化、抗肿瘤、降血糖、降血脂等作用[2-3]。
杨书良等[4]首先用温浸的方法提取北豆根中蝙蝠葛碱的含量,接着用渗漉法,最后采用超声波法,在其他条件不变的情况下对提取率进行比较,结果发现超声提取法用时较短,提取率比其他的两种方法高效。高岐[5]等人运用微波提取金银花中总黄酮,提取率为2.73%;向极迁等[6]运用超声法从金银花中提取总黄酮,提取率高达8.84%,可见同种植物超声提取的提取率比较高。刘华等[7]在提取因素不变情况下,同时采用超声法及微波法,提取韭菜中总黄酮,超声各个方面均优于微波法。郭文娟等[8-10]用超声方法分别从山楂核、藏药刀豆、广豆根中提取总黄酮,与对照品进行比较,黄酮提取液用于清除DPPH·效果较好,清除率越高抗氧化能力越强。植物总黄酮提取含量测定常采用紫外分光光度法[11],利用黄酮类物质可被亚硝酸钠还原和硝酸铝络合在碱性条件下会显红色的性质,以芦丁作为标准品,在最大波长处可以测定植物中总黄酮含量。
超声技术提取地参总黄酮,工艺简便、高效、快速、成本低,所用的提取溶剂乙醇较其他工艺用量少。在黄酮研究中选取地参为提取物较少报道,选用价格相对较低的乙醇为提取剂可以降低实验成本。地参抗氧化剂能有效清除体内多余自由基,不但能延缓衰老还能减少和预防疾病。
1 材料与试剂
1.1 实验材料
实验材料选取黔东南州凯里市万潮镇培植的地参。采摘时间2016年11月。将新鲜的地参的根部分洗净,沥干表面水分,切成小块,置于电热鼓风干燥箱中,设置温度80 ℃。干燥好后用粉碎机将其粉碎,过40目筛,作为供试样品。
1.2 实验试剂与设备
芦丁标准品(中国药品生物制品鉴定所,批号:NACC-60013)、亚硝酸钠(毕得医药)、硝酸铝(毕得医药)、氢氧化钠(毕得医药)、1,1-二苯基-2-2苯肼基自由基(梯希爱化成工业发展有限公司)、VC(上海山浦化工有限公司)、无水乙醇(探索平台),实验用水均为超纯水。
电热鼓风干燥箱(上海博讯实业有限公司医疗设备厂)、小型高速粉碎机(青州市精诚医药装备制造有限公司)、分样筛(湖南长沙思科仪器沙筛厂)、电子天平(奥豪斯仪器(常州)有限公司)、超声波清洗器(上海科导超声仪器有限公司)、超纯水机(艾柯成都康氏康宁科技有限公司)、紫外-可见分光光度计(日本岛津公司)。
2 实验方法
2.1 标准品制备
精密称取芦丁标准品25 mg置于小烧杯中,加70%乙醇溶液3 mL,用玻璃棒搅拌至完全溶解,再将其转至50 mL容量瓶中,用70%的乙醇溶液定容,摇匀,得到50 mg·mL-1芦丁标准溶液,备用。
2.2 样品提取液制备
称取地参粉末1.0048 g(过40目筛),置于50 mL锥形瓶中,加入70%乙醇溶液20 mL,盖上玻璃塞,摇匀。超声15 min,超声功率100 W,冷却抽滤,将滤液转至50 mL容量瓶中,加70%乙醇溶液定容,得到地参提取液,备用。
2.3 检测波长
取以上芦丁标准溶液4 mL和地参提取溶液1 mL,置于50 mL容量瓶中,加入70%乙醇溶液10 mL,然后加入5%亚硝酸钠溶液1 mL,摇匀,静置6 min,再加入10 %的硝酸铝溶液1 mL,摇匀后静置7 min后,最后加入5%氢氧化钠溶液10 mL,用70%乙醇溶液定容至刻度,摇匀后静置15 min,以相应试剂做空白,用紫外-可见分光光度计在波长200~800 nm之间进行扫描,扫描结果显示,芦丁标准溶液和地参提取液在510 nm处有最大波长。
2.4 标准曲线
精密移取标准品溶液4.00 mL、6.00 mL、8.00 mL、10.00 mL于50 mL容量瓶中,分别加入70%乙醇溶液10 mL并加入5%亚硝酸钠溶液1 mL,静置6 min;然后加入10%硝酸铝溶液1 mL,静置7 min;最后加入5%氢氧化钠溶液10 mL,用70%乙醇溶液定容,摇匀后静置15 min。于510 nm波长处测定吸光度。
2.5 单因素实验
2.5.1 乙醇浓度的选择
称取1.0019 g地参粉末,分别加入不同浓度(40%、50%、60%、70%、80%、90%)的乙醇溶液20 mL,超声功率100 W,时间15 min。
2.5.2 超声功率的选择
称取1.0041 g地参粉末,加入70%的乙醇溶液20 mL,设置超声时间15 min,超声功率分别为100 W、137.5 W、175 W、212.5 W、250 W。
2.5.3 超声时间的选择
称取1.0048 g处理好的地参粉末,加入70%乙醇溶液20 mL,设置超声功率175 W,超声时间分别为10 min、15 min、20 min、25 min、30 min。
2.5.4 料液比的选择
称取1.0052 g地参粉末5份,分别加入70%乙醇溶液20 mL、25 mL、30 mL、35 mL、40 mL,超声功率175 W,超声时间20 min。
2.6 正交实验
根据单因素实验,得出单个因素最佳水平,为了进一步考察各实验因素对总黄酮提取率的影响,以乙醇体积分数(A)、超声功率(B)、超声时间(C)、料液比(D)为总黄酮提取率(Y)的评价指标,设计L9(34)正交实验。
2.7 抗氧化活性研究
2.7.1 DPPH·溶液配制
精密称取4.4 mg DPPH·粉末置于小烧杯中,溶解后转到100 mL棕色容量瓶中,用无水乙醇定容至刻度,摇匀,避光保存,备用。
2.7.2 样品提取液配制
配制方法与2.7.1相似,将提取液稀释为0.1924 mg·mL-1,避光保存,备用。
2.7.3 VC溶液配制
精密称取48.1 mg VC粉末,置于小烧杯中,加入3 mL无水乙醇搅拌溶解。将其转入100 mL棕色容量瓶中,用无水乙醇定容。精密移取1 mL置于25 mL容量瓶中用无水乙醇定容,摇匀,避光保存,备用。
2.7.4 地参总黄酮对DPPH·清除作用的研究
方法参考了文献[8-10]。提前准备好10 mL棕色容量瓶,第一瓶加入5 mL DPPH·,第二瓶加入地参提取液及DPPH·,第三瓶加入地参提取液,分别用无水乙醇定容。按照此法加入DPPH·体积不变,地参提取液依次加入量为1.00 mL、1.50 mL、2.00 mL、2.50 mL、3.00 mL。无水乙醇作为空白,在517 nm处分别测定DPPH·(A0),DPPH·加地参提取液(A1),以及加入的地参提取液(A2)吸光度值。算出清除率。
2.7.5 VC对DPPH·清除作用的研究
同等体积地参提取液溶液换成VC,依次算出不同浓度下VC对DPPH·的清除率,再和地参提取液做比较。
DPPH·清除率公式:DPPH·清除率(%)=[A0-(A1-A2)/A0]×100%
A0:DPPH·+无水乙醇;
A1:地参提取液+DPPH·;
A2:地参提取液+无水乙醇。
3 实验结果与分析
3.1 标准曲线的绘制
以芦丁浓度作为横坐标,测得的吸光度为纵坐标做标准曲线,结果见图1,芦丁在0.04~0.10 mg·mL-1之间线性关系良好。

图1 芦丁溶液的标准曲线Fig.1 Standard curve of rutin
3.2 单因素实验
3.2.1 乙醇浓度的影响
由图2可以看出,乙醇浓度从50%增长到70%,提取率增高,乙醇浓度为70%时达到最大值;继续增加乙醇浓度,提取率迅速下降。从成本和提取量来考虑,乙醇浓度最好控制在70%左右。
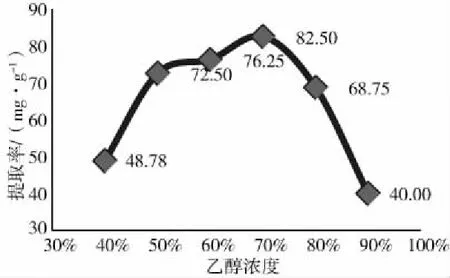
图2 不同乙醇浓度对总黄酮提取率的影响Fig.2 Effect of different ethanol concentration on theextraction rate of total flavonoids
3.2.2 超声功率的影响
从图3可见,超声功率在100 W到175 W时提取率逐渐提高,随后功率增大提取率渐渐降低。可见功率太低不能将所需成分提取出来;而功率过高则会破坏有效成分,由此选取功率175 W为宜。
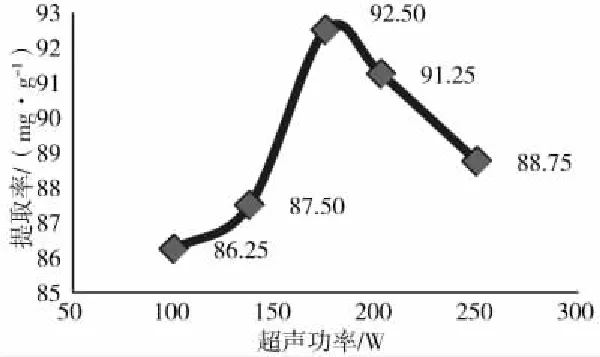
图3 不同超声功率对总黄酮提取率的影响Fig.3 Effect of different ultrasonic power on theextraction rate of total flavonoids
3.2.3 超声时间的影响
从图4可见,从超声10 min开始每间隔5 min提取率上升,20 min后提取率逐渐下降,可见超声时间太短无法提取出黄酮类化合物;时间过长导致黄酮类物质被破坏,因此选择超声时间20 min相对较好。
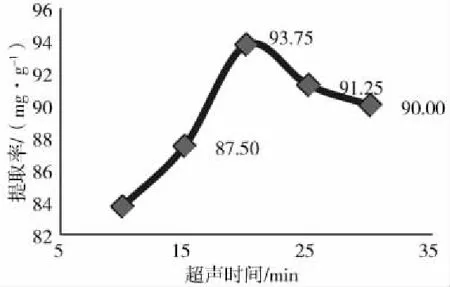
图4 不同超声时间对总黄酮提取率的影响Fig.4 Effect of different ultrasonic time on theextraction rate of total flavonoids
3.2.4 料液比的影响
料液比对地参总黄酮提取率的影响如图5所示,在料液比为1∶30 g·mL-1时,地参总黄酮提取率最好,当料液比小于1∶30 g·mL-1时,活性物质不能完全被析出;当料液比大于1∶30 g·mL-1后,提取率逐渐下降。综合提取效果和减少溶剂用量等方面考虑,选取料液比1∶30 g·mL-1较合适。
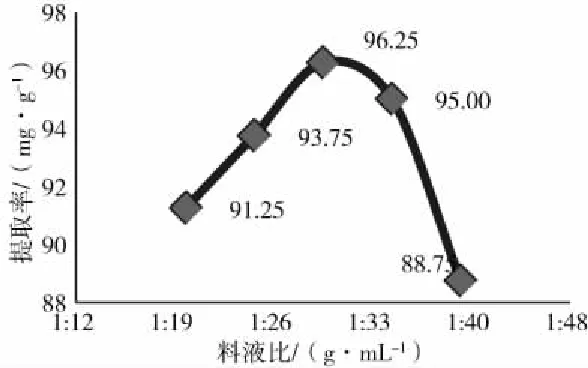
图5 不同料液比对总黄酮提取率影响Fig.5 Effect of different solid-liquid ratio on the extraction rate of total flavonoids
3.3 正交实验
选择的因素见表1,组成的正交实验见表2。

表1 正交实验因素与水平Tab.1 Factors and levels of the orthogonal experiment
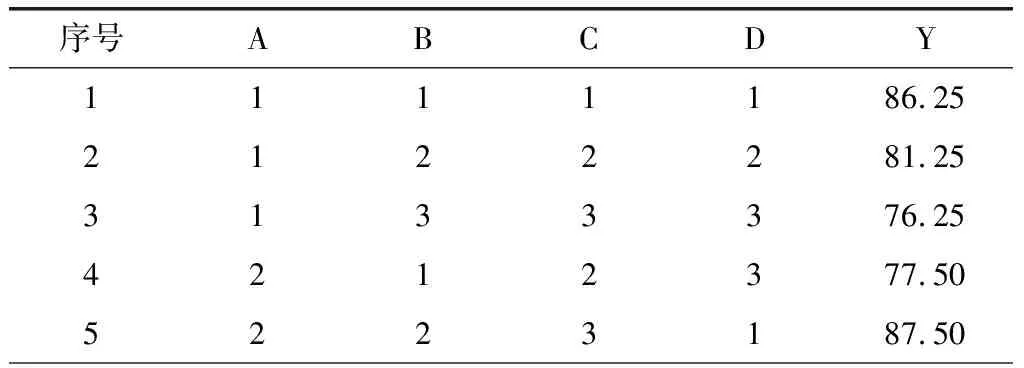
表2 L9(34)正交实验结果Tab.2 L9(34) orthogonal test results
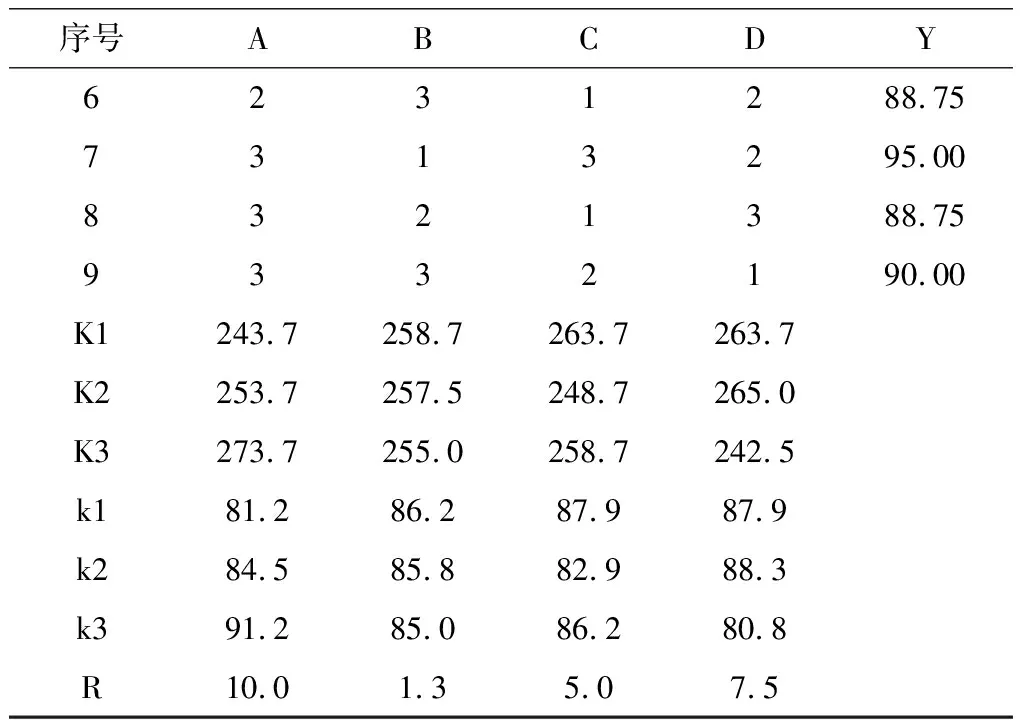
续表2
由表2可看出,各个因素对地参总黄酮提取率的影响依次为乙醇体积分数>料液比>超声时间>超声功率。得到的最佳条件:乙醇体积分数70 %、超声功率175 W、超声时间20 min、料液比1∶30 g·mL-1,此条件下平行测定三次,提取率为96.25 mg·g-1。
3.4 抗氧化活性研究
比较相同体积浓度下地参提取液及VC对DPPH·的影响,见图6。
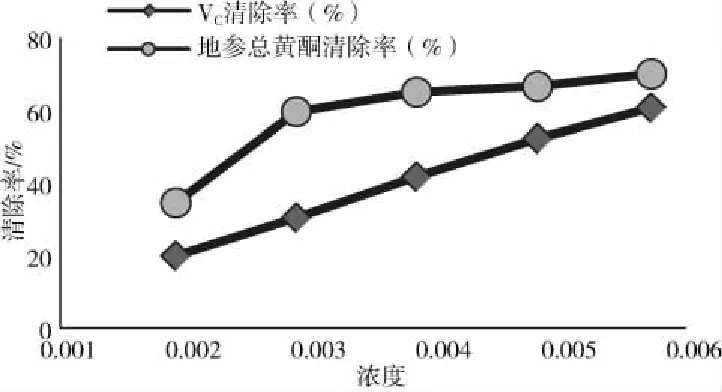
图6 总黄酮及VC对DPPH·的清除作用Fig.6 Scavenging effect of total flavonoids and Vc on DPPH·
由图6可知,在以上选定浓度范围内,地参总黄酮浓度越高,清除能力越强,与VC相比,通过回归方程可以计算出地参总黄酮IC50=0.00272 mg·mL-1;VC的IC50=0.00455 mg·mL-1,地参总黄酮提取液对DPPH·表现出较强的清除能力,地参提取液对DPPH·的清除能力强于VC。
4 结论与讨论
本实验研究利用超声法提取地参总黄酮化合物工艺并对其体外抗氧化活性进行测试。考察了乙醇体积分数、超声功率、超声时间、料液比四个因素对总黄酮提取率的影响,通过正交实验得出最佳提取工艺,并采用DPPH·法对地参总黄酮的自由基清除能力和总抗氧化活性进行评价。结果表明:地参总黄酮最佳提取工艺条件为:乙醇体积分数为70%,超声功率为175 W,超声时间为20 min,料液比为1∶30。总黄酮提取率高达96.25 mg·g-1。且超声提取法得到的地参提取物对DPPH·有很好清除作用,IC50值为0.00272 mg·mL-1。

