急性ST段抬高型心肌梗死伴射血分数减少型心力衰竭患者左心室逆重构的预测因素
王晓敏 徐亚威 毛云 郑璐 裴小鑫 杨海波
郑州大学第一附属医院心内科(郑州450000)
急性ST 段抬高型心肌梗死(ST-segment elevation myocardial infarction,STEMI)是冠心病的严重类型,虽然冠脉介入技术及药物不断发展,STEMI仍可导致各种致命性并发症。STEMI 最常见的并发症为心力衰竭(heart failure,HF),根据左心室射血分数(left ventricular ejection fraction,LVEF)可以分为射血分数保留型心力衰竭(heart failure with preserved ejection fraction,HFpEF)、射血分数中间型心力衰竭(heart failure with mid-range ejection fraction,HFmrEF)和射血分数减少型心力衰竭(heart failure with reduced ejection fraction,HFrEF)。多项研究表明,STEMI 患者射血分数降低与预后不良密切相关,与HFpEF 及HFmrEF 的预后相比,HFrEF 的预后较差,但发生HFrEF 的比例低于HFpEF 及HFmrEF。左室重构是指在发生心肌损伤时,心肌细胞和间质变化,表现为左室大小、质量、形状和功能改变,导致心室扩张、心室间质纤维化以及收缩和舒张功能障碍。左室逆重构是扩大的左室恢复到正常的几何学结构,维持正常的心肌收缩和舒张功能[1]。近年来发现,部分HFrEF 患者经过规范化治疗可发生左心室逆重构(left ventricular reverse remodeling,LVRR),且出现LVRR的患者预后明显改善。因此本研究探究STEMI 患者直接PCI 术后HFrEF 发生逆重构的预测因素,为临床诊疗方案的指定提供依据。
1 资料与方法
1.1 研究对象 本研究为回顾性病例对照研究,连续纳入郑州大学第一附属医院2018年1月至2020年12月所有诊断为STEMI 患者接受PPCI 且LVEF 小 于40%的患者108 例,其中男82 例,女26 例,平均(60.56±11.21)岁。根据患者PCI 术后6 个月的心脏彩超结果将患者分为LVRR 组48 例和NLVRR 组60 例。研究经过本院伦理委员会审批通过。
纳入标准:(1)患者的病史、心电图改变及肌钙蛋白等方面均符合STEMI 诊断标准[2];(2)在发病12 h 内行直接PCI 的患者;(3)术后3 d 内超声心动图测得EF 值小于40%。
排除标准:(1)年龄<18 岁;(2)心脏瓣膜病、高血压性心脏病、风湿性心脏病、心肌病等导致心力衰竭的患者;(3)存在严重感染或合并严重肝肾功能不全患者;(4)合并肿瘤、结核等消耗性疾病患者;(5)临床资料不完整者。
1.2 资料收集 通过电子病例系统查阅并记录所纳入患者的基线资料及手术资料,包括:年龄、性别、既往病史、心率、血压、Killip 分级、常规生化指标、超声心动图指标、手术资料和用药情况。心脏彩超采用Simpson 双平面法测量LVEDV、LVESV、LVEF 和FS。LVRR 组的NT-proBNP 峰值、cTnT 峰值、间接胆红素、LVEDV、LVESV 低于NLVRR 组,FS 高于NLVRR 组(P<0.05),见表1。
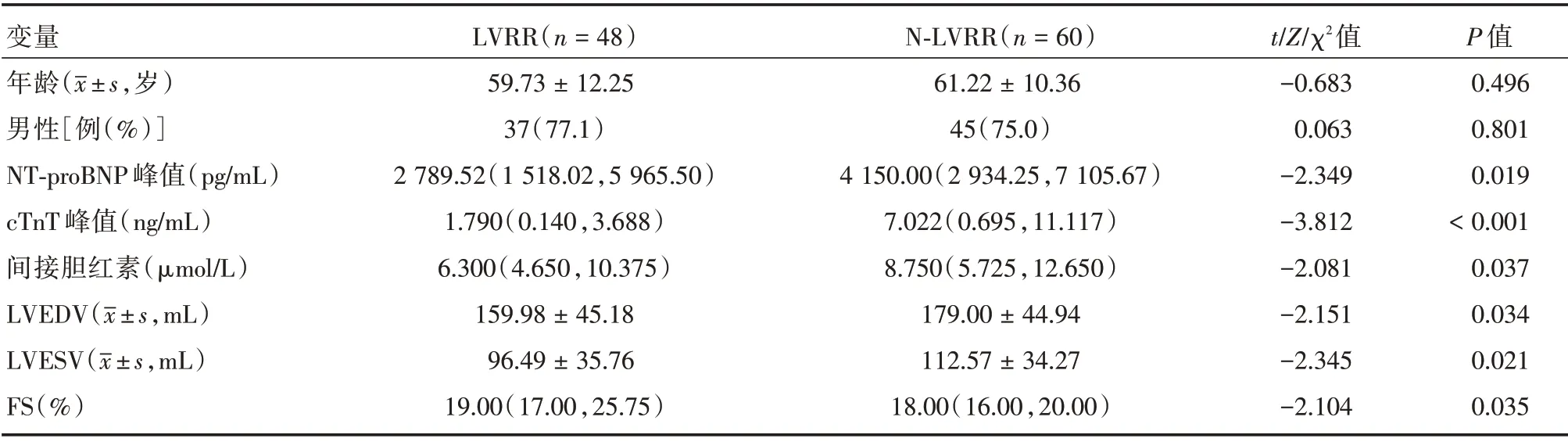
表1 基线特征比较Tab.1 Baseline characteristics M(P25,P75)
1.3 手术方法 入院后给予双抗负荷量、抗凝,手术方法采用桡动脉或股动脉入路置入动脉鞘,由经验丰富的心血管介入医师行冠脉造影明确罪犯血管及余冠脉病变的狭窄程度,根据冠脉钙化、冠脉直径及狭窄情况选择植入支架型号及数量,根据患者能否耐受直接或择期处理余病变冠脉,术后是否应用糖蛋白Ⅱb/Ⅲa 受体拮抗剂据情况而定。术后常规服用阿司匹林及P2Y12 抑制剂,β 受体阻滞剂、ACEI/ARB/ARNI、利尿剂、MRA、地高辛、SGLT-2 抑制剂视情况而定,并记录患者院外用药情况。收集患者6 个月后Simpson 双平面法测得的LVEF 值及LVEDd 值,LVEF 绝对值较基线提高≥10%且LVEF ≥50%,同时LVEDd 绝对值较基线缩小≥10%且LVEDd ≤55 mm 为LVRR 组,反之则为NLVRR 组。
1.4 统计学方法 采用SPSS 26.0 统计软件对数据进行统计学分析,正态分布计量资料以()表示,两组间比较采用独立样本t检验;非正态分布计量资料表示为M(P25,P75),两组间比较采用Mann-WhitneyU检验;计数资料采用例(%)表示,比较采用χ2检验。研究HFrEF 患者发生LVRR 的影响因素采用多因素logistic 回归分析。采用Med-Calc 19.0 绘制受试者工作特征(ROC)曲线,采用Delong检验进行两个指标间ROC曲线下面积(AUC)的比较。以P<0.05为差异有统计学意义。
2 结果
2.1 手术资料及院外用药情况 两组患者手术资料对比,LVRR 组的TIT 低于NLVRR 组,完全血运重建高于NLVRR 组(P<0.05)。LVRR 组IRA 的左前降支比例、三支病变比例低于NLVRR 组,差异无统计学意义(P>0.05)。两组患者院外用药情况对比,LVRR 组与NLVRR 组阿司匹林、P2Y12抑制剂、他汀、β 受体阻滞剂、伊伐布雷定、ACEI/ARB/ARNI、MRA、利尿剂、地高辛、SGLT-2 抑制剂差异均无统计学意义(P>0.05),见表2。

表2 手术资料及院外用药情况Tab.2 Operation data and discharged medications 例(%)
2.2 LVRR 预测因素的logistic 回归分析 对差异有统计学意义的因素进行单因素logistic 回归分析,以P<0.05 为标准,从纳入的变量中筛选出TIT、完全血运重建、LVEDV、LVESV、FS、NT-proBNP 峰值、cTnT 峰值、IBil 为影响因素。对上述影响因素进行共线性诊断并筛选共线性因素,LVEDV 和LVESV仅保留LVEDV。将上述影响因素纳入多因素logistic回归分析,结果显示影响STEMI 伴HFrEF 患者LVRR 的独立影响因素为总缺血时间、cTnT 峰值、完全血运重建,其中TIT、cTnT 峰值为危险因素,完全血运重建为保护因素,见表3。
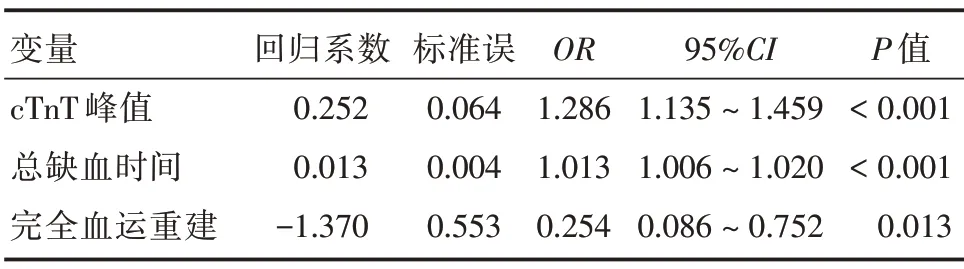
表3 多因素logistic 回归分析Tab.3 Multivariate logistic regression analysis
2.3 ROC 曲线分析及最佳诊断界值 采用logistic回归方程分别计算TIT、cTnT 峰值、TIT 联合cTnT峰值的预测概率,绘制ROC 曲线。结果显示,TIT联合cTnT 峰值的AUC 高于TIT、cTnT 峰值单独的AUC(AUC 分别为0.817、0.737、0.714),差异均有统计学意义(P<0.05)。见图1、表4。
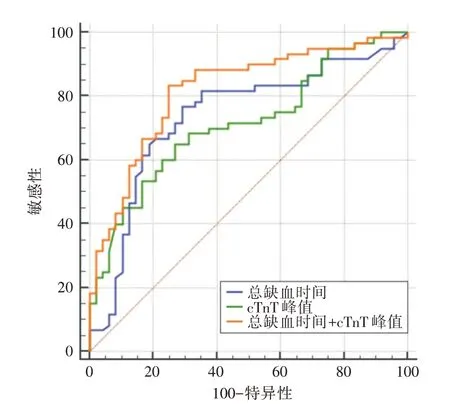
图1 TIT、cTnT 峰值单独及联合的预测价值Fig.1 The predictive value of of TIT and peak cTnT alone and in combination

表4 独立危险因素预测的效能比较Tab.4 Comparison of the predictive value of independent risk factors
3 讨论
STEMI 术后严重左室收缩功能不全(HFrEF)的发生率随着直接PCI 的广泛应用及指南推荐的药物治疗而显著降低。在一项包括2 853 例接受直接PCI 治疗的STEMI 患者的研究中,ABOU 等[3]发现LVEF<40%的发生率为13%。与HFpEF 和HFmrEF 相比,HFrEF 的心血管死亡率较高,预后较差[4-5]。但是,罗瑶等[6]表明射血分数改善的心力衰竭(HFrecEF)的全因死亡率及心血管死亡率低于HFpEF 及HFrEF,GHIMIRE 等[7]发现HFrecEF的心脏移植、全因住院、全因死亡率低于持续性HFrEF,提示左心室逆重构与预后改善密切相关。
肌钙蛋白存在于心肌细胞中,STEMI 患者冠脉斑块破裂,继发血栓性阻塞,引起心肌缺血、损伤或坏死,继而血清cTnT 升高。本研究通过比较LVRR 组与NLVRR 组的cTnT 峰值,发现cTnT 峰值是LVRR 的危险因素,这与DAUW[8]和ABOU[3]的研究结果一致。cTnT 峰值反映心肌梗死面积的大小[9],较大的梗死面积导致更不可逆的左心室功能障碍;较高的cTnT 峰值代表更不可逆的心肌坏死,较低的cTnT 峰值表明更可逆的心肌顿抑[8];且较高的cTnT 峰值与较差的心外膜及组织灌注有关[10],上述原因导致较高cTnT 峰值与STEMI 术后左心室不良重构密切相关。
TIT 为胸痛症状开始至恢复心肌血流再灌注的时间。冠状动脉阻塞导致心肌细胞坏死,心肌坏死是时间依赖性的过程,从心内膜开始延伸至心外膜层,罪犯血管缺血时间延长,导致更大的心肌梗死面积,甚至出现心肌的透壁性坏死[11]。而心肌梗死面积和透壁性心肌坏死直接影响患者的心功能。有研究表明,总缺血时间越长,心力衰竭发生率及全因死亡率越高[12-13]。本研究发现,NLVRR 组的TIT 明显长于LVRR 组,且TIT 是STEMI 术后HFrEF 患者发生左心室逆重构的独立危险因素。因此需要尽量缩短总缺血时间,包括患者自身延误、院前系统延误和院内救治延误,早期、快速并完全地开通罪犯血管是改善LVRR的关键。
有研究表明,高达50%的STEMI 患者有多支冠状动脉病变[14],与单独罪犯血管PCI 相比,包括非罪犯血管PCI 的完全血运重建可显著降低心血管死亡和再发心肌梗死的风险[15-16],但关于完全血运重建的最佳策略和时机仍有争议[17]。本研究显示完全血运重建为STEMI 伴HFrEF 患者左心室重构的保护因素。与单独罪犯血管再通相比,完全血运重建可最大限度恢复心肌灌注,改善非梗死区域心肌的收缩功能,促进STEMI 伴HFrEF 患者左心室重构的发生,同时可显著改善临床结局,包括心血管死亡和再发心肌梗死[18]。因此对于STEMI 患者,除处理罪犯血管外,积极干预非罪犯血管减少左室不良重塑的发生。
综上所述,对STEMI 伴HFrEF 患者,cTnT 峰值、总缺血时间、完全血运重建是发生左心室重构的影响因素,对于较高cTnT 峰值的STEMI 患者,更应尽早给予罪犯血管的干预措施,同时或择期完全血运重建。本研究仍存在一定的局限性,这是一项单中心回顾性研究,且样本量小。研究可能存在未知的混杂因素和选择偏倚影响结果,未来仍需多中心、前瞻性的研究验证。

