莫海威芽孢杆菌对梨腐烂病的抑菌防病效果
刘 龙,荣 华,郑童童,马俊杰,郭庆元,2
(1新疆农业大学农学院,乌鲁木齐 830052;2新疆农林外来入侵有害生物监测预警与综合防控重点实验室,乌鲁木齐 830052)
0 引言
梨为蔷薇科(Rosaceae),苹果亚科(Pomoideae),梨属(PyrusL.)多年生果树。梨树是中国种植范围最广的果树之一[1]。梨树腐烂病菌(Valsa canker of pear)属于黑腐皮壳属,主要危害梨树的主干、主枝和侧枝的树皮,常造成树体病疤累累,枝干残缺不全,甚至造成死树或毁园[2]。梨树腐烂病在新疆库尔勒地区所有梨园都有发生,梨树腐烂病成为影响当地香梨产业健康发展的重要影响因子[3]。目前在生产实践中针对梨腐烂病常用化学防治药剂有苯醚甲环唑类、25%吡唑醚菌酯、43%戊唑醇、2.12%腐植酸铜水剂、43%戊唑醇[4],长期使用化学药剂存在抗药性、农药残留、环境污染等问题,利用具有生物活性代谢物的生防菌对植物进行防治可以替代化学农药,符合绿色农业和可持续发展的理念。芽孢杆菌(Bacillussp.)、假单胞菌(Pseudomonassp.)和链霉菌(Streptomycessp.),已被广泛应用于各种细菌属的生物防治策略[5]。芽孢杆菌广泛的分布于根际土壤中,由于芽孢杆菌对不利环境条件的抗性、对多种病原菌的防治能力以及对植物根系的定殖活性,芽孢杆菌在生物防治方面表现出巨大的潜力,成为国内外生防的研究热点[6-8],莫海威芽孢杆菌(Bacillus mojavensis)就是其中之一。研究表明,大多数的莫海威芽孢杆菌都能产生特定的表面活性剂,如脂肽的衍生物,枯草芽孢杆菌非核糖体合成的环状脂肽类抗生素,伊枯草菌素以及抗真菌活性的水解酶[9-10]。莫海威芽孢杆菌PS17对小麦赤霉病菌(Fusarium graminearum)、尖孢镰刀菌(Fusarium oxysporum)、厚孢镰刀菌(Fusarium chlamydosporum)、豌豆壳二孢(Ascochyta pisi)、链格孢菌(Alternaria alternate)、菌核病菌(Sclerotiniasclerotiorum)、大丽轮枝菌(Verticillium dahliae)、黑附球菌(Epicoccum nigrum)都有抑制效果[12]。因为莫海威芽孢杆菌具有不同拮抗代谢产物谱,可抑制病原菌的种类很广泛,在生物防治方面拥有很大的潜力。目前暂时没有莫海威芽孢杆菌在梨腐烂病方面的研究。本试验将莫海威芽孢菌作为潜力生防菌,通过观察莫海威芽孢杆菌对梨腐烂病菌丝的影响,次生代谢产物对梨腐烂病菌生长的影响,了解胞外酶产生情况,对梨树离体枝条防效测定,初步获得莫海威芽孢杆菌对梨腐烂病菌的抗菌机理,明确其对梨腐烂病的预防和治疗效果,为该菌在梨腐烂病防治研究及其他病害防治研究提供理论依据。
1 材料与方法
1.1 供试枝条、病原菌和培养基
库尔勒当地采摘香梨树1~2年生健康粗细基本一致枝条。3株香梨腐烂病病原菌(Valsa ceratosperma)由新疆农业大学作物病害研究室从库尔勒英下乡,十分场、哈拉玉宫乡香梨树中分离并鉴定,代号为PYX-1、PSF-1、PHL-1。莫海威芽孢杆菌(Bacillus mojavensis)由新疆农业科学院核技术生物技术研究所提供。PDA培养基、LB培养基、蛋白酶培养基、淀粉酶培养基、纤维素培养基、嗜铁素培养基、几丁质培养基:参考文献[13]进行配制。
1.2 平板对峙培养
将3株梨腐烂病菌分别接种于PDA培养基中央,在28℃恒温培养箱培养4天,待病菌铺满培养皿后放入4℃冰箱备用。挑取莫海威芽孢杆菌单菌落在LB固体培养基上,在28℃恒温培养箱培养1天。利用直径6 mm的无菌打孔器分别在3株梨腐烂病平板上打孔获得菌饼,将菌饼放入PDA培养基中央,在距离菌饼中央3 cm四周利用接种环点接莫海威芽孢杆菌,空白对照组接梨腐烂病并点接无菌水,每个处理3个重复,28℃培养,待空白对照病原菌菌落接触培养皿边缘时利用十字交叉法测量菌落直径,计算病原菌菌落生长抑制率,如式(1)。

1.3 莫海威芽孢杆菌对梨腐烂病菌丝形态的影响
在PDA培养基中央放入无菌载玻片,在载玻片上利用移液枪吸取25 mL 50℃左右PDA覆盖在载玻片上,将6 mm的梨腐烂病菌饼PYX-1放在载玻片中央,在载玻片四周边缘放6 mm莫海威芽孢杆菌菌饼,空白对照不放莫海威芽孢杆菌菌饼,每处理3个重复。培养2天观察菌丝形态。
1.4 莫海威芽孢杆菌次生代谢产物对梨腐烂病菌的抑制效果
1.4.1 无菌发酵液的抑菌性 接种莫海威芽孢杆菌于LB培养液中,利用恒温摇床180 r/min,30℃培养36 h,菌液OD600为1.5,将菌液于12000 r/min,离心15 min,收集上清液并用0.22 μm微孔滤膜过滤,4℃冰箱保存待用。将无菌发酵液与PDA按10%,15%、25%、30%、40%配制,空白对照用液体LB代替滤液,将3株梨腐烂病6 mm菌饼分别放于不同浓度培养基中央,每个处理4个重复,28℃培养3天,利用十字交叉法测量菌落直径,计算病原菌菌落生长抑制率,如式(1)。
1.4.2 挥发性产物抑菌作用 参考文献[13]使用双板法进行测定。将3株6 mm梨腐烂病菌饼接种于PDA培养基中央,在另一个相同大小的LB培养基上划线接种莫海威芽孢杆菌,将两者对扣在一起,用封口膜将接触处密封,以未接种莫海威芽孢杆菌的LB培养基作为空白对照,每处理3个重复,28℃培养3天,待对照培养基菌丝铺满培养皿时,分别测量划线接种莫海威芽孢杆菌和对照培养梨腐烂病菌落的直径,计算菌落相对抑制率。
1.5 莫海威芽孢杆菌胞外酶产生情况
将莫海威芽孢杆菌点接到蛋白酶培养基、淀粉酶培养基、纤维素酶培养基,几丁质培养基上28℃培养3天后观察培养基是否透明或者有无透明圈,每个处理5个重复。
1.6 离体枝条测定莫海威芽孢杆菌对梨腐烂病的防效
1.6.1 实验用菌的制备 将莫海威芽孢杆菌挑入无菌蒸馏水中,浓度调至OD600为0.5(菌体浓度约109CFU/mL)作为接种液。梨腐烂病菌PYX-1接种于PDA平板上活化备用。
1.6.2 室内预防性效果测定 香梨离体枝接种方法主要参考刘坤及古丽孜热[14-15]的方法进行并略作调整。将采摘的枝条截成25 cm长,用水清洗干净,在75%酒精中浸泡1 min后冲洗干净,重复3次,晾干后利用固体石蜡两端封口减少水分损失。在枝条中间位置用打孔器(Ф=6 mm)打孔,取约1 cm2灭菌脱脂棉蘸取细菌菌液贴在伤口部位,用保鲜膜固定保湿,48 h后取下,以无菌水接种为对照。在24 h后接种活化好的梨腐烂病菌菌饼(Ф=6 mm)PYX-1,每处理15个重复。将离体枝条放入铺有纱布的铁托盘中,滴入无菌水刚好浸透纱布,盘口覆盖保鲜膜保湿,置于26℃恒温培养箱培养,记录梨腐烂病接种第4天与第7天发病率及病斑面积,发病初期病斑为椭圆斑时按式(2),发病中后期病斑为非椭圆斑时按式(3)测量病斑面积,计算防治效果[式(4)]。后续观察离体枝产分生孢子角情况。

1.6.3 室内治疗性效果测定 接种方式与预防性效果接种方法一致。接种顺序相反,即在中间位置打孔处先接种梨腐烂病,待枝条有明显发病症状后再接种莫海威芽孢杆菌,以接种无菌水为对照,每处理15个重复。记录枝条接种莫海威芽孢杆菌后第3天与第7天病斑长度并计算病斑面积。后续观察离体枝产分生孢子角情况。
2 结果与分析
2.1 莫海威芽孢杆菌对梨腐烂病的拮抗作用
莫海威芽孢杆菌可较强的抑制梨腐烂病菌落的扩展,培养4天后,莫海威芽孢杆菌对梨腐烂病菌丝有强烈的抑制效果,菌丝抑制率为68%。如图1所示。
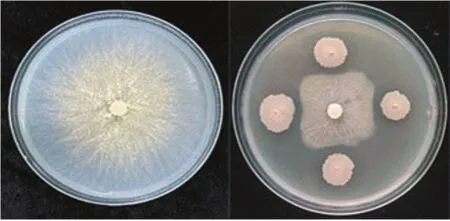
图1 莫海威芽孢杆菌对梨腐烂病菌的抑菌效果
通过光学显微镜可以观察到,正常生长梨腐烂病菌落边缘菌丝量少,看着很稀疏,菌丝呈线性平滑生长。受到莫海威芽孢杆菌抑制的菌落边缘菌丝量大,发出分支较多,看上去较致密,菌丝扭曲,生长明显受到抑制。如图2所示。

图2 莫海威芽孢杆菌对梨腐烂病菌丝的影响
2.2 莫海威芽孢杆菌次生代谢产物对梨腐烂病的抑制作用
莫海威芽孢杆菌无菌发酵滤液对梨腐烂病菌丝生长有明显的抑制效果,随着滤液浓度的增加,菌丝生长被抑制的越明显,如图3所示。

图3 不同浓度无菌发酵液对梨腐烂病菌的抑制作用
当莫海威芽孢杆菌的无菌发酵滤液与培养基混合浓度达到40%时,梨腐烂病菌菌丝的生长完全被抑制,见表1。抑菌回归方程见表2。

表1 滤液对菌丝生长抑制结果

表2 菌丝生长抑制试验
通过双板法实验,表明莫海威芽孢杆菌挥发性物质对梨腐烂病菌具有抑制效果(图4),3株菌株菌丝平均相对抑制率为22.6%。
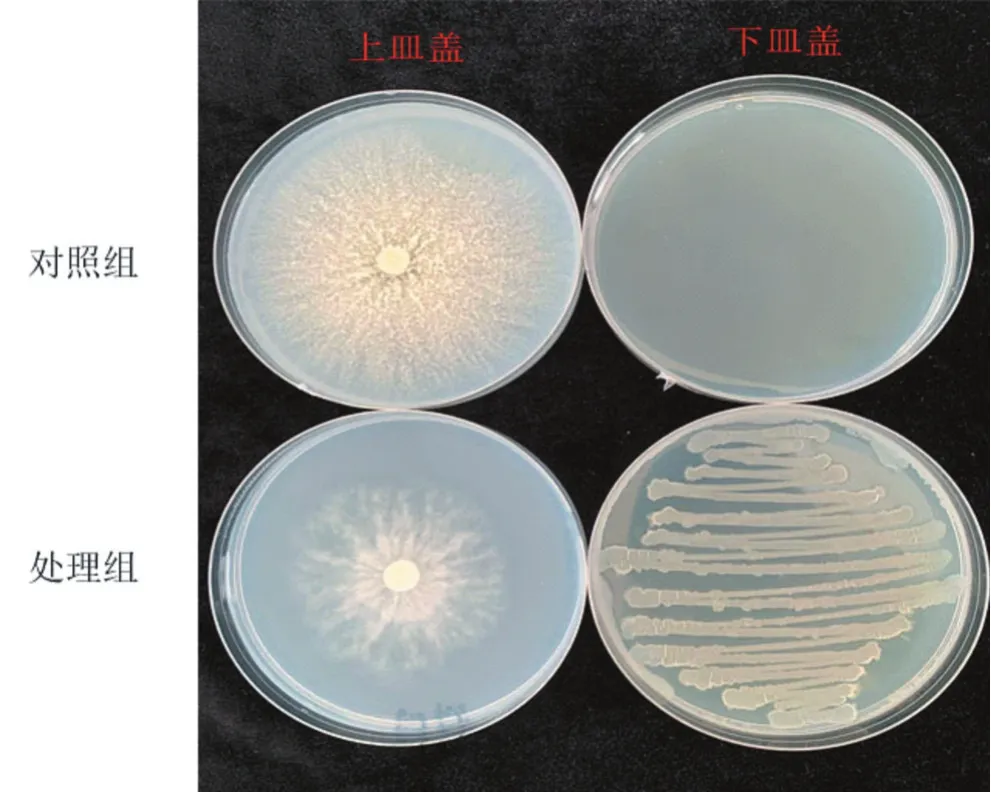
图4 莫海威芽孢杆菌挥发性物质对梨腐烂病菌菌落的影响
2.3 基于莫海威芽孢杆菌拮抗代谢产物种类测定的抗菌机理初步分析
通过平板检测拮抗代谢产物结果显示:莫海威芽孢杆菌可以分解蛋白质、淀粉、纤维素并具有结合Fe3+的能力,但是不能分解几丁质。初步表明莫海威芽孢杆菌可以产生蛋白酶、淀粉酶、纤维素酶和嗜铁素(如图5所示),不产生几丁质酶。所产生的这些酶类都是生防相关酶类物质,可抑制病原菌的生长。嗜铁素可与Fe3+结合,与病原微生物竞争从而达到抑制病原菌生长的目的[16-17]。

图5 莫海威芽孢杆菌拮抗代谢产物检测结果
2.4 莫海威芽孢杆菌对离体枝条防效测定结果
通过预防性试验发现,接种莫海威芽孢杆菌6天,接种梨腐烂病3天,2/3离体枝条发病且病斑面积较小,CK离体枝条基本都发病。莫海威芽孢杆菌接种7天,腐烂病菌接种4天离体枝条与CK离体枝条全部发病,接种梨腐烂病菌4天的防效为52%,接种梨腐烂病菌7天的防效为41.7%,见表3。在接种梨腐烂病第16天,预防枝条与CK枝条基本都产生了分生孢子角。

表3 离体枝实验中莫海威芽孢杆菌对梨腐烂病预防效果
治疗性试验结果表明,莫海威芽孢杆菌接种3天的防效为49%,接种7天的防效为44.6%,莫海威芽孢杆菌对已经被梨腐烂病危害的枝条有一定的治疗效果,见表4。在接种梨腐烂病第16天,CK枝条未产生分生孢子角,治疗枝条80%都产生了分生孢子角,如图6。

图6 治疗离体枝条产分生孢子角情况

表4 离体枝实验中莫海威芽孢杆菌对梨腐烂病治疗效果
3 结论与讨论
新疆冬季寒冷,梨树受冻后易发生腐烂病[18],且目前对于梨腐烂病无单一防效显著的化学药剂,无明显症状却携带梨腐烂病菌[19],这对防治梨腐烂病加大了难度,大量使用化学药剂对其进行防治,不符合农业可持续发展和环保安全的理念。利用自然界中的有益微生物防治植物病害具有无毒、无害、无污染、不易产生抗药性等优点[20]。芽孢杆菌属是目前研究最广泛的生防剂之一,可作为植物根际细菌生长促进剂,在农业可持续发展中作为商品化杀菌剂和生防剂具有很大潜力[21-22]。
目前已报道梨腐烂病生防拮抗菌有芽孢杆菌(Bacillusspp.),贝莱斯芽孢杆菌(Bacillus velezensis),多黏类芽孢杆菌(Paenibacillus polymyxa)等,而未有莫海威芽孢杆菌(Bacillus mojavensis)对梨腐烂病防治的相关报道。刘坤[14]研究的多黏类芽孢杆菌无菌发酵液对梨腐烂病菌丝抑制EC50(v/v)为0.2156,而本试验EC50(v/v)为0.166,无菌发酵液的抑菌效果比其好很多。古丽孜热[15]研究的贝莱斯芽孢杆菌对梨腐烂病离体枝的保护性与治疗性防效分别为77.71%和66.71%,本试验保护性与治疗性防效分别为41.7%和44.6%,影响结果的原因是古丽孜热所用的接种液是发酵液,发酵液中不仅含有生防菌还含有已产生的抑菌物质以及培养基成分,而本试验所用的接种液中仅含有生防菌。现有大量芽孢杆菌产挥发性物质抑菌的报道,宗英[23]研究贝莱斯芽孢杆菌可产挥发性物质,禾烷酮、2-壬酮和2-壬醇抑制禾谷镰刀菌生长,抑制率为27.7%。GOTOR-VILA等[24]研究发现解淀粉芽孢杆菌可产生挥发性物质(1,3-戊二烯、3-羟基-2-丁酮和噻吩)对采摘后樱桃3种病害病原菌Monilinia laxa、M.fructicola和Botrytis cinera具有较好的抑制作用。本试验莫海威芽孢杆菌产生的挥发性物质对梨腐烂病菌丝抑制率为22.6%,但具体物质还需后续研究。在本试验中,治疗离体枝条第16天未产生分生孢子角,而对照80%枝条都产生了分生孢子角,说明莫海威芽孢杆菌可以减缓梨腐烂病的传播,不足之处未记录治疗离体枝条产生分生孢子角时间。试验结果表明,莫海威芽孢杆菌可以产蛋白酶,淀粉酶,纤维素酶以及嗜铁素生防因子,对生防其他病原菌具有借鉴意义。由于梨树腐烂病菌的细胞壁成分主要为几丁质[25],几丁质酶对治疗梨树腐烂病至关重要,试验中发现莫海威芽孢杆菌不能产生几丁质酶,这与DIABANKANA等[12]的试验结果一致,但其实验结果发现莫海威芽孢杆菌产糖苷水解酶家族18蛋白和N-乙酰氨基葡萄糖苷酶,这些是参与几丁质降解的酶,所以莫海威芽孢杆菌在治疗梨腐烂病上具有一定的潜力。通过试验表明莫海威芽孢杆菌对梨腐烂病菌的抑制因子主要来源于代谢产物,现已报道多种生防菌对梨腐烂病菌有拮抗作用,建议今后可以将多种生防菌混合搭配进行防治,探索对梨腐烂病最佳生防效果。
莫海威芽孢杆菌对梨腐烂病保护性与治疗性防效分别为41.7%和44.6%,具有一定的生防潜力,但最大发挥其功效需要其具有很强的抗逆能力,可以在植物组织上大量繁殖及定殖存活,后期还需对莫海威芽孢杆菌在田间梨树上的繁殖及定殖存活能力进行研究,并通过大田试验进一步验证其防治效果。

