不同抗冻保护剂对绵羊精液冷冻保存效果的影响
郝冠英,刘宏涛,王晶晶,白佳琛,刘昱成,石国庆,赵学明,万鹏程*
(1.石河子大学 动物科技学院,新疆 石河子 832000;2.新疆农垦科学院 畜牧兽医研究所,新疆 石河子 832000;3.省部共建绵羊遗传改良与健康养殖国家重点实验室,新疆 石河子 832000;4.中国农业科学院 北京畜牧兽医研究所,北京 100193)
精液冷冻保存技术是指精液储存在超低温条件下,当回到正常的生理温度(37℃)时可以继续发育的一项辅助生殖技术。精液冷冻保存技术在畜牧生产上对提高优良种公畜利用率、优良遗传资源的保存利用、配子低温生物保存技术的研究,以及人类辅助生殖技术的发展都具有十分重要的意义[1]。
目前广泛使用的精液保存方法有低温液态保存和超低温冷冻保存两种[2]。1937年最早报道了绵羊精液冷冻保存[3]。在20世纪70年代绵羊精液冷冻方面的相关报道表明,绵羊精液冷冻后的受胎率为47.9%~57.4%[3]。随着绵羊人工授精技术的普及和发展,到20世纪90年代,精液冷冻保存技术也获得了长足的发展,利用冻精开展人工授精,母羊的受胎率达到60%[3]。
然而,由于家畜精液对外界条件的敏感性和不稳定性,在一定程度上限制了家畜精液冷冻保存技术的发展。为提高家畜精液在冷冻-解冻后的活力和配种母畜受胎率,会在冻精稀释液中添加冷冻保护剂、抗氧化剂、蛋白质及无机盐等营养成分[4]。目前,精液质量检测常采用计算机辅助精子分析仪检测精子活力、活率、直线速率、曲线速率、运动轨迹等[5]。精液在冷冻过程中容易因低温打击形成冰晶,对精子细胞超微结构造成损伤[6],因此普遍在稀释液中添加抗冻保护剂,以降低精子的低温损伤。其中,甘油(glycerinum,相对分子质量为92.10)多年来被作为冷冻保护剂使用[7],以相对分子质量小、渗透性强为优势,但毒性较大。二甲基乙酰胺(DMA,相对分子质量为59.07)相对分子质量更小,渗透性更强[8],更能渗透到精子内部保护精子。本试验在绵羊精液冷冻保护剂中分别添加甘油、DMA及甘油+DMA,测定解冻后精子的活力、活率、直线速率、曲线速率、顶体完整率及DNA完整率等指标,探究不同浓度抗冻保护剂对精液冷冻保存效果的影响,现报道如下。
1 材料与方法
1.1 试验动物及样品的采集
中国美利奴羊(新疆军垦型)公羊12只,平均年龄3岁,体格健壮,膘情较好,无生殖道疾病,生殖、营养、健康等方面状况良好且个体之间无明显差异,体型外貌和生产性能均符合种用标准。采用假阴道法采精,将采出的精液移入1.5 mL离心管中,放入37℃水浴。进行常规检测时,首先观察颜色为乳白色或浅黄色,浓度在1×109/mL,射精量在0.5~1.0 mL,活力在0.8以上可以用于后续试验。
1.2 主要试剂、药品、仪器
卡苏精液冷冻液(KS),购自IMV公司;丙二醇、DMA、Tris、青霉素、链霉素、吉姆萨染液,均购自Solarbio公司;柠檬酸、葡萄糖,均购自Wako公司;TUNEL细胞凋亡检测试剂盒-FITC(100T),购自博士德公司。
绵羊精液冷冻稀释基础液[1.817 g Tris,0.25 g葡萄糖,0.995 g柠檬酸,7.5 mL卵黄,双抗(庆大霉素和青霉素)100 000单位,加水至47.5 mL],为自制。
精子冷冻仪(型号为CL-5500)、迈朗精子分析仪(CASA,型号为SJ-TMDI608)、迈朗一次性精子计数板(型号为ML-CASA 20)、酶标仪(购自赛默飞公司)、水浴锅(型号为HWS24,购自上海恒科宇公司),均来源于新疆农垦科学院省部共建绵羊遗传改良与健康养殖国家重点实验室。
1.3 试验设计
(1)基础液中添加甘油2.0%(G2组)、5.0%(G5组)、8.0%(G8组);(2)基础液中添加DMA 2.0%(D2组)、3.0%(D3组)、4.0%(D4组)、5.0%(D5组);(3)基础液中添加4.0%甘油+1.0% DMA(G4D1组),3.0%甘油+2.0%DMA(G3D2组),2.5%甘油+2.5%DMA(G2.5D2.5组),2.0%甘油+3.0%DMA(G2D3组)。为验证各试验组的效果,采用商品化的成熟绵羊冻精稀释液作为对照组(KS组)判定各试验处理。将配制好的稀释液用0.22μm滤器过滤混匀,4℃保存,备用。
1.4 试验步骤
1.4.1 精液冷冻前准备工作 将采集的镜检活力在0.8以上、质量合格的精子与稀释液按1∶2的比例进行稀释,分组存放。
1.4.2 精液冷冻与解冻 精液冷冻:将稀释的精液装入0.25 mL细管,放入4℃冰箱内平衡70 min。同时准备精子冷冻仪,在5℃时放入细管,进行程序化冷冻(即程序开始运行,初始温度在19.8~20.1℃;倒入液氮后运行70 min左右到5℃;当运行75 min左右温度在-10℃时温度骤降,在90 min时降至-120℃),在90 min后温度降至-120℃时冷冻完毕,将细管精液取出,投入液氮罐中保存。
精液解冻:从液氮中取出细管冻精,快速放入37℃水浴解冻30 s,擦拭干净细管,剪开封口,将精液倒入1.5 mL离心管,按精液稀释液体积比1∶1稀释后混匀,利用计算机辅助精液分析仪检测精子活力,精子密度≥2×109个/mL。
1.4.3 精液质量检测 解冻后精液孵育10 min,轻轻混匀,取10μL解冻后精子放置于精子分析仪专用载玻片上,利用迈郎精子分析仪检测解冻后精子活力、活率、直线速率及曲线速率。其中活精子和死亡精子形态见图1。
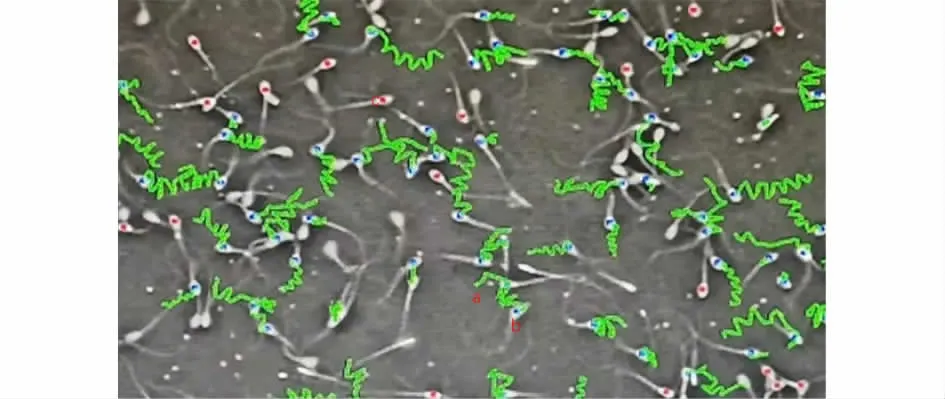
图1 迈朗精液分析仪精液质量检测示意图(20×)Fig 1 .Schematic diagram of semen quality detection of Milang semen analyzer(20×)
1.4.4 精子顶体完整率的检测 采用吉姆萨染色法:吉姆萨染液按说明书进行1∶10稀释,常温保存;取10μL解冻精液于载玻片涂片,等待10~15 min自然风干;甲醛固定15 min,风干后冲洗干净,晾干;用吉姆萨染色液染色2 h,清水冲洗,风干[9-10]。于油镜下随机观察3个视野(n≥200),重复3次,统计顶体完整的染成紫红色的精子数和总精子数比例平均值,计算精子顶体完整率。其中顶体完整和破裂情况观测见图2。
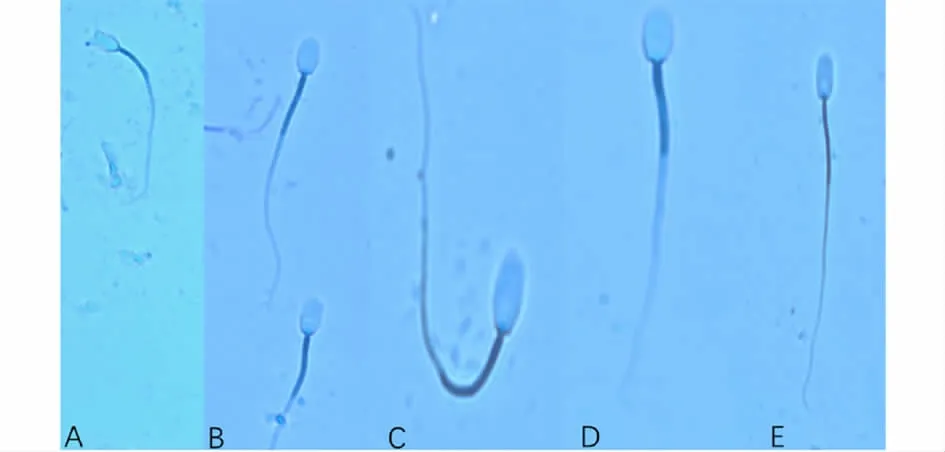
图2 吉姆萨染色的精子顶体形态(100×)Fig.2 Giemsa-stained sperm acrosome morphology(100×)
1.4.5 精子DNA完整率的检测 使用TUNEL细胞凋亡检测试剂盒-FITC:将玻片放入多聚赖氨酸溶液中30 min,至pH值为7.5;精液涂片,晾干,用4%多聚甲醛固定30~60 min;之后用磷酸盐缓冲液(PBS)洗2 min并重复2次;用纯水洗2 min并重复2次;配制标记缓冲液,滴在玻片上20μL,放入湿盒中37℃保存2 h;用TBS洗2 min,重复3次;加封闭液50 μL,室温湿盒保存30 min;用0.01 moL/L TBS洗2 min并重复3次,玻片上加50 μL;用SABC稀释液,放入湿盒中37℃作用30 min;用0.01 moL/L TBS洗5 min,重复4次;DAPI染色5 min,再用纯水洗2 min,重复2次;最后用抗荧光封片剂封片。在400×荧光显微镜波长520 nm下随机选取4个视野(n≥200)观察,精子呈现黄绿色荧光为死亡精子,计数活精子和死亡精子,重复3次,统计精子DNA完整率。精子DNA完整情况判定见图3。
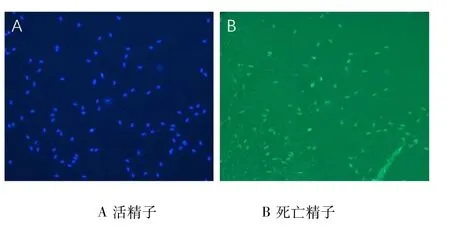
图3 精子DNA完整率(40×)Fig 3.Sperm DNA integrity(40×)
1.5 数据的统计分析
采用SPSS和Excel软件进行数据分析,结果用“平均值±标准差”列出。
2 结果与分析
2.1 不同浓度甘油对绵羊冻精质量的影响
G5组精子活力、活率、直线速率、曲线速率、顶体完整率、DNA完整率显著高于其他甘油组(P<0.05),但显著低于KS组(P<0.05),见表1。
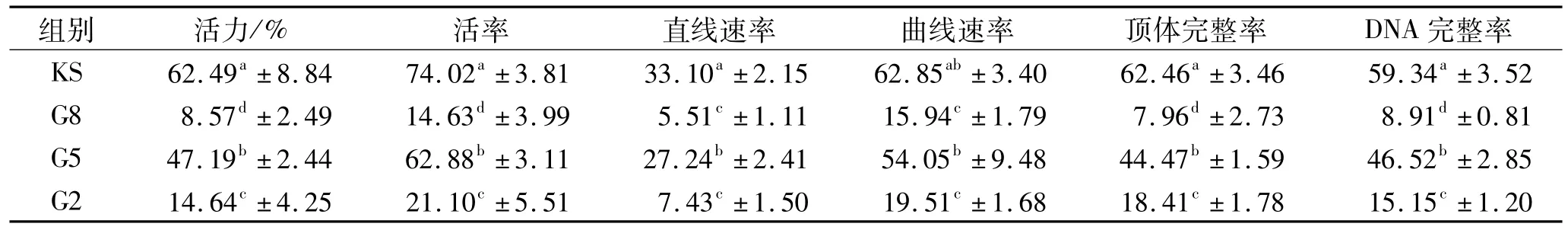
表1 稀释液中添加不同浓度甘油后绵羊冻精质量测定结果Tab.1 Quality determination results of sheep frozen semen after adding different concentrations of glycerol in diluent %
2.2 不同浓度DMA对绵羊冻精质量的影响
D3组精子活力、活率、直线速率、曲线速率、顶体完整率、DNA完整率显著高于其他DMA组(P<0.05),但显著低于KS组(除曲线速率外,P<0.05),见表2。
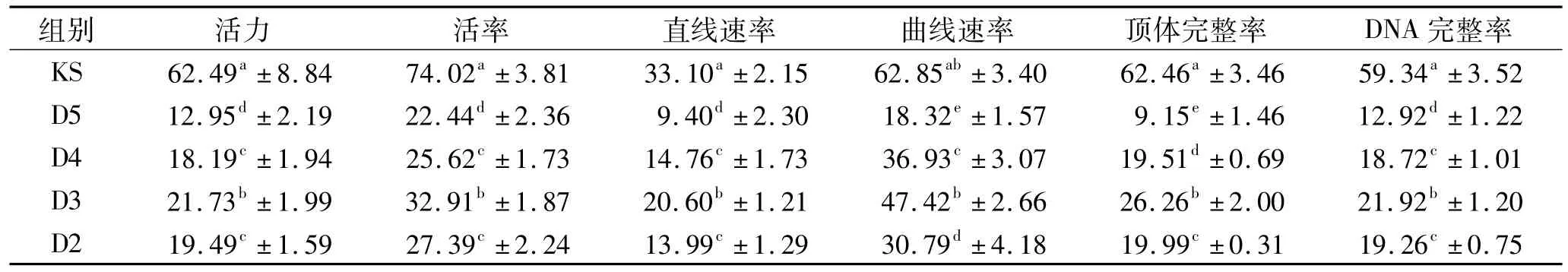
表2 稀释液中添加不同浓度DMA后绵羊冻精质量测定结果Tab.2 Quality determination results of sheep frozen semen after adding different concentrations of DMA into diluent %
2.3 甘油+DMA对绵羊冻精质量的影响
为便于比较,将甘油组和DMA组中精子质量最好的G5组数据与甘油+DMA组一起进行分析。G3D2组精子活力、活率、顶体完整率、DNA完整率略高于G2.5D2.5组,但差异不显著(P>0.05),两组均显著高于G4D1、G2D3组(P<0.05),显著低于KS组(P<0.05);G3D2组直线速率显著低于KS组和D5组(P<0.05),显著高于G4D1组、G2.5D2.5组和G2D3组(P<0.05);G3D2组曲线速率显著低于G4D1组、G2.5D2.5组(P<0.05),显著高于G2D3组(P<0.05),与KS组差异不显著(P>0.05);G2.5D2.5组直线速率显著低于KS组、G5组和G3D2组(P<0.05),显著高于G4D1组、G2D3组(P<0.05),曲线速率与KS组差异不显著(P>0.05),见表3。
3 讨论
3.1 不同浓度甘油对绵羊冻精质量的影响
在稀释液中,甘油是最常见的抗冻保护剂。刘晋津等[11]的研究表明,在猪精液抗冻保护剂中加入4%甘油时,冷冻-解冻后精子活力最佳。宋国欣等[12]的研究表明,在绒山羊精液抗冻保护剂中协同应用海藻糖和甘油,添加1%~2%甘油时的DNA完整率较高,显著高于不添加甘油组。本试验结果表明,绵羊精液冷冻保护剂中单独添加甘油组中,添加5%甘油组的精子活力最高。李晟[13]报道,在公猪精液冷冻保护剂中添加3%甘油,精子解冻效果优于添加5%DMA。本试验结果与前人研究结果有差异,分析原因:一是可能由于基础液不同,导致结果不一致;二是可能由于动物种类不一致导致。P.K.Jha等[14]研究表明,在公羊精液冷冻保护剂中添加5%甘油效果优于添加7%甘油,与本试验结果(添加5%甘油效果优于添加8%甘油)相近。
3.2 不同浓度DMA对绵羊冻精质量的影响
据国内外的研究报道,在鸡[6]、猪[1-2]、牛[7]、鸟类[8]、鱼类[9]、山羊[15]、绵羊[16]上使用DMA保存精液取得了较好的冷冻保护效果。乙酰胺类抗冻保护剂在所有渗透性和非渗透性抗冻保护剂中相对分子质量最小、冷冻毒性最低[10]。研究山羊精液冷冻发现,添加5%DMA时可以减少活性氧(ROS)的形成和活性,改善精子的功能[15]。R.F.Bittencourt等[16]研究表明,在公羊精液冷冻保护剂中添加5%DMA或5%甘油的冷冻效果无明显差异。A.Santiani等[17]发现,在秘鲁帕索马精液中添加3%~5% DMA时冷冻保护效果最佳。张伟[2]的研究表明,添加4%DMA时猪精液冷冻保存的精子活力、顶体完整率最高。郭堂玉等[18]的研究表明,1%DMA替代1%甘油用于公猪精液冷冻,解冻后精子活力更高。本试验结果表明,在绵羊精液冷冻保护剂中添加同为2%、5%DMA和甘油的冷冻效果有明显差异,与前人研究结果有差异。分析原因:一是可能由于基础液不同导致;二是可能由于动物物种不同,精液内含物不一致导致;三是由于DMA渗透性过大,抗冻保护成分大多流入精子内部,致使精子外部没有得到充分的保护,结晶过多导致死亡。
3.3 DMA与甘油联合应用对绵羊冻精质量的影响
G.F.O Menezes等[19]研究表明,在公羊精液冷冻保护剂中添加3.0%甘油+3.0%DMA或4.0%甘油+2.0%DMA时冷冻保护效果较好。本试验中,在绵羊冷冻保护剂中添加3.0%甘油+2.0%DMA与2.5%甘油+2.5%DMA效果相当,均好于其他联合添加组。与G.F.O Menezes等[19]的研究结果接近。M.Anand等[20]的研究表明,冷冻-解冻后精子活力及运动性能检测指数越高,其人工授精的受胎率越高。因此,可以通过测定冷冻-解冻精子活力与运动性能初步断定精子品质。精子不同于一般的体细胞,它是一种高度分化的单倍体雄性生殖细胞,具有独特的形态结构和生殖细胞特性[21]。顶体是呈帽状形态的囊状结构,覆盖在细胞核的前部,精子顶体完整性是判断精子是否有受精能力的重要指标。然而精子顶体极易因所处环境的变化而发生异常,精子颈部受损将会直接影响精子的运动,导致精液品质降低。姜珊[22]的研究表明,精子顶体经吉姆萨染色后可分为五种类型:顶体完整、顶体轻微膨胀、顶体膨胀、顶体部分脱落和顶体全部脱落。徐振军等[23]研究表明,冷冻保存对绵羊精子DNA链的完整性没有显著影响。
本试验中添加3.0%甘油+2.0%DMA的DNA完整率显著高于5%甘油组(P<0.05),添加3.0%甘油+2.0%DMA的顶体完整率与单独添加甘油相比差异不显著(P>0.05)。目前,甘油与DMA互作机制尚未明确,但可以通过现有的研究及结果进行推测。本试验结果表明,甘油与DMA联合互作会显著提高精子活力、膜完整性等相关指标,其作用结果显著优于单独添加甘油。在甘油与DMA联合应用时,甘油含量为2.0%左右时冷冻和解冻后的效果最好。对此进行分析,主要可能因为当仅存在甘油时,精子只能依赖甘油来抵御冷冻损伤,当甘油含量过低时不能在精子外部形成很好的保护膜,而过多的甘油会使精子产生更大的毒性含量;而当存在DMA时,甘油与DMA共同抵御冷冻损伤,所需甘油浓度下降,更高含量的甘油反而会损伤精子质膜,降低精子活力。而适当含量的甘油与DMA联合使用时,利用其渗透性大小的特性,可以同时保护精子的内外部,使精子减少一部分冷冻损伤。
单独添加时,甘油比DMA更适合作为绵羊精液的冷冻保护剂。DMA不能完全代替甘油,但是两者协同作用亦能提高冷冻效果。DMA在稀释液中添加,在精子冷冻-解冻后产生的效果不相同,存在一定的争议,具体机制有待进一步研究。
4 结论
本研究结果表明,在绵羊精液冷冻保存过程中,甘油与DMA通过相互协同作用提高了精子冷冻保存效果。其中当甘油浓度为3.0%、DMA浓度为2.0%时精子冷冻保存效果最佳。

