茉莉酸介导的丛枝菌根真菌诱导植物抗病性研究进展
吕亚茹,严俊鑫,王 菲,谭 怡,蔺吉祥
(东北林业大学园林学院,哈尔滨 150040)
丛枝菌根(Arbuscular Mycorrhizal,AM)真菌是一类土壤中广泛存在的真菌,能与80% 以上陆地植物根系形成共生体[1]。在AM真菌与植物形成的共生体中,植物可将高达20% 固定的碳分配至真菌,AM真菌也将根外菌丝从土壤中吸收的氮、磷等矿质营养元素转运至植物,从而实现“植物-真菌”之间的互惠共生[2]。植物遭受病害时会给农林业带来巨大损失,农药使用不仅带有环境污染、药物残留及植物产生抗药性等问题,还会对植物造成氧化胁迫使植物生长受抑[3],微生物技术作为一种环境友好型技术便成为当下研究热点。研究表明AM真菌能促进植物生长,增强抗氧化代谢,诱导植物次生代谢产物等的积累[4]来增强植物抗病性。因此,了解AM真菌在共生体系中的生态功能及作用机制对于调节植物生长和提高植物抗病性至关重要。
茉莉酸(Jasmonic Acid,JA)作为一种重要的植物胁迫激素,除了广泛参与植物生长发育和抵抗逆境胁迫外,JA还可以缓解植物对农药产生的氧化应激,减少农药残留,增强植物的农药解毒潜力[5]。植物体内JA通过“十八烷途径”合成:亚麻酸经过脂氧合酶(LOX)、丙二烯氧化合酶(AOS)和丙二烯氧化环化酶(AOC)的催化生成12-氧代植物二烯酸(OPDA),OPDA经过氧化物酶(POD)等的还原氧化最终形成JA[6]。大量研究表明接种AM真菌的植物体内JA水平升高且植物抗病性增强[7-9],同时越来越多的研究也证明了JA在AM真菌诱导植物抗病性中起关键作用[10,11]。本文对JA和AM真菌之间的相互关系、AM真菌诱导的植物抗病性、JA在AM真菌诱导植物抗病性中的作用进行综述,为AM真菌应用于植物生产和保护提供一定的参考。
1 茉莉酸与丛枝菌根
1.1 茉莉酸对丛枝菌根形成的影响
内源JA对AM形成尚存在争议。Hilou等[12]和Isayenkov等[13]抑制苜蓿MedicagotruncatulaJA合成途径中AOC基因表达,发现植物内源JA含量显著降低,含丛枝的细胞数量减少,根系AM真菌丰度显著降低,表明JA可能对AM的形成起积极作用。JA缺乏的番茄Solanumlycopersicum突变体接种聚生根孢囊霉Rhizophagusfasciculatus后AM定殖减少[14],然而在接种异形根孢囊霉Rhizophagusirregularis的植物中,JA合成缺陷突变体的番茄菌根定殖率要高于野生型和JA过表达突变型[15],Sanchez-Romera等[16]则发现番茄JA合成受阻对菌根定殖没有影响,在JA合成缺陷的水稻Oryzasativa[17]中也不影响AM定殖。这些结果表明JA对 AM定殖的影响可能与AM真菌和植物种类有关。
外源JA类物质对AM形成的影响大致总结为低浓度促进、高浓度抑制[18]。高浓度JA降低了旱金莲Tropaeolummajus和番木瓜Caricapapaya的菌根定殖率[19],低浓度外源JA促进了大蒜Alliumsativum[20]和苜蓿Medicagotruncatula[21]中的 AM 定殖。但用低浓度 5 μmol/L和高浓度 50 μmol/L的茉莉酸甲酯(Methyl Jasmonate,MeJA)喷施接种根内根孢囊霉Rhizophagusintratadices的番茄均降低了菌根定殖强度和丛枝丰富度[22],而低浓度5 μmol/L的MeJA喷施接种摩西斗管囊霉Funneliformismosseae的番茄菌根侵染率却增加[10]。由此可见,外源JA类物质对AM定殖水平与JA类物质的浓度和种类、植物与AM真菌种类有关,还可能与施加方式、供给时间和处理周期等因素有关。
1.2 丛枝菌根对植物内源茉莉酸积累的影响
多数研究表明,接种AM真菌提高了植物内源JA水平[23],Plett等[24]指出在菌根侵染早期阶段,植物将AM真菌当作外来物种,激活植物免疫系统,诱导植物体内水杨酸(Salicylic acid,SA)水平上升,后期植物识别了AM真菌为有益微生物后SA水平回落,JA水平升高。但也有研究表明,接种单一的AM真菌降低了大白茶Camelliasinensis根系中MeJA的含量[25]。
AM真菌促进植物体内JA水平上升主要表现在空间和时间上,空间上表现为JA应答基因在含丛枝的细胞中表达上调,如接种根内根孢囊霉上调了苜蓿中编码JA合成的前体OPDA、JA信号通路核心调控因子MYC2和编码JA的Zim结构域(JAZ)蛋白基因的表达[26];时间上表现为菌根共生体建立完成后JA合成酶基因表达增强,因此推测含丛枝细胞的数量增加可能会引起 JA水平升高[27]。Hause等[28]发现大麦Hordeumvulgare接种根内根孢囊霉后,AOS和编码JA诱导蛋白(JIP23)基因表达增强,JA水平升高,且从时间上分析转录发生在第一次出现丛枝后的4~6 d,这表明植物体内JA水平可能是在共生前期开始上升。但是也有研究表明JA水平上升发生在共生后期[29],因此AM真菌对JA的调控需要更进一步的研究。关于AM如何促进植物体内JA上升,有研究者曾做出这样的假设:对于菌根植物来说,大量的碳水化合物从地上部汇集到菌根引起渗透胁迫,而糖本身又可以诱导编码 JA生物合成酶基因的表达[30,31],病原菌入侵时引起植物体内JA和糖含量增加,糖增加导致高渗透压,标志JA合成基因的诱导[28]。
2 丛枝菌根真菌诱导的植物抗病性
2.1 丛枝菌根真菌对植物抗病性的影响
Safir等[32]在1968年发现洋葱Alliumcepa接种摩西斗管囊霉能降低土棘壳孢Pyrenochaetaterestris引起的根腐病发病率,首次指出AM真菌能增强植物抗病性。接种AM真菌提高了植物的抗病性(表1),AM诱导的抗病性主要有Ralstonia、Fusarium、Phytophthora、Pythium、Rhizoctonia等属内病原菌引起的病害。除了AM真菌的单独使用外,AM真菌与其他微生物如酵母菌[46]、缬草芽胞杆菌[47]、生防剂Ulocladium atrum[48]、黑外球菌[49]、哈茨木霉[41]及根瘤菌[50]等的联合使用对病害的防治效果优于AM真菌单独接种,揭示了AM真菌与其他微生物互作并提高植物抗病性。
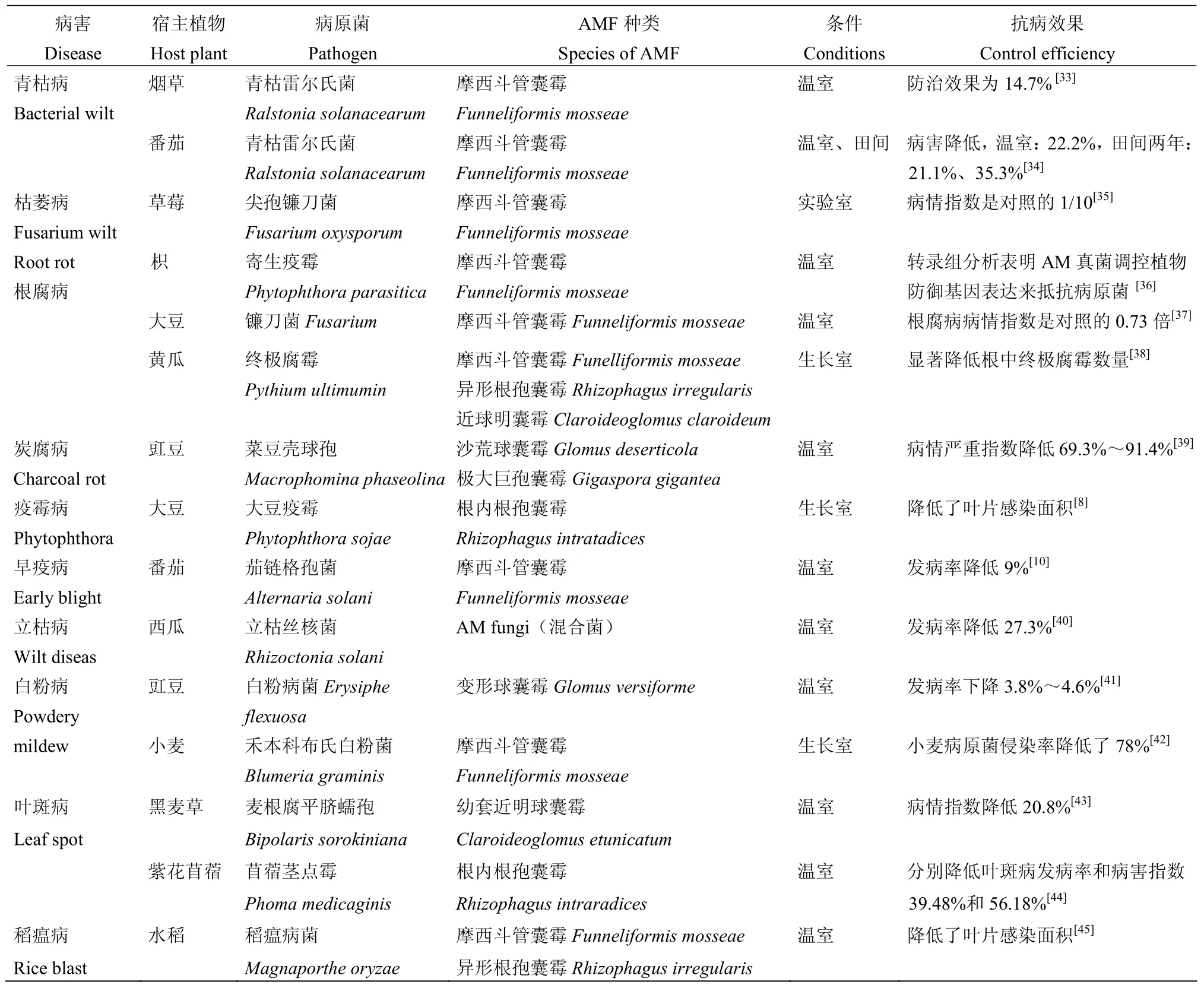
表1 AM真菌诱导的植物抗病性汇总Table 1 The summary of plant disease resistance induced by AM fungi
2.2 丛枝菌根真菌诱导植物抗病性机制
AM真菌与植物形成的共生体可以保护植物抵御病原菌侵染,这可能来自菌根诱导抗性(Mycorrhiza-Induced Resistance,MIR)[51]。关于AM真菌的致病相关分子模式(PAMPs)可能涉及AM真菌“分枝因子”(Myc)与宿主受体之间的相互作用[52]。根据Cameron等[53]提出的MIR时空模型,根系分泌物中一些Myc诱导AM真菌孢子萌发和菌丝分枝并促进其对植物的侵染。AM真菌在侵染过程中与病原菌竞争侵染位点和能源物质[54],根系表皮在遭到病原菌入侵时,细胞壁不断的木质化、硅质化,加大了病原菌的入侵难度[55]。
AM真菌与植物的共生体可以通过表达MIR来保护植物免受病原菌攻击[56,57],虽然MIR的机制尚不完全清楚,但已知MIR是通过防御酶[58]活性增加或病程相关蛋白[59]表达升高介导的。因此AM真菌引起的防御激素水平调节被认为是启动植物增强病原菌防御的重要因素。在AM真菌侵染根皮层时,与生物营养病原体[60]引起的防御反应相似,植物天然免疫系统识别真菌的微生物相关分子模式(MAMPs),触发免疫并产生信号抑制对AM真菌[61]的初始防御反应,由此诱导SA防御和系统获得抗性(Systemic Acquired Resistance,SAR)启动。虽然关于SA对MIR的贡献目前知之甚少,但这个过程对MIR是必需的。在共生关系建立的早期,植物内源SA水平的增加导致植物防御基因表达增加,这些基因随后被抑制,从而导致AM成功定殖[62],这似乎表明在菌根形成早期对SA的抑制是成功定殖的关键。有研究发现在菌根缺陷体(Myc-)的豌豆Pisumsativum中SA积累增强,而在菌根植物(Myc+)中SA积累水平较低[63]或只是短暂的积累[64,65]。SA水平与菌根定殖程度呈负相关,在接种根内根孢囊霉和摩西斗管囊霉的烟草Nicotiana tabacum中,低SA含量的转基因NahG(一种使SA失活的过表达水杨酸细菌羟化酶)植株中菌根定殖率高,侵染细胞和丛枝数量也较多,而在SA含量高的CAS(合成SA)植株中则相反,当最终达到根定殖水平之后,就没有再检测到SA水平的调节作用,因此SA水平升高可能会延迟根系定殖,但不会影响根系定殖的最大程度[66]。
在定殖后期,SA水平回落,宿主植物感知菌根分泌物传递的信号后诱导系统抗性(Induced Systemic Resistance,ISR),产生JA和乙烯(Ethylene,ET)防御[53],由此激活JA途径,因此JA很可能是通过ISR对MIR做出贡献。在研究MeJA在菌根诱导番茄对尖孢镰刀菌抗性表达中的作用时,发现在应对病原菌时菌根和对照植株中SA水平和SA响应基因均有增加,并且系统获得性抗性途径基因NIM1不管有无病原菌侵染,在AM和对照植物中均未表现出差异显著,由此可以判断SA介导的SAR在植物与病原菌交互中不起作用[67]。用水杨羟肟酸(SHAM,JA合成抑制剂)处理菌根番茄后,发现抗性受到了抑制,这说明AM诱导的JA水平升高参与了MIR,而在SHAM处理后SA应答基因PR1在应答尖孢镰刀菌时增加,而在未使用SHAM处理的对照植株中未观察到此类现象,这说明了JA可能抑制了SA的反应,而JA与SA在植物病原菌互作中的拮抗作用之前也被多次验证过[67]。因此,AM定殖产生MIR的机制可能是通过调节内源JA水平和激活JA来实现的,但是JA能否作为菌根诱导ISR的内源信号,尚待进一步研究。
3 茉莉酸在丛枝菌根真菌诱导植物抗病性中的作用
外源施加MeJA不仅恢复了拟南芥ArabidopsisthalianaJA合成缺失突变体对腐霉Pythiummastophorum的抗性[11],还上调了菌根番茄中JA调控的防御基因表达,降低番茄叶片对灰葡萄孢Botrytiscinerea的感染率[68],表明JA可能参与调控AM真菌诱导的植物抗病性。接种AM真菌的番茄受到机械伤害和毛虫取食时产生的防御也受JA调节,这进一步证明了JA在MIR中的重要性[56]。与非菌根植物不同,菌根植物在感受到外界的刺激信号后会先将接收的刺激信号放大[69],然后激活JA途径,JA水平上升,在茉莉酰氨基酸结合物合成酶 1(JA amino acid conjugate synthase 1,JAR1)催化下与异亮氨酸Ile形成茉莉酸-异亮氨酸JA-Ile(Jasmonic acid-isoleucine)复合物并与JA受体F-box家族冠毒素不敏感型蛋白COI1(Icoronatine insensitive I)特异性结合,在E3泛素连接酶SCFCOI1复合物的作用下促使茉莉酸ZIM结构域JAZ(Jasmonate zim domain,JAZ)蛋白泛素化,26S蛋白酶体将其降解释放出MYC2及其他因子,随后启动JA早期应答基因转录[70-74],如机械屏障、酶蛋白、次生代谢产物和信号合成物质等相关基因,由此产生 JA诱导相关防御(图1)。

图1 AM真菌诱导的JA防御Fig.1 The JA defense induced by AM fungi
3.1 诱导形成防御结构
植物叶片毛状体具有重要的防御功能,研究表明接种AM真菌和外源使用JA类物质均可增加植物叶片毛状体密度,且在一定JA浓度范围内毛状体密度与JA浓度呈正相关[75,76]。JA类化合物调节表皮分化,导致毛状体密度增加,如青蒿Artemisiaannua体内毛状体密度与内源JA水平之间表现出强烈的正相关,接种根内根孢囊霉与外源MeJA处理的青蒿体内毛状体密度相近,是对照植物的2倍,而用布洛芬(IBU,JA合成抑制剂)处理后毛状体密度显著降低[77]。木质素作为细胞壁的骨架物质起着强化细胞壁的作用,木质素加大了病原菌入侵和酶降解细胞壁的难度,阻止水分和养分向病原菌运输,为植物提供有效防护[78,79]。JA/MeJA诱导植保素和木质素合成关键酶基因表达,无法合成JA的转基因植物在感病后不能合成植保素,且植保素的关键合成酶基因也未被病原菌所诱导[80]。接种摩西斗管囊霉的草莓Fragariaananassa根系中木质素含量上升,增强了对枯萎病的抗性,但是在矮牵牛PetuniahybridaAM缺陷型vapyrin中抑制了木质素的积累,同时对枯萎病的防御减弱[81]。通过菌根菌丝网络(CMNs)连接的未感染晚疫病原菌Phytophthora infestans的受体马铃薯Solanumtuberosum在供体感染的24 h后,JA/ET依赖性防御基因PR-1b、PAL、ERF3和LOX上调[82]。机械性屏障(如木质素、植保素、植物防卫素等)相关基因PAL1、GST、LOX、CHS、PDF1.2等也受JA调控[18],可见AM真菌可能通过JA介导形成防御结构。
3.2 提高酶活性及合成防御蛋白
AM真菌侵染植物后激活苯丙烷代谢途径[83],苯丙烷代谢途径中的苯丙氨酸解氨酶(PAL)使L-苯丙氨酸转化为反式肉桂酸,产生植物防御素和酚类物质[84]。Cordier等[85]认为菌根植物中邻苯二酚水平增加可以增强植物抗病性。菌根番茄叶片中 PAL活性、苯酚浓度和植物体内的 JA水平呈正相关,因此推测AM真菌可能通过诱导PAL酶产生酚类物质提高植物抗病性,且JA参与该过程[86]。已有研究表明AM真菌侵染植物后激活了防御酶如多酚氧化酶(PPO)、超氧化物歧化酶(SOD)、过氧化物酶(POD)及过氧化氢酶(CAT)等酶活性,而这些酶活性在JA诱导后也会增强[87];另外,用MeJA喷施接种摩西斗管囊霉的JA合成突变体和野生型番茄,番茄体内的POD、PPO和LOX活性显著提高,病情指数降低,但是在未接菌的野生型、接菌未喷施MeJA的JA合成突变体spr2中未发现该类现象。Nair等[88]发现菌根番茄中LOX活性与MeJA含量相关。这些结果共同揭示出AM真菌可能通过JA增强了防御酶活性,进而参与菌根诱导抗性[10]。
在植物激活的防御体系中,除了激活防御酶类保护系统外,还包括病程相关蛋白的诱导,β-1,3-葡聚糖酶和几丁质酶作为重要的PR蛋白通过分解暴露在真菌菌丝尖端的β-1,3-葡聚糖和几丁质参与植物防御[89]。接种摩西斗管囊霉可以促进番茄非菌根化根段中PR蛋白的积累[79],抵御寄生疫霉的侵染。CMNs在番茄间传递早疫病Alternariasolani防御信号,激活了植物防御基因(PR-1、PR-2、PR-3、PAL、LOX),且在JA合成缺陷的番茄中不能诱导该防御反应,说明JA信号通路是必需的[90,91]。许多研究均发现在菌根植物中防御相关蛋白(PR-1,β-1,3-葡聚糖酶,几丁质酶)诱发了对植物病原菌的防御[58,92],而这些蛋白的调控受JA/MeJA诱导[93]。此外,JA还调控病程相关蛋白基因PR1、PR2、PR10等,硫素基因CHI-B、凝集素基因HTA1、几丁质酶基因BJCHI1、蛋白酶抑制剂基因Pin-2等[18]。由此可见,JA可能介导了AM真菌诱导合成防御蛋白增强植物抗病性。
3.3 诱导次生代谢物质合成
AM真菌侵染可促进植物体内JA水平上升,诱导如酚类、萜类、生物碱和黄酮类化合物等次生代谢产物增加,从而增强植物抗病性[31]。PAL是苯丙烷代谢途径中的关键酶,对类黄酮生物合成至关重要,在某些植物中编码PAL的基因受JA调控[93],且这些基因在含有丛枝的细胞中表达量上升,表明AM真菌诱导植物体内黄酮类化合物的形成与JA有关。苯丙烷代谢途径中大多数化合物都具有抗氧化特性,这将保护植物免受活性氧的侵害[94],如香豆酸可以作为抗菌和抗氧化化合物,在菌根植物中含量升高[95]。接种AM真菌能提高根细胞壁结合态酚的含量,而酚类是重要的抗病物质[96]。菌根诱导植物体内酚酸含量增强,这将抑制病原菌活性从而增强防御[77]。经鉴定洋葱中细胞壁结合态酚的主要成分有阿魏酸和对香豆酸,这两种物质在菌根小麦中增加,并且在JA类物质处理的非菌根植物中也会积累,因此推测JA参与AM真菌调节细胞壁结合态酚含量的增加来提高植物抗病性[97]。Maes等[98]在青蒿叶片中鉴定出493个JA诱导的相关基因,且外源JA处理青蒿促进体内青蒿素合成途径相关基因的表达,Mandal等[99]发现具有相似内源JA水平的非菌根和接种根内根孢囊霉的青蒿体内青蒿素浓度相近,而布洛芬处理则导致植物青蒿素浓度下降,这表明青蒿素浓度增加是由增高的JA水平所介导。所以JA作为重要的诱导植物抗病相关次生代谢物质产生的植物激素,可能是AM真菌诱导植物抗病性中的重要媒介。
3.4 诱导调控信号分子
一氧化氮(NO)及过氧化氢(H2O2)等一些信号分子参与了AM真菌诱导的抗病性,多数研究证明NO参与JA诱导的植物对病原菌入侵和伤害胁迫的抗性[100]。NO通过抑制H2O2的产生和蛋白酶基因的表达,成为JA合成的下游介质[101],而在连翘Hypericumperforatum中NO清除剂抑制真菌诱导子诱导的NO和JA生物合成,JA合成抑制剂不影响诱导子诱导的NO的产生,说明JA可能在响应真菌诱导子处理的NO生成的下游起作用[102],由此可见,NO与植物抗逆信号JA之间存在着复杂的关系,有待进一步的验证。NO诱导JA关键酶合成基因、蛋白(如铁蛋白、PR-1)和酶(POD、PAL)的表达,而这些与抗病机制有关[103]。Vos等[104]研究表明菌根番茄诱发的大量防御基因,特别是参与苯丙烷途径和活性氧代谢的基因,诱导了对根结线虫(RNK)病的抗性,这些基因也可能参与NO和(或)JA介导的RNK防御。张艺灿等[105]也发现菌根真菌的菌丝桥传导JA信号并诱导受体植物中NO和激素变化抵御溃疡病菌的危害。接种摩西斗管囊霉诱导了三叶草Trifoliumrepens根中H2O2、NO和SA积累,酚类物质上升,因此AM真菌可能通过 H2O2、NO和 SA信号通路促进了根系酚类物质的合成,提高了植物对病原菌的抵抗力[106],而H2O2的水平也与JA积累有关[107]。此外,NO积极调控JA诱导木质素的过程[108],参与菌根形成及碳氮代谢过程影响植物抗病性[8]。因此,或许在信号分子参与的植物抗病性中也是通过JA介导的。
3.5 茉莉酸与其他激素相互作用
AM真菌诱导植物合成内源激素,通过一种激素主导或多种激素共同作用来提高植株的抗病能力[27]。对于植物防御,水杨酸(SA)主要在营养型病原菌中起作用,而JA主要在坏死型病原菌中起作用,且JA和SA互相拮抗[109],但在接种AM真菌的植株中,二者的关系知之甚少。Ludwig-Muller和Yoram[57]作出这样的假设:植物接种AM真菌之后,生长素(Auxin,IAA)和细胞分裂素类(Cytokinin,CK)促进JA抑制SA,而赤霉素(Gibberellic acid,GA)抑制JA促进SA,ET和SA的瞬时积累会启动植物根部的防御,进而调节菌根定殖,植物接种AM真菌诱导的防御反应与PR蛋白有关,主要的防御激素JA、SA和ET均可诱导PR蛋白的产生,而IAA和CK则抑制PR蛋白的转运,因此PR蛋白或许是连接激素间相互作用的一个交叉点。用枝状镰孢Fusariumvirguliforme侵染接种异形根孢囊霉的大豆,转录组分析发现信号相关基因(IAA、ABA、ET、JA、SA)上调[9],JA与IAA、ET与SA表现出协同作用,而JA与SA并非拮抗关系。在研究接种变形球囊霉对植物抵御立枯丝核菌的侵害时,南美蟛蜞菊Wedeliatrilobata体内的JA和GA含量没有显著变化,ABA含量上升;相同处理下空心莲子草Alternantheraphiloxeroides体内JA和SA水平降低,由此可见,激素在植物防御中的相互作用极为复杂,这可能是由于物种间防御机制的差异性造成的[110]。
植物抵抗病原菌入侵时诱导体内多种激素信号途径激活,JA与多种激素相互作用提高植物抗病性(图2)。如ABA可以诱导JA和ABA途径的共同调节因子MYC2的表达[111]。GA信号的抑制子DELLA通过与MYC2竞争结合JAZ1 蛋白增强了MYC2对下游伤害应答基因转录和对坏死营养性病原体抗性的激活;GA存在,Della蛋白被降解使JAZ和MYC2结合阻断JA信号途径;在DELLA突变体中,MeJA诱导的PDF1.2抗性基因表达不敏感,且抗死体营养性真菌侵染的能力下降[112,113]。在对抗病原菌/病毒侵染时,WRKY70过表达正调节SA对PR的表达增强对活体营养型病原菌抗性,同时负调节MeJA对PDF1.2的诱导减弱对腐生型病原菌的抗性[114]。有研究证实转基因提高了CK水平,引起了JA途径代谢产物OPDA的积累,并且在拟南芥中CK促进对腐生型病原菌的免疫反应[115]。病原菌能诱导ERF1在JA和ET互作中激活植物抗性并调节PDF1.2、b-CHI等抗性基因的表达,ET的增加使细胞对JA或MeJA的响应更加敏感[72];JAZ蛋白负调控EIN3/EIN1转录因子,导致JA调节的转录因子(如ERF1和ORA59)以及ET和JA调节的基因(包括PDF1.2)协同激活[116];而ET通过EIN3/EIN1来减弱MYC2的转录激活活性,抑制JA途径中MYC2介导的伤害应答和对昆虫防御相关基因的表达[117-119]。在病毒侵染中油菜素内酯(Brassinosteroid,BR)信号转导元件直立叶 1(Elf1)降低水稻纹枯病防御反应的正调控因子OsWRKY4的稳定性,而外源JA处理抑制了这种作用;同样在野生型水稻中JA处理上调了OsWRKY4的表达而BR则下调了其表达,所以OsWRKY4参与BR介导的JA反应的抑制[120]。在抗坏死性病原菌中IAA与JA途径也是正相互作用,如拟南芥IAA缺陷突变体比野生型植物更容易受到坏死型病原菌的侵染[121],IAA和MeJA协同诱导防御相关基因PDF1.2和HEL的表达。这些由JA介导的激素之间的互作可能依然存在于AM诱导的植物抗病性中,但有待进一步深入研究。

图2 不同激素信号途径在植物抗病防御中的相互作用Fig.2 The interaction of different hormone signal pathways in plant disease-resistance denfense
4 展望
目前,关于MIR菌根化对植物地上部抗病(病毒、病原菌)防御的诱导尚存争议,其作用机制还不得而知。而AM真菌是否诱导所有植物产生抗病性,诱导产生的系统抗性与局部抗病性之间有什么不同,病原菌、AM真菌和植物种类之间又存在着什么关系,还需结合多组学技术来加以研究。此外,MIR是否可以通过表观遗传延续到下一代也是个有意思但完全未知的课题,有待将来进一步探索。关于JA介导下AM真菌诱导植物防御的作用模式则更需明确,如AM真菌诱导和其他诱导因子激发的JA信号防御有哪些差异,JA信号途径是否在所有的MIR中均起作用,可以通过控制JA水平如使用JA合成或途径特异位点突变体或JA积累型突变体、JA抑制剂、同位素标记等生物技术入手来进一步探讨此类问题。

