吸血性节肢动物共生菌研究进展
刘 岐,高梦波,王金正,刘 馨,孙玮玮,潘保良
(中国农业大学动物医学院,北京 100193)
节肢动物门Arthropoda是动物界最大的一门,全世界约有120万现存种,占整个动物种数的80%。其中,吸血性节肢动物(hematophagous arthropods)由于其特殊的采食行为,可以大规模传播病原体,对畜牧业的发展和人类的健康造成巨大威胁,其中,蚊子和蜱分别是人类疫病的第一大和第二大传播媒介;而蜱又是动物疫病的第一大传播媒介。吸血性节肢动物体内栖息有大量细菌,经过长时间的共同进化,它们与节肢动物形成了各种各样的共生关系。共生菌可为节肢动物宿主提供必需的营养物质,可影响其生长发育、交配、繁殖、代谢等功能;还可以影响宿主的免疫功能,增强宿主自身防御病原微生物、寄生物的能力,保护宿主逃避天敌,避免被寄生或捕食[1]。
一直以来,对吸血性节肢动物的防控主要依赖于化学杀虫剂,但是随着害虫耐药性的增加和环境污染日益加重,生物防治手段已成为研究热点。共生菌与宿主有着特殊的进化关系,在宿主的生命活动过程中发挥重要作用,因此,吸血性节肢动物体内的共生菌在开发害虫新型生物防治方法和防控虫媒传染病方面具有广阔的应用前景。本文简要概述了吸血性节肢动物共生菌的研究进展,重点介绍常见共生菌的生物学功能,以期为以后的研究提供参考。
1 吸血性节肢动物的种类
吸血性节肢动物种类繁多,主要包括吸血性昆虫和蜱螨等。在昆虫纲Insect的34个目中,吸血性昆虫主要隶属于双翅目Diptera、半翅目Hemiptera、虱目Anoplura和蚤目Siphonaptera等4目,只有少数科、属、种的虫种以吸血为生。双翅目吸血昆虫包括10科,分别是蚊科Culicidae、蝇科Muscidae、舌蝇科Glossina、蠓科Ceratopogonidae、蚋科Simuliidae、虻科Tabanidae、虱蝇科Hippoboscidae、白蛉科Phlebotomidae、蛛蝇科Nycteribiidae和蝠蝇科Streblidae[2]。其中,蚊科约有3000余种,我国约300余种,全部吸血;半翅目中的吸血性昆虫主要包括臭虫科 Cimicidae和猎蝽科 Reduviidae,其中,臭虫吸食人血和鸡、兔等动物血液,分布很广泛;虱目包括食毛亚目Mallophaga和吸虱亚目Anoplura,其中,食毛亚目主要食鸟类羽毛,兼性吸食血液及组织液,吸虱亚目吸食血液;蚤目共包括16科,全世界2300多种(包括亚种),我国约有500种,全部吸血[2]。蜱主要包括软蜱科Argasidae和硬蜱科Ixodidae,世界已发现约800多种,我国的蜱类有120余种,均以吸血为生[3]。螨中,革螨亚目Gamasida中的许多螨都是专性吸血性寄生虫,如皮刺螨科Dermanyssidae、巨刺螨科Macronyssidae、蝠螨科Spinturnicidae等[4]。吸血性节肢动物从脊椎动物的血液中获得营养,不仅对宿主造成机械性损伤、贫血、消瘦、发育不良等危害,而且会传播细菌、病毒、原虫、螺旋体、立克次体等多种病原体,对养殖业以及人类的健康造成极大的威胁。如牛羊梨形虫病是以蜱为媒介传播的一种寄生虫病,虫体可在蜱体内繁殖并通过蜱叮咬牛羊传播,动物发病后病情严重,死亡率高,给养殖业造成很大经济损失;登革热是登革病毒经蚊媒传播引起的一种急性虫媒传染病,本病主要在热带和亚热带地区流行,严重危害人类健康;寨卡病毒也是一种通过蚊虫传播的虫媒病毒,感染后常伴随着严重的神经系统并发症,严重威胁人类健康。防控节肢动物是防控这些虫媒传染病的重要环节。
2 节肢动物共生菌的概念和分类
凡是能与节肢动物构建共生关系的原生动物、真菌和细菌等,可统称为节肢动物的共生微生物,其中,能与节肢动物共同生存的细菌称为节肢动物共生菌[5]。
共生菌可定殖于节肢动物体表、体腔、消化道、中肠、后肠、淋巴、脂肪体和其他器官组织的细胞内。根据共生菌在宿主体内的分布和与宿主的进化关系可将其划分为两类:初生共生菌(primary symbionts)和次生共生菌(secondary symbionts)。初生共生菌通常存在于宿主的特定细胞——含菌细胞(bacteriocytes)中,在一些物种中还会形成特化的器官——含菌体(bacteriomes),其感染率很高,与宿主长期协同进化,在宿主的发育和繁殖中行使重要功能,表现出垂直传播模式(母体传递给子代),初生共生菌也被称为专性共生菌[2]。次生共生菌的感染率通常低于初生共生菌,在宿主体内分布比较广泛,大多定殖于宿主体表、体腔、肠腔、盲肠或分散于血淋巴中,与宿主的协同进化关系比较短暂,对宿主的发育和繁殖并非必需,传播模式通常为水平或混合传播,次生共生菌也被称为兼性共生菌[6]。
根据共生菌的定殖部位,可将其分为内共生菌和外共生菌。内共生菌是定殖于节肢动物细胞内的细菌,如沃尔巴克氏体(Wolbachia)是广泛定殖于昆虫细胞内的共生菌;外共生菌是指定殖于健康宿主细胞外的细菌,包括附着于节肢动物肠壁细胞和游离在肠腔的细菌,目前研究最多的外共生菌是肠道菌群[5]。
虽然对节肢动物共生菌的种类有了明确的定义,但值得注意的是,在宿主动物的进化过程中,有些细菌的特征会发生改变,如从兼性共生菌转变为专性共生菌,从病原菌转变为共生菌。一个典型的例子就是Wolbachia。许多年前,Wolbachia被视为一种细胞内寄生菌,对几乎所有节肢动物(螯肢动物、昆虫和甲壳类动物)和线虫的多种适应性相关性状都有负面影响[7];近年来,随着研究的深入,发现Wolbachia属的一些菌株已经和宿主建立起了专性的互惠共生关系,作为一种初生共生菌与宿主共同进化,对宿主的生长发育和繁殖起重要作用[8]。因此,未来研究的一个非常重要的问题是确定一种共生菌在什么情况下会对其宿主产生负面、正面或中性的影响。
3 节肢动物共生菌的研究方法
3.1 共生菌多样性分析
研究节肢动物共生菌多样性最古老的方法是微生物分离鉴定法。传统的细菌分离鉴定法是指通过对细菌的分离、纯化获得细菌菌株的纯培养物,然后通过革兰氏染色、显微镜观察以及生理生化试验,结合菌落特点、形态差异、生理生化特征等,参照《伯杰细菌鉴定手册》及《常见细菌系统鉴定手册》等对分离到的菌株进行分类鉴定[1]。Chavshin等[9]用传统的分离鉴定方法对库蠓Culicoides体内的可培养细菌进行研究,共鉴定出了12个细菌属;Martin和Schmidtmann等[10]用传统方法研究肩胛硬蜱Ixodesscapularis体内需氧菌,发现若蜱体内主要存在革兰阴性球菌,而成蜱体内主要是革兰阴性和革兰阳性杆菌。
大多数研究都是通过分离和培养细菌来研究节肢动物体内的微生物群。然而,自然环境中 99.5%~99.9%的微生物种类至今尚不可培养,因此以纯培养技术为基础对吸血节肢动物体内细菌的鉴定不能完全反映其体内细菌的真实情况,且不能揭示所分离细菌间的系统发育关系。细菌16S rRNA基因在结构与功能上具有高度的保守性,素有“细菌化石”之称,能反映生物物种的亲缘关系,为系统发育提供线索,其可变区能揭示生物物种的特征核酸序列,具有属或种的特异性[11]。目前用于吸血性节肢动物体内共生菌研究较多的是以16S rRNA基因为基础的分子生物学技术,主要有16S rRNA-PCR、16S rRNA序列分析、变性/温度梯度凝胶电泳(PCR-DGGE/TGGE)、限制性片段长度多态性聚合酶链反应(PCR-RFLP)、实时荧光定量PCR(RT-qPCR)等[12],各种技术都有各自的特点和适用性,如表1。

表1 基于细菌16S rRNA基因的分子生物学技术Table 1 Introduction of molecular biology techniques based on bacterial 16S rRNA gene
近年来,随着测序技术的迅猛发展,基于细菌16S rRNA基因可变区的细菌第二代高通量测序技术已经广泛应用于吸血性节肢动物共生菌的研究中,此方法可以检测出群落中极度稀少的微生物,更精确地测定节肢动物体内各类微生物的相对丰度。黄邵军等[19]采用高通量测序技术分析了血蜱属Haemaphysalis和扇头蜱属Rhipicephalus的细菌种群多样性,共检出9个门77个属,居前3位的细菌门依次是厚壁菌门Firmicutes、变形菌门Proteobacteria、蓝藻门Cyanobacteria,其中厚壁菌门为优势菌群,另外,还发现了5种人兽共患病原菌。高通量测序技术可以全面准确地分析吸血性节肢动物体内病原微生物信息,为节肢动物传染疾病的防控和综合监测提供依据。
3.2 共生菌功能研究
研究共生菌对宿主的功能主要有3种方法,一种是选择性地去除特定共生菌,通过比较特定菌去除前后宿主表型的变化来分析共生菌的功能。另一种是对基因组、转录组、蛋白组和代谢组数据进行关联分析,推测特定菌对宿主的功能。此外,对于可体外培养的细菌,可以通过体外生化试验分析其功能[20]。
共生菌的去除方法主要有两种,一种是抗生素处理,另一种是高温或辐照处理。抗生素处理是最常用的去菌方法,通过虫体取食或显微注射,可以有效去除共生菌[20]。给镰形扇头蜱R.haemaphysaloides的血腔中注射卡那霉素,发现柯克斯氏体属Coxiella内共生菌对扇头蜱的繁殖具有重要作用[21]。虽然抗生素处理可以有效去除宿主体内的共生菌,但是,由于现有抗生素的广谱性,缺乏能够选择性去除特定共生菌的抗生素,不能排除非目的菌丰度变化对宿主的影响;所以在用此方法研究共生菌的功能时,要考虑抗生素的使用剂量和共生菌对不同抗生素的敏感度,同时结合传统的细菌培养、qPCR、荧光染色等方法检测抗生素对宿主体内共生菌的去除效果[20]。除了抗生素处理外,高温和辐照也可以去除节肢动物体内的共生菌,有研究表明辐照处理可选择性去除宿主体内的共生菌,如使用γ射线处理舌蝇Glossina后,其体内共生菌线粒体纤原体Sodalis和Wolbachia的丰度下降,而螺原体属Wigglesworthia的丰度不变。但是,有些共生菌对高温的耐受度高于宿主本身,所以这种处理方法可能会影响宿主的适合度,不利于后续研究[22]。
多组学(Multi-Omics)技术是探究生物系统中多种物质之间相互作用的方法,包括基因组学、转录组学、蛋白质组学、代谢组学等。共生菌和宿主之间通过代谢物质进行交流和建立联系,多组学产生的大量数据可以为研究昆虫-共生菌的互作机制提供新思路[20]。如宏基因组测序能全面准确地分析共生菌的多样性和丰度,还可以获得共生菌的基因序列,为共生菌的遗传进化提供最直接的信息,此外,将宏基因组数据和功能数据库进行比对、注释和功能分析,可以推测共生菌的潜在功能;转录组学和蛋白组学适用于研究共生菌去除前后宿主的分子功能变化,进而揭示共生菌对宿主的作用;代谢组学可以通过对共生菌和宿主的代谢物进行定性和定量分析,为共生菌和宿主的代谢过程提供更直接的证据[23]。在测序技术迅速发展的基础上,多组学技术在节肢动物共生菌的研究中扮演着非常重要的角色。
对于一些可体外培养的共生菌,可以通过给培养基中添加某种特殊成分或底物来判定共生菌的功能。有研究用血平板分离埃及伊蚊Aedesaegypti肠道细菌,通过观察溶血圈的产生发现了两种能够有效溶解红细胞、促进埃及伊蚊血液消化的细菌,分别是肠杆菌属Enterobacter和沙雷氏菌属Serratia[24]。也有研究将昆虫共生菌与化学杀虫剂共培养,培养一段时间后,通过检测培养基中杀虫剂的浓度判定共生菌是否具有降解杀虫剂的能力[25],进而研究共生菌与昆虫抗药性的关系。
4 吸血性节肢动物常见共生菌及其功能
吸血性节肢动物的初生共生菌主要包括沃尔巴克氏体Wolbachia、立克次氏体Rickettsia、杀雄菌属Arsenophonus、柯克斯氏体Coxiella、弗朗西斯氏菌属Francisella、螺原体属Spiroplasma、Lariskella、Wigglesworthia、Riesiapediculicola等;次生共生菌主要包括不动杆菌Acinetobacter、Asaia、肠杆菌属Enterobacter、沙雷氏菌属Serratia、葡萄球菌Staphylococcus、线粒体纤原体Midichloriamitochondrii、Pantoea、Pseudomonsa、Sodalisglossinidius等,这些共生细菌感染不同的节肢动物(图1),并在它们体内行使重要功能。
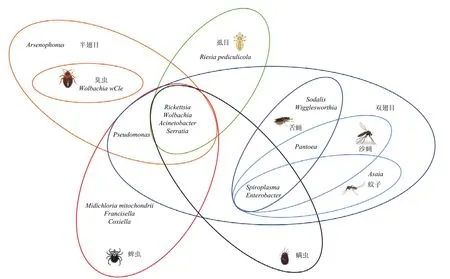
图1 吸血性节肢动物主要共生菌的整体感染情况Fig.1 Overall view of the main groups of the symbionts in haemophagous arthropods
4.1 吸血性昆虫和蜱螨共有的共生菌及其功能
Wolbachia是唯一在所有吸血性节肢动物分类群中均有报道的细菌,但是Wolbachia并不是吸血性节肢动物独有的,研究发现,在 70%的昆虫和一些甲壳类动物(主要是陆生的)、螯齿动物和线虫中都有Wolbachia,它存在于宿主各种组织和器官中,如蜱的唾液腺和肠道、白纹伊蚊Aedesalbopictus的血淋巴中,但最常见的是在卵巢和睾丸等性腺组织中[26]。以前,Wolbachia被认为是一种生殖寄生菌,它会影响节肢动物宿主的生殖性能,如胞质不相容性(cytoplasmic incompatibility):当感染Wolbachia的雄蚊(白蚊伊蚊)与未感染Wolbachia的雌蚊交配后,在胚胎中观察到较高的死亡率[27]。近年来,随着研究的深入,一些Wolbachia菌株的专性共生现象已被报道,如Wolbachia与臭虫的共同进化导致WolbachiawCle菌株的产生,该菌株在感染臭虫时扮演了专性互惠共生的角色。WolbachiawCle存在于雄性和雌性生殖腺附近的含菌细胞中,为臭虫的生长发育提供生物素和核黄素,并参与宿主生殖调控[8]。此外,有研究发现Wolbachia可使其宿主具有抗病毒的特性,可降低甚至清除蚊体内病原体的感染,抑制登革热病毒、黄病毒、疟原虫、丝虫等病原体在蚊虫体内的生长,从而阻断虫媒病的传播[28]。
Rickettsia是节肢动物广泛携带的细菌类群,它感染多种吸血性节肢动物,如体虱、舌蝇、埃及伊蚊、冈比亚按蚊、沙蝇、蜱、螨虫等。Rickettsia在蜱中存在多种共生关系,从致病性到互惠共生。布氏立克次氏体Rickettsiabuchneri是肩胛硬蜱的主要共生菌,主要存在于成年雌蜱的卵巢中,垂直传播,但其在蜱其他生命阶段的组织向性和与蜱生理有关的功能尚不清楚[29]。最近有研究发现布氏立克次氏体还可以在肩胛硬蜱Ixodesscapularis的唾液腺中定殖,这一发现对于诊断和防控蜱传立克次体传染病具有重要意义[30]。猫立克次氏体Rickettsiafelis是人类病原体,存在于冈比亚按蚊的各种器官中,甚至在粪便中也发现此菌,因此,冈比亚按蚊Anophelesgambiae可能是猫立克次氏体的潜在传播媒介[31]。在其他节肢动物如舌蝇、白蛉中也发现了Rickettsia,但是它们的功能尚不清楚。
Acinetobacter是吸血性节肢动物体内分布最广泛的次生共生菌,在吸血性昆虫和蜱螨中都检测到。在蚊子中检测到了多种Acinetobacter,包括醋酸钙不动杆菌A.calcoaceticus、琼氏不动杆菌A.junii、鲍曼不动杆菌A.baumanii、鲁菲不动杆菌A.lwoffi等,其中鲍曼不动杆菌作为医院感染的主要病原,会引起菌血症、肺炎、脑膜炎、腹膜炎、心内膜炎以及泌尿道和皮肤感染。据报道,鲍曼不动杆菌存在于蚊科、沙蝇科、虱科的某些物种中,这些节肢动物是传播此类细菌的媒介[32]。关于Acinetobacter对吸血性节肢动物功能的研究鲜有报道。研究中发现舌蝇中肠的共生菌——肠杆菌Entrobacter、肠球菌Enterococcus和Acinetobacter,可使舌蝇对锥虫的感染率提高三倍,说明Acinetobacter可能影响舌蝇对锥虫的敏感性,或许可以通过重塑舌蝇体内的共生菌感染模式来改变其作为疾病传播媒介的能力[33]。
Serratia是广泛存在于吸血性节肢动物体内的一种次生共生菌,已经从多种节肢动物体内分离到了这类细菌,包括蚊科、沙蝇科、白蛉科、猎蝽科、虱科等。对蚊子中Serratia功能的研究相对较多,Serratia能稳定寄生在蚊子的中肠、雌性卵巢和雄性副腺体,并在蚊子种群中迅速传播。中华按蚊AnophelessinensisWiedemann中肠的Serratia可以激活蚊子的免疫系统,诱导产生多种抗疟原虫效应蛋白,抑制疟原虫在蚊子体内的繁殖[34]。从埃及伊蚊中分离的Serratia具有溶血活性,参与宿主血液消化过程中红细胞的裂解,提高宿主对血液的利用率,进而提高生殖性能[24]。
4.2 蜱特有的共生菌及其功能
Francisella是蜱特有的初生共生菌,未在其他的吸血性节肢动物中发现。从蜱中检测到的类弗朗西斯氏菌内共生体(Francisella-like endosymbiont,FLE)与人畜共患病兔热病的病原土拉弗朗西斯氏菌(Francisellatularensis)具有高度同源性,揭示FLE可能是由病原菌进化而来的。迄今为止,对FLEs的研究大多停留在种类鉴定层面,而对其功能的研究相对较少。有研究从血蜱中鉴定出一种FLE,并评估了这种共生菌的潜在功能,结果表明:在血蜱中FLE感染率为100%,分布于蜱的卵巢、马氏小管、唾液腺和中肠,特别是在雌虫卵巢中出现了较高的密度和规律的种群动态,提示该共生菌可能为雌虫卵巢的正常发育提供必要的营养或调节因子[35]。但是,最近在一项关于钝眼蜱属细菌多样性的研究中发现,FLE是短暂存在的一种共生菌,它与蜱中的其他内共生菌可能存在竞争关系,如类柯克斯氏体内共生体(Coxiella-like endosymbiont,CLE)[36],因此,FLE在蜱体内所起的作用还需要进一步探索。
Coxiella也是蜱特有的初生共生菌,研究发现,类柯克斯氏体内共生体CLE在约2/3的蜱类中都存在。虽然在其他物种中也检测到Coxiella,但是它们与宿主的共生关系没有被确认。CLE与蜱有很长的协同进化历程,与蜱的多种生理活动密切相关。在一项关于美洲花蜱共生菌的研究中发现蜱虫体内CLE的含量对蜱的体质量、卵孵化率及幼虫的存活率都有影响[37]。后来又有一项研究揭示了 CLE影响蜱发育和繁殖的机制,微小牛蜱Boophilusmicroplus体内CLE是一种垂直传播的互惠共生体,通过细菌基因组测序发现了几种与维生素和关键代谢辅因子生物合成途径相关的基因,这些基因可能为蜱宿主提供营养补充[38]。此外,有研究从嗜群血蜱Haemaphysalisconcinna中检测到了CLE,发现在实验室种群的雌蜱和雄蜱中CLE的感染率均为100%;CLE在蜱的各个发育阶段及F1代卵中均有存在,说明CLE在嗜群血蜱中可垂直传播;同时对CLE生物感染位点进行检测,结果表明CLE在嗜群血蜱中的感染具有组织特异性,特异性感染嗜群血蜱的卵巢和马氏管[39]。以上研究均说明 CLE作为蜱的初生共生菌,与蜱共同进化,对蜱的生长发育和繁殖起重要作用。
Midichloriamitochondrii是蜱特有的共生菌,最初是从硬蜱科的蓖麻硬蜱Ixodesricinus体内检测到,对该菌特征和功能的研究大部分集中在蓖麻硬蜱上。Midichloriamitochondrii在雌性蓖麻硬蜱中的感染率为 100%,主要定殖在卵巢细胞的细胞质中并垂直传播给后代,具有入侵和破坏宿主线粒体的独特能力,这种普遍存在的现象说明该细菌在雌蜱的生命活动中扮演着重要角色,但是具体功能有待进一步探索。大多数Midichloriamitochondrii局限于蜱的卵巢,然而,也有研究在蓖麻硬蜱的唾液腺和脊椎动物的血液中检测到此菌,提示该细菌可能作为病原体感染脊椎动物[40]。
4.3 吸血性节肢动物的其他常见共生菌及其功能
Arsenophonus是吸血性节肢动物中分布广泛的共生菌,在半翅目昆虫(锥蝽科、臭虫科)和蜱(蓖麻硬蜱、革蜱)中检测到此类细菌。Arsenophonus最初被认为是寄生在黄蜂体内的一种细菌,对雄性黄蜂的发育有负面影响,通常与性别比例失调有关。在花蜱GenusAmblyomma中,Arsenophonus可垂直传播。在蓖麻硬蜱中分离出了一种与黄蜂体内Arsenophonus几乎相同的菌株,37%的若蜱感染这种细菌,而成蜱的感染率只有3.6%,表明在蓖麻硬蜱的早期发育阶段,这种细菌的感染率很高,因此,可以推测Arsenophonus可能在蜱的适应性或发育中发挥作用,但关于细菌-蜱关系的确切证据需要进一步探索[40]。
Asaia主要感染蚊子,位于宿主的肠道、生殖腺以及唾液腺中,对宿主生长、发育和繁殖起着十分重要的作用。在冈比亚按蚊中,Asaia可以垂直传播并且促进宿主幼虫的发育。抗Asaia单克隆抗体注射到成蚊体内抑制Asaia的生长后,会导致雄性死亡率增加和多种转录组发生变化,说明Asaia对成蚊的生存也至关重要[41];此外,Asaia能同时和疟原虫共生于按蚊的肠道和唾液腺中,可发挥免疫调控作用,激活宿主抗菌肽的表达而自身不受抑制,因此可以对Asaia进行遗传改造,使其宿主产生抗寄生虫分子来降低按蚊传播疟疾的能力[42]。
Wigglesworthia可以感染大多数种类的舌蝇,舌蝇是布鲁氏锥虫(非洲睡眠病的病原)的传播媒介,系统发育分析表明,这种共生菌与舌蝇至少有 5000万年共同进化历程。在舌蝇体内,已经确定了两个主要的Wigglesworthia种群:一种位于雌性前肠中的含菌体中,另一种位于雌性乳腺器官中。舌蝇体内的Wigglesworthia作为一种专性互惠共生菌,影响宿主的繁殖、消化和免疫过程,用抗生素消除雌性舌蝇体内的Wigglesworthia后,繁殖力显著降低,补充维生素后可以部分恢复其繁殖力,说明Wigglesworthia在宿主合成维生素的过程中发挥重要作用[43]。此外,Wigglesworthia对舌蝇免疫系统的正常发育也至关重要,研究发现,如果舌蝇幼虫阶段缺乏Wigglesworthia,发育为成虫后细胞免疫和体液免疫功能受损,编码抗微生物的基因表达降低,容易受到病原菌的攻击[44]。
Sodalisglossinidiusy也是吸血性节肢动物常见的次生共生菌。Sodalisglossinidius最初被鉴定为舌蝇的次生共生菌,广泛分布舌蝇的肠道、唾液腺、淋巴和肌肉等多个组织器官中。将Sodalisglossinidius从舌蝇中去除后,舌蝇的寿命会受到影响,并且会增强舌蝇对锥虫的抵抗力,证明该菌在增强宿主对锥虫易感性方面具有重要作用[45]。最近在一些其他物种(虱蝇、臭虫)中也发现了此类细菌,但是它们的功能尚不清楚[46]。
Riesiapediculicola是体虱的专性内共生菌,位于雄性体虱中肠的细菌细胞、雌性体虱输卵管外侧及卵母细胞极的后部,其主要的传播方式为垂直传播。在关于此细菌对宿主的功能研究中发现Riesiapediculicola在雌性和雄性体虱中都与泛酸的产生有关,而在雌性中感染后对健康卵子的产生和后代的生存有积极影响。基因组分析显示,Riesiapediculicola的基因组在一个短线性染色体和一个环状质粒上编码了不到600个基因,质粒中含有一种泛酸合成所需的独特基因序列,这也证实了它与宿主的密切关系[46]。
Enterobacter是伊蚊、库蚊和按蚊属中常见的肠道共生菌,在疾病传播方面有重要作用。这些菌株可以产生活性氧,活性氧干扰了疟原虫的发育,导致疟原虫在入侵蚊子肠道上皮细胞之前就死亡,使蚊子产生对疟原虫的抗性,阻断疟疾的传播[47]。此外,埃及伊蚊中肠的Enterobacter能产生溶血酶,可以促进吸血后血液的消化[24]。
5 共生菌在防控吸血性节肢动物及其传播疾病中的应用
吸血性节肢动物的共生菌在宿主的发育、繁殖、免疫以及疾病传播过程中扮演重要角色,利用共生菌和宿主的关系,已经建立了一些针对吸血性节肢动物及其传播疾病的生物防治手段。
5.1 基于Wolbachia种群压制技术控制蚊媒传染病
在蚊虫体内,Wolbachia会引起一种称为胞质不相容(cytoplasmic incompatibility,CI)的现象,即感染Wolbachia的雄蚊与未感染的雌蚊或感染不同Wolbachia的雌蚊交配后,雌蚊产的卵在胚胎时期死亡的现象[48]。根据 CI特性,可以建立两种蚊媒传染病的控制策略。一种策略是种群替换,即感染Wolbachia的雌蚊与感染或未感染的雄蚊交配,产生的后代都携带Wolbachia,这就使Wolbachia在整个种群中发生扩散。Wolbachia使蚊子对一系列虫媒病毒产生抗性,包括登革热病毒、黄病毒、寨卡病毒等,因此Wolbachia的传播可以减少甚至阻断病毒通过蚊子传播。另一种策略是种群压制,即感染Wolbachia的雄蚊与其未感染或感染不同类型Wolbachia的雌蚊交配,它们的后代在胚胎时期死亡。通过持续释放感染的雄蚊,从而控制蚊媒种群数量,进而阻断疾病传播[49]。基于上述原理,有许多研究进行了种群压制田间试验,其中,规模最大的一次试验为奚志勇及其团队的一项应用型研究,该研究通过人工培育,释放了经过处理的携带Wolbachia的绝育雄蚊,可以几乎根除防疫区内的野生白纹伊蚊种群,从而实现对于登革热、疟疾等虫媒传染病的防治[50]。
5.2 利用肠道共生菌阻断疟疾的传播
疟疾(malaria)的病原体疟原虫是一种由按蚊传播的寄生虫,通过叮咬人传播。按蚊吸血后,肠道微生物数量迅速增长,特别是革兰氏阴性菌,这些细菌不仅会与疟原虫争夺营养,还会通过产生各种酶、毒素和物理屏障直接对疟原虫产生作用,另外还能够激活宿主的免疫系统产生抗疟原虫效应蛋白,或改变按蚊的代谢,从而影响对疟原虫发育至关重要的各种生物分子的合成。有研究将黏质沙雷氏菌Serratia marcescens和各种肠杆菌科Enterobacter细菌分别与感染疟原虫的血液共同饲喂淡色按蚊,结果仅有1%的按蚊感染疟疾,而无细菌共同饲喂的对照组感染率高达71%,说明这些肠道共生菌对疟原虫有很好的防控效果[51]。
6 小结和展望
迄今,有关吸血性节肢动物共生菌的多样性和功能的研究已经取得了一些进展,但由于节肢动物种类繁多且生活习性多样,关于共生菌和宿主之间的关系以及各种共生菌之间的相互作用了解甚少。早期对共生菌的研究主要依赖传统的微生物分离培养和基于16S rRNA基因的一些分子生物学手段,这些方法可以鉴定出可培养的、丰度较高的细菌,许多不可培养或丰度较低的微生物难以发现,极大地限制了此类微生物的研究。近年来,宏基因组测序技术的发展可以有效弥补传统研究手段的缺陷,有助于深入了解吸血性节肢动物共生菌多样性。
经过长期共同进化,吸血性节肢动物与其体内的共生菌建立了密切的共生关系,它们相互影响,协同进化。共生菌在宿主的生长发育、营养代谢、免疫调节、抵御病原以及生殖调控等方面具有重要作用。在共生菌功能研究中最常用的方法是利用抗生素清除宿主体内细菌,通过对比共生菌清除前后宿主表型变化来确定目标共生菌的功能,但是这种方法存在一定的缺陷,广谱抗生素会清除宿主体内的大部分共生菌,因此,难以排除目标菌以外的其他共生菌对宿主造成的影响。随着分子生物学的发展和宏基因组测序技术的普及,不仅可以明确节肢动物宿主体内共生细菌种类,还可以预测单个共生菌、共生菌间、共生菌种群的相应功能,打破抗生素处理不稳定的研究瓶颈,为共生菌-宿主互作机制的研究提供了更为有效的手段[13]。
关于共生菌在防治吸血性节肢动物及虫媒传染病的应用性研究报道很少。迄今为止,仅有少数几种共生菌被应用到蚊媒传染病的防治中,而大部分研究只停留在实验室阶段,这主要是因为实验室饲养的种群与野外种群体内的共生菌存在很大差异,不同地域种群的共生菌也不相同,这使得吸血节肢动物共生菌研究变得更为复杂。但是,可以确定的是,随着研究的深入,会有更多新的、具有特殊功能的共生菌被发现;随着分子生物学和基因组学技术的发展,关于共生菌与宿主的共生机制和进化机制的研究也会获得新突破,这些成果将在开发新型的生物防控技术中发挥越来越重要的作用。

