退化沙质草地菌根对细根分解过程中营养元素释放的影响
丁杰萍 ,罗永清 ,刘伟春 ,温飞 ,王立龙 ,王旭洋 ,段育龙 ,连杰
(1. 甘肃省生态环境科学设计研究院,甘肃 兰州 730020;2. 中国科学院西北生态环境资源研究院奈曼沙漠化研究站,甘肃 兰州 730000;3. 内蒙古自治区库伦旗农业技术推广中心,内蒙古 通辽 028200)
细根分解是植物-土壤系统物质循环的重要环节,尤其是在低覆盖度植被区,其分解过程中的物质释放是土壤养分的重要来源,为地表植被的生长发育提供了重要的物质基础[1]。例如在退化沙质草地,由于风的活动,叶、茎等地上凋落物存在由低植被覆盖区(流动沙丘和半流动沙丘)向高植被覆盖区(固定沙丘和丘间低地等)运移的现象,这种凋落物的再分配过程严重干扰着地上凋落物向土壤的物质输入[2]。根系存在于土壤之中,受风力搬运以及放牧、火烧等地表活动的干扰较小,同时,由于细根具有快速周转的特性,其分解可向土壤提供持续性的物质输入[3]。已有研究表明,在沙漠化地区,0~20 cm 土层土壤碳含量主要受地下凋落物和地下生物量影响[2-3]。因此,细根分解过程在退化沙质草地生态系统中的物质循环研究中具有重要意义。
目前,细根分解的研究主要集中在非生物因素,如温度、降水[1,4]、放牧、氮磷添加等人类活动[5-8]对细根分解过程中的物质释放规律、分解过程对土壤元素或微生物活性的影响机制等方面[9-11],而对于根区生物要素方面的研究相对较少。菌根真菌(mycorrhizal fungi)作为根区的重要微生物,在植物根系生长发育和植物-土壤系统碳氮循环方面具有重要作用[12]。90% 以上的陆地植物可同菌根真菌形成共生关系,菌根真菌通过丛枝菌根(arbuscular mycorrhizal,AM)、外生菌根(ectotrophic mycorrhiza)、内外生菌根(ecto-endotrophic mycorrhiza)等形式,将植物与土壤环境进行连结,从而提高植物的养分吸收效率[13-15]。大量研究表明,菌根真菌对于植物获取环境中的养分具有重要的作用,然而,其对凋落物分解的影响却经常被忽视[16]。在菌根对细根分解影响的研究方面,已有的研究主要集中在氮素方面,外生菌根真菌并不能有效利用凋落物中的有机氮,而是通过腐生微生物从难分解的有机物中获取氮[17]。而Hodge 等[18]的研究表明,一些丛枝菌根真菌可提高凋落物的分解速率,同时获取分解释放的无机氮,通过对分解产物的有效利用促进菌丝生长。Cheng 等[19]的研究表明,AM 真菌通过对土壤中铵态氮和硝态氮含量的改变加速了凋落物的降解速率。而作为植物生长的必需元素,磷和钾的研究相对不足。另外,菌根对植物-土壤系统物质循环的研究多集中在森林生态系统[13-14],在退化沙质草地的研究相对较少。基于此,本研究以科尔沁沙地植被恢复过程中的先锋灌木差不嘎蒿(Artemisia halodendron)为研究对象,采用内生芯法,开展了菌根对根分解过程中营养元素释放影响的研究,旨在明确细根分解过程中的营养元素释放对菌根的响应机理,为半干旱退化沙质草地生态系统的物质循环研究提供思路。
1 材料与方法
1.1 研究区概况
研究区位于内蒙古自治区东部的通辽市奈曼旗境内(N 42°55′,E 120°42′)。该区位于科尔沁沙地中南部,平均海拔340~350 m,属温带大陆性半干旱气候,冬春季干旱,多大风天气,大风日数20~60 d,夏季多雨,降水主要集中在6-8月,年降水量364.6 mm,为典型的雨热同期型气候。地貌以平缓的流动沙丘、半流动沙丘、固定沙丘、丘间低地和甸子地镶嵌分布为主。优势灌木为差不嘎蒿(A. halodendron)、黄柳(Salix gordejevii)和小叶锦鸡儿(Caragana microphylla),草本优势植物包括黄蒿(Artemisia scoparia)、狗尾草(Setaria viridis)、尖头叶藜(Chenopodium acuminatum)、砂蓝刺头(Echinops gmelini)、冷蒿(Artemisia frigida)、糙隐子草(Cleistogenes squarrosa)、地锦(Euphorbia humifusa)、苦荬菜(Ixeris gracilias)、雾冰藜(Bassia dasyphylla)等。
1.2 试验设计
1.2.1 物种选择 以科尔沁沙地植被恢复过程中的先锋灌木差不嘎蒿为研究对象,其是科尔沁沙地和呼伦贝尔沙地半固定沙丘的优势物种之一,是沙化草地典型的丛枝菌根植物[20]。由于兼具种子繁殖和营养繁殖的特点,且耐沙埋、易分蘖、根系深,其极易在风沙活动强烈的流动和半固定沙丘存活[11,21]。且其还具有强大的分蘖能力,较强的阻沙能力,灌丛下可形成沙堆,有利于其他物种种子的附着[21],因此被广泛运用于区域植被重建[21-22]。在科尔沁沙地植被自然恢复过程中,差不嘎蒿最早出现在流动沙丘,并随着植被的逐渐恢复,取代沙米(Agriophyllum squarrosum)成为优势物种;当恢复到半固定沙丘阶段,其重要值达到最大;此后随植被的进一步恢复,逐渐被大果虫实(Corispermum macrocarpum)、达乌里胡枝子(Lespedeza daurica)等物种替代,到固定沙丘阶段,差不嘎蒿逐渐退出植物群落[23]。
1.2.2 样地建设 本试验样地位于中国科学院奈曼沙漠化研究站植物园内,建设于2012年4月,该区域土壤性质与植被组成和半固定沙丘类似。2012年4月中旬,将样地人为划分为6 块10 m×10 m 的小区,每个小区内按照1 m×1 m 的行间距移栽差不嘎蒿小苗。该小苗于当年4月中旬采集自附近的半固定沙丘,为保证长势一致,挖掘时统一选择株高13~15 cm、茎粗3~5 mm 且无分枝的新生苗,同时挖掘后进行修根处理,保证所有移栽苗根系深度和数量基本一致。移栽苗按照相同深度移栽后浇适量水,并清除苗木周边杂草,同时,为保证成活,在苗木移栽后适时统一补充浇水(共计4 次),在苗木完全成活后停止所有人为干扰。差不嘎蒿自然生长4 a 以后,其长势与野外自然状况下基本一致时开始试验。
1.2.3 处理设计 参照Phillips 等[12]和尹华军等[24]的方法开展本研究。2016年4月,每个小区选取长势一致的 10 株(共计 60 株)差不嘎蒿,在其 1/3 冠幅处沿 120°夹角选取 3个点,分别标记为 a、b、c,并安装直径 100 mm,高400 mm 的PVC 筒,筒上沿与地表一致(图1)。其中a 筒和b 筒于两侧切割开窗,窗口面积为300 mm×90 mm,位于PVC 筒的中间位置,然后分别给窗口固定2 mm 和50 μm 孔径的尼龙纱,c 筒不开窗。a 筒根系和菌根均可自由生长,b 筒仅菌丝体能自由生长,c 筒全封闭。各筒在安装时原位收集挖掘出来的所有土壤,经手动筛检杂质后,将一半土壤回填并均匀按压至筒内200 mm 处,然后将提前准备的装有5.0 g 的差不嘎蒿细根样(于2015年10月下旬采集自附近的半固定沙丘,采集后手动挑选直径<2 mm 的细根,洗净烘干后切割成2.5~3.0 cm 的长段,样品初始元素含量见表1)的凋落物网袋(10 cm×10 cm,网孔直径0.1 mm)水平置于已回填土壤表面,将剩余土壤全部回填,用手按压紧实,保证紧实度与自然状况一致。所有凋落物袋均于2016年5月3 日布设完毕,分解开始后定期观察,及时清除杂草和凋落物。
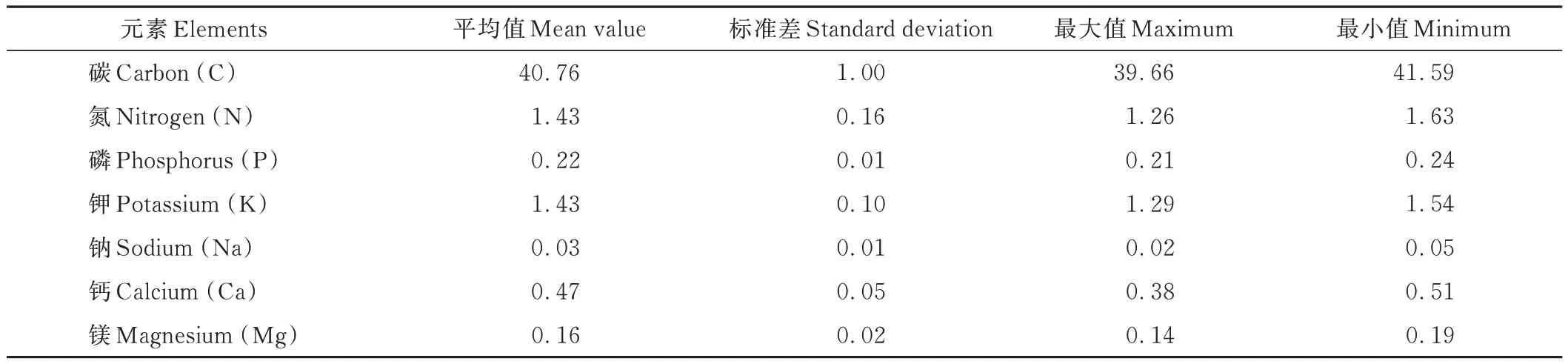
表1 差不嘎蒿细根元素含量本底值Table 1 Initial value of element content in fine roots of A.halodendron(%,n=5)
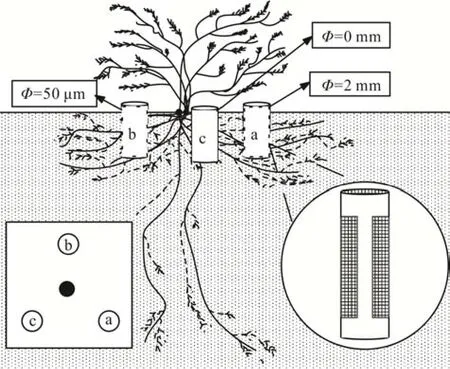
图1 内生芯布设示意图Fig.1 Schematic diagram of installation of the in-growth core
1.2.4 取样与室内分析 分别于2016年6月3 日、8月 3 日、10月 3 日、2017年 5月 3 日以及 2018年 10月3 日,即分解的 1、3、5、12 和 29个月后进行取样。每次每个小区随机选择1~2 株差不嘎蒿植株进行取样。样品取出后带回实验室,用自来水仔细冲洗干净后置于65 ℃的烘箱中烘干48 h,测定完生物量后粉碎,经浓硫酸-过氧化氢溶液消煮后,分别采用凯氏定氮法、钼锑抗比色法和火焰光度法[25]进行凋落物氮、磷、钾的测定。本研究中的降水量和气温数据来源于奈曼站综合气象观测场自动观测数据,该观测场距离本研究样地约200 m,土壤温度(地下20 cm 处)和土壤含水率(地下20 cm 处)数据来源于样地附近(直线距离<50 m)的水碳通量观测场自动观测数据。
1.3 数据处理
本研究中的营养元素残留率计算公式如下:

式中:RR为残留率(%),表示不同分解期后营养元素残留量占分解前总量的比例;IM为分解前的差不嘎蒿细根初始质量(g);IC为各营养元素分解前的初始含量(%);DM为各分解期后的细根质量(g);DC为各分解期后的细根营养元素含量(%)。
本研究中不同处理对营养元素残留率的效应值采用如下公式计算[26]:
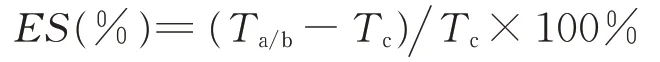
式中:ES为不同处理的效应值,Ta/b为a 筒或b 筒中的营养元素残留率,Tc为c 筒中的营养元素残留率。
采用SPSS 20.0 分析数据,采用二因素方差分析法(Two-Way ANOVA)分析不同处理和时间下差不嘎蒿细根氮磷钾含量的差异性;采用单因素方差分析法(One-Way ANOVA)分析相同处理不同分解期根氮磷钾含量以及相同分解期不同处理间细根氮磷钾残留率的差异性;采用SigmaPlot 12.5 软件作图。
2 结果与分析
2.1 研究期间气候要素
本研究期间的水热状况具有较好的同期性(图2),累计降水154 次,累积降水量1009.4 mm,其中日降水量大于2 mm 的有效降水70 次,累计降水量954.4 mm;日降水量大于25 mm 的强降水事件13 次,最大降水发生于2017年8月3 日,该日降水量为104.2 mm。研究期间平均土壤含水率为3.93%,其中非生长季的较低,约为2%,生长季由于频繁的降水事件,土壤含水率含量较高且波动较大。另外,生长季内的降水、气温、土壤温度以及土壤含水率均维持在较高的水平。

图2 研究期间的气候要素动态Fig.2 Dynamics of climatic factors during the study period
2.2 营养元素含量变化
差不嘎蒿细根分解过程中的氮含量受处理方式、分解时间以及二者的交互效应共同影响(表2)。从分解时间来看,各处理下的氮含量均随分解时间的增加逐渐升高,尤其是在菌根和对照处理下,这种趋势更明显,分解1 a 以后,与初始含量相比较,二者的氮含量分别增加了53.8%和71.0%,而活细根+菌根处理1 a 以后的氮含量仅增加了46.1%(图3a)。另外,不同处理间的差异性分析表明,在分解的前期(分解时间<1 a),各处理间的差异不显著,而当分解时间≥1 a 以后,对照处理的氮含量显著高于其他处理(图3a)。由此表明,在分解后期,菌根的存在显著降低了细根氮含量,这种效应不受活细根的影响。

表2 不同处理和分解时间对差不嘎蒿细根凋落物氮、磷、钾含量的差异性二因素方差分析Table 2 Two-Way ANOVA analysis of the effect of different treatments and decomposition time on A. halodendron fine root litter contents of N,P and K
与氮含量类似,差不嘎蒿细根分解过程中的磷含量也受处理方式、分解时间以及二者的交互效应共同影响(表2)。但与之不同的是,随分解时间的增加,磷含量呈先增后减的趋势,在分解前期,活细根+菌根处理下的磷含量增加幅度较大,在分解的后期(分解时间≥1 a),菌根处理下的磷含量下降幅度较大,显著低于对照,而活细根+菌根处理下的磷含量与对照差异不显著(图3b)。由此表明,菌根的存在显著降低了差不嘎蒿细根磷含量,但这种效应受活细根影响。
与氮含量不同,差不嘎蒿细根分解过程中的钾含量仅受分解时间和处理方式两个单因素影响(表2)。同时,与氮含量的变化趋势相反,随分解时间的增加,细根钾含量呈显著降低的趋势,尤其是在分解初期,钾含量下降更剧烈,与初始含量相比,分解3个月后,3个处理的钾含量分别下降了79.3%、86.1%和86.3%(图3c)。另外,与磷含量类似,在分解的后期(分解时间≥1 a),菌根处理下的钾含量显著低于对照,而活细根+菌根处理下的钾含量与对照差异不显著(图3c)。

图3 不同处理和分解时间下差不嘎蒿细根氮(a)、磷(b)和钾(c)含量Fig.3 Contents of N,P and K in fine roots litter of A. halodendron under different treatments and decomposition time
2.3 营养元素释放特征
差不嘎蒿细根分解过程中的氮释放受处理方式和分解时间两个因素影响,但这两个因素的交互效应对其影响不显著(表3)。在分解的初期,氮的残留率有一定的波动性,即在分解第5个月的氮残留率略高于分解3个月后的样品,说明在该时段差不嘎蒿细根分解过程中有一定程度的氮富集现象。此后,随着分解时间的增加,氮残留量逐渐降低。从各处理间的差异来看,菌根的存在促进了差不嘎蒿细根氮的释放,但在不同时期,这种促进效应存在差异性,在分解3个月和1 a 时,菌根显著促进了氮释放,而在其他取样时期,该效果不显著(图4a)。

表3 不同处理和分解时间对差不嘎蒿细根氮、磷、钾残留率的差异性二因素方差分析Table 3 Two-Way ANOVA analysis of the effect of different treatments and decomposition time on A. halodendron fine root litter mass remaining rate of N,P and K

图4 不同处理下差不嘎蒿细根氮、磷、钾残留率动态Fig.4 Dynamics of A. halodendron fine root litter N,P and K remaining rate under different treatments
与氮残留率相同,差不嘎蒿细根分解过程中磷的残留率受处理方式和分解时间两个因素影响,但这两个因素的交互效应对其影响不显著(表3)。从时间尺度分析,磷残留率在分解的初期与氮类似,也有一定程度的富集现象(图4b),5个月后磷残留率分别较3个月后增加了17.67%(活细根+菌根处理)、10.33%(菌根处理)和3.88%(对照)。从不同处理的效应来看,在分解后期,即分解时间≥1 a 时,菌根的效应值分别为-31.21%和-30.15%,且多重比较结果显示菌根处理下的磷残留率显著低于对照,说明在该阶段,菌根显著促进了磷的释放。而活细根+菌根处理下的磷残留率在分解的各个时期与对照均无显著差异,说明活细根+菌根处理在差不嘎蒿细根分解过程中对磷残留率无影响,由此表明,菌根可显著促进磷的释放,而活细根的存在可消除这种促进效应。
钾残留率与氮磷相同,受处理方式和分解时间两个因素影响,但这两个因素的交互效应对其影响不显著(表3)。但与上述元素不同的是,钾在差不嘎蒿细根分解的整个阶段不仅不存在富集现象,且释放迅速,在分解1个月后,3个处理下的钾残留率分别为38.77%(活细根+菌根)、36.22%(菌根)和34.73%(对照),3个月后,均低于10%(图4c)。另外,与磷类似,在分解时间≥1 a 时,菌根显著促进了钾的释放(分解1 a 和29个月时的效应值分别为-38.37%和-37.87%),同时活细根+菌根处理下的钾残留率与对照差异不显著,由此表明,在分解时间≥1 a 时,菌根可显著促进钾的释放,但这一促进效应受活细根干扰。
3 讨论
菌根显著影响着凋落物的分解以及凋落物-土壤系统的物质循环过程[12-14,26]。已有的研究表明,菌根一方面可通过自身的腐生加速凋落物的分解[27],另一方面,在菌根发育过程中快速生长的菌丝可释放大量的酶或者有机酸,从而促进了凋落物的分解[28]。也有研究表明,菌根对凋落物的分解存在抑制效应,但目前相关机理尚不明确,相关研究主要集中在森林生态系统,且分解材料多为茎、叶等地上器官[13]。有关根系分解以及该过程中根系凋落物营养元素释放对菌根响应过程的研究相对较少。本研究结果显示,菌根的存在可在一定程度促进细根凋落物氮的释放,这与Tan 等[29]的研究结果相似,该研究采用双室试验装置控制丛枝菌根真菌存在与否对凋落物分解的影响,发现丛枝菌根真菌的存在显著加快了凋落物分解速率以及碳氮释放。相关研究发现,菌丝对凋落物氮释放的促进机理有两方面,一是菌丝发育过程中释放的有机酸或酶可促进凋落物氮释放[14,28];另一方面,菌丝体可直接从凋落物中吸收氮素,从而导致凋落物氮含量下降,如N15标记研究结果发现,丛枝菌根真菌的菌丝可直接从凋落物中吸收氮素,从而为菌丝自身以及宿主植物提供氮素,这是菌根促进凋落物氮释放的重要因素[30]。AM真菌从凋落物中吸收营养元素,然后供应自身和宿主生长发育,从而导致凋落物营养元素释放加快,这一结论在很多研究中得到了验证[29-32]。在半干旱沙质草地,氮素是植物生长发育的限制性要素之一,因此,菌根对差不嘎蒿细根分解过程中的氮吸收可能是菌根促进氮释放的重要原因。另外,本研究结果表明,在分解试验的后期(分解时间≥1 a),无论菌根还是菌根+活细根的存在,均显著降低了差不嘎蒿细根凋落物的氮含量(图3a)。由此表明,一方面,对细根凋落物氮含量释放起促进效应的根区要素仅为菌根,另一方面,根系活动,如根际微生物或根系分泌物等过程对菌根的氮释放促进效应没有影响。而氮残留率的结果显示,在分解开始的3个月,菌根的存在也显著促进了差不嘎蒿细根凋落物氮的释放,而该时期菌根对细根凋落物氮含量无显著影响,同时,在分解的第29个月,无论菌根还是菌根+活细根的存在均对差不嘎蒿细根凋落物的氮残留率无显著影响,这可能与分解过程中的生物量变化有关[26]。
本研究结果表明,与氮不同,差不嘎蒿细根分解过程中磷和钾的变化仅在分解1 a 以后产生效应。当分解时间≥1 a 时,菌根的存在显著降低了细根凋落物磷和钾的含量(图3b 和c),同时也降低了二者的残留率(图4b 和c)。据此推断,菌根在生长过程中的物质释放(酶或有机酸)不仅可促进生物量降低或氮释放[14,28],也促进了磷和钾的释放。此外,与氮不同,分解时间≥1 a,当差不嘎蒿活细根与菌根共同存在时,细根凋落物的磷和钾含量(图3b 和c)及残留率(图4b 和c)均与对照无显著差异。由此表明,活细根的存在抵消了菌根对磷、钾释放的促进效应。活细根对细根凋落物分解的影响主要通过土壤含水量、根系分泌物以及根际微生物等过程产生效应[33]。本研究中,无论是活细根+菌根还是单独的菌根存在,土壤含水量均与对照无显著差异[26]。由此推断,可能是根系分泌物的产生或根际微生物活动影响着菌根对磷和钾释放的促进效应,最终导致活细根+菌根处理下氮磷的残留低于菌根处理。该推论仅为野外控制试验对氮磷钾含量变化及残留率动态的观测结果,尚需根系分泌物或根际微生物等相关研究的进一步验证。
4 结论
本研究发现,对于退化沙质草地植被恢复的先锋灌木差不嘎蒿,其菌根的存在显著促进了细根分解过程中的营养元素释放,这种促进效应主要发生在分解的后期(≥1 a)。另外,差不嘎蒿菌根对其细根分解过程中氮释放的促进效应不受活细根影响,而对于磷和钾,活细根的存在抵消了菌根对其释放的促进效应。本研究表明,菌根是影响根系分解过程中营养元素释放的关键要素,在植物根系分解及其与土壤物质周转关系的研究中,尤其是土壤养分贫瘠的退化沙质草地或低植被盖度区应当重点关注。

