文石与方解石在含Cu2+溶液中的界面溶解–再沉淀
唐红梅, 鲜海洋, 朱建喜, 李 琴, 黎建刚, 黄振雄
文石与方解石在含Cu2+溶液中的界面溶解–再沉淀
唐红梅1, 鲜海洋2, 3*, 朱建喜2, 3, 李 琴1, 黎建刚1, 黄振雄1
(1. 江西省科学院 能源研究所, 江西 南昌 330096; 2. 中国科学院广州地球化学研究所 矿物学与成矿学重点实验室/广东省矿物物理与材料开发研究重点实验室, 广东 广州 510640; 3. 中国科学院深地科学卓越创新中心, 广东 广州 510640)
碳酸钙与重金属离子之间特定的界面相互作用, 控制着重金属离子在环境中的固定和转化。然而, 文石和方解石(两种最常见的碳酸钙同质多像矿物)与重金属离子的这种特定界面作用有何异同还不得而知。本研究采用X射线衍射仪(XRD), 原位扫描探针显微镜(SPM)、X射线光电子能谱仪(XPS)和透射电子显微镜(TEM), 对比考察了文石和方解石在含Cu2+溶液中的界面溶解–再沉淀反应。结果表明: (1)文石(110)与方解石(10.4)面在10 mmol/L Cu(NO3)2溶液中溶解后, 表面均生成了≡Ca–OH物种, 但前者的物种含量低于后者; (2)文石与方解石粉末在10 mmol/L CuCl2、Cu(NO3)2和CuSO4溶液中发生溶解–再沉淀, 均产生了孔雀石矿物; (3)文石与方解石粉末在10 mmol/L CuSO4溶液中溶解后形成CaSO4(aq)离子对, 诱导了硬石膏的形成, 说明在含SO2− 4体系中, CaSO4(aq)离子对是调控碳酸钙溶解进程的关键因素。本研究不仅加深了对文石和方解石晶面“构–效”关系的认识, 还有助于理解Cu2+在含不同类型阴离子和碳酸钙的环境中的迁移和固定。
文石; 方解石; 溶解–再沉淀; 含Cu2+溶液
0 引 言
碳酸钙广泛分布于土壤、水体和沉积物中(Morse and Mackenzie, 1990), 其水–岩界面反应控制着重金属离子的迁移与转化(吴宏海等, 2001; 贺婧等, 2015)。前人研究方解石与重金属离子之间的界面反应机理发现, 方解石固定重金属离子的方式主要包括表面吸附、表面溶解–再沉淀和进入矿物晶格形成固溶体(吴宏海等, 1999, 2001), 且方解石对重金属离子固定的稳定性由前往后依次递增。以上3种不同的作用机理, 受重金属离子的浓度和类型共同制约。重金属离子的浓度偏低时, 方解石通过表面吸附聚集重金属离子; 重金属离子的浓度升高后, 它们主要以表面溶解–再沉淀及形成固溶体的方式被固定。此外, 高浓度的Pb2+(Yuan et al., 2016)、Cu2+和Zn2+(Ghizellaoui et al., 2007)主要以形成沉淀的方式固定于方解石表面, 而高浓度的Cd2+则相对更易进入方解石晶格中形成固溶体(Xu et al., 2015)。
虽然前人对方解石型碳酸钙与重金属离子之间的界面反应已有深刻的认识, 但文石作为另一种常见的无水碳酸钙, 它与重金属离子之间的相互作用机制还有待深入研究。已有研究发现, 方解石和文石对不同种类重金属离子的吸附具差异性。例如, 方解石和文石对Zn2+的吸附容量相当, 但方解石对Pb2+的吸附容量大于文石, 而文石对Cd2+的吸附容量大于方解石(Du et al., 2011), 这可能归因于方解石和文石表面与这些重金属离子的配位络合方式不同(Elzinga et al., 2006)。除此之外, 方解石和文石与同种重金属离子的界面反应也存在差异性。例如, 在含Cd2+溶液中, 表面形成的CaCd1−CO3固溶体层能显著降低方解石的溶解速率, 但并不影响文石的溶解速率, 主要是因为CdCO3与方解石的晶体结构相似, 而与文石的晶体结构迥然不同(Cubillas et al., 2005)。方解石归属于碳酸盐矿物中的方解石族矿物, 方解石结构中的Ca2+与CO2− 3组成NaCl的晶体衍生结构, 其中CO2− 3位于NaCl结构中Cl−的位置, Ca2+位于Na+的位置, 方解石中的Ca2+占据八面体的中心位置, 相邻CO2− 3中的O位于八面体的6个角顶, 与Ca相连接形成稳定的八面体结构。文石的矿物学分类为碳酸盐矿物中的文石族矿物, 文石结构中的CO2− 3以六方最紧密堆积方式排列, 每个Ca2+周围含有6个CO2− 3, 与9个O2−配位(潘兆橹, 1993)。因此, 方解石和文石的晶体结构差异, 也可能对其他种类的重金属离子产生不同的界面作用。因此, 文石与重金属离子之间的界面反应还需深入研究。
Cu2+作为自然界中常见的重金属离子, 具有强烈的生物毒性(宋志慧和王庆伟, 2011)。在一些金属加工厂和铜矿氧化带附近的土壤和水体中, Cu2+的含量可达几百甚至上千µg/kg (Kashem and Singh, 1999;王萌等, 2018; Spahić et al., 2018)。这些高浓度的Cu2+可通过食物链富集, 最终危害人体生命健康。因此, 探明广泛分布的碳酸钙与Cu2+的界面反应机理, 有利于深入认识Cu2+的迁移与转化过程, 也为Cu2+的污染控制提供更多的理论依据。
基于前期对方解石在含Cu2+溶液中的溶解研究(Tang et al., 2019), 本文采用X射线衍射仪(XRD)、原位扫描探针显微镜(SPM)、X射线光电子能谱仪(XPS)和透射电子显微镜(TEM), 考察了文石与含Cu2+溶液的界面反应, 并将其与方解石的研究结果进行对比分析。主要探究了文石和方解石在不同类型的含Cu2+溶液(Cu(NO3)2、CuCl2和CuSO4)中反应前后的表面化学环境变化和矿物相转变。
1 实验与方法
1.1 溶液与样品的制备
反应溶液配制: 将一定量的Cu(NO3)2、CuCl2和CuSO4(分析纯, 广州化学试剂)分别溶解在去离子水中配制成溶液。控制溶液的浓度为0~10 mmol/L, 并通过滴加KOH、HNO3、HCl或H2SO4稀溶液, 将体系的初始pH值调至4.5。
块状样品制备: 将冰洲石(无色透明方解石单晶, 产自中国贵州)在去离子水中清洗两遍后用N2吹干, 然后使用干净的手术刀沿方解石晶体的(10.4)晶面轻轻滑动, 可得到方解石的(10.4)新鲜解理面(以下简称(10.4)面, 约2 mm×2 mm×1 mm), 最后用N2吹扫新鲜解理面上的碎屑。将假六方柱状文石单晶(产自摩洛哥)的(110)晶面用黏合剂完全包裹, 以避免切割过程中水溶液对生长晶面的溶蚀。然后先使用金刚石线切割仪(STX-202A, 沈阳科晶自动化仪器有限公司)切下文石的(110)晶面(以下简称(110)面, 约2 mm×2 mm×1 mm), 再使用精研一体机(Leica EM TXP)将切割面抛光, 以便后期样品固定。接着将这些生长面放入装有15 mL丙酮的玻璃容器中, 并使用数控超声波清洗仪超声清洗1 h, 最后用N2吹干样品后储存。然后将备好的方解石和文石晶面样品用石蜡固定在SPM专用的圆形铁片上备用。
粉末样品制备: 将方解石与文石单晶磨碎后过100目分级筛(晶粒尺寸约为147 μm), 然后分别称取3份0.50 g方解石和文石粉末样品于2 mL离心管中, 再使用移液枪向离心管中对应加入1 mL浓度为10 mmol/L的Cu(NO3)2、CuCl2和CuSO4反应溶液, 密封离心管后定期取样分析。
1.2 分析与测试方法
在进行晶面溶解–沉淀实验之前, 将制备好的方解石(10.4)面和文石(110)面, 用Rigaku MiniFlex600 台式XRD进行表征分析, 以确保原始矿物的纯度达到实验要求, 扫描范围为10°~80°, 速度为10(°)/min。
使用布鲁克Multimode 8 SPM观测方解石(10.4)面和文石(110)面的原位溶解–沉淀过程。实验选用J型扫描管(最大扫描范围125 μm×125 μm), 扫描采用接触模式(Contact Mode)。选用力常数为0.06 N/mSi3N4材质的SNL-10探针。实验流程如下: 将固定有样品的圆形铁片置于扫描管样品台中间, 选好样品点后下降样品台, 再把装有O圈、硅胶管及探针的液体池安装到样品上方形成密闭的反应空间, 调整仪器参数后进行空气中的扫描成图。然后抬起探针并用单通道注射泵以550 μL/min的注射速率通入pH值为4.5的去离子水, 再次调整仪器参数后在溶液中扫描成图。在此基础上, 通入配制好的含Cu2+溶液, 进行样品的溶解反应。测试过程中适时调整探针与样品表面的作用力以减小针尖对样品表面形貌的影响。
使用Thermo Scientific K-Alpha XPS测试反应前后样品的表面化学组成。光源为Al K线(1486.8 eV),基准压力值为10−6MPa。XPS谱图信号采集束斑直径为400 μm, 测试参数: 全谱扫描电压100 eV, 步长1 eV;窄谱扫描电压30 eV, 步长0.05 eV。运用Avantage软件分析谱图, 并采用C 1=284.8 eV校准由电荷引起的结合能位移。通过分析方解石(10.4)面和文石(110)面上Ca 2、O 1和Cu 2的XPS信号, 获得表面局域化学环境信息。
使用TEM(FEI Talos F200S, 200 kV)观察方解石与文石粉末在含Cu2+溶液中反应前后的矿物相变化。主要测试内容包括: 扫描透射电镜显微镜图像(STEM)、能谱面扫描(EDS mapping)、高分辨透射电镜显微镜图像(HRTEM)和选区电子衍射(SAED)。
2 结果与讨论
2.1 原始矿物的表征分析
XRD分析结果发现, 文石(110)面与文石标准卡片PDF#41-1475具有相同的特征衍射峰(110)、(122)和(330), 方解石(10.4)面与方解石标准卡片PDF#05- 0586也具有相同的特征衍射峰(104)和(208)(图1a~d),同时, TEM、HRTEM和SAED分析结果也共同证明了原始矿物的物相分别为单一的文石和方解石(图1e~j), 表明实验所使用的文石和方解石均为纯度极高的矿物晶体。
2.2 含Cu2+溶液对方解石的界面溶解调控
前期的研究发现, 方解石(10.4)面在去离子水中的溶解形貌呈菱形四边形(图2a), 在10 mmol/L Cu(NO3)2和CuCl2溶液中的溶解形貌均呈泪滴状(图2b、c), 在10 mmol/L CuSO4溶液中的溶解形貌呈扇形(图2d)(Tang et al., 2019)。此外, 方解石(10.4)面在含Cu2+溶液中的溶解还伴随少许沉淀物生成, 指示了次生矿物的产生。
2.3 不同阴离子类型的含Cu2+溶液与文石的界面反应
利用SPM考察文石(110)面在不同浓度的Cu(NO3)2, CuCl2和CuSO4溶液中的原位溶解, 发现固体界面上均伴随沉淀物的生成(图3~5)。在Cu(NO3)2溶液中生成的沉淀物为它形的固体颗粒, 并且可以观察到表面溶蚀坑的溶解与颗粒沉淀物的生成同步进行(图3)。在CuCl2溶液中生成的沉淀物也为它形的固体颗粒, 当溶质浓度增加至10 mmol/L后, 表面沉淀物迅速发生聚集(图4)。在CuSO4溶液中生成的沉淀物为规则延伸的多边形晶体, 这些晶体均由小颗粒聚集而成(图5)。在以上不同种类的含Cu2+溶液中沉淀出的晶体形貌呈现差异, 表明沉淀物的矿物相极可能不完全相同。
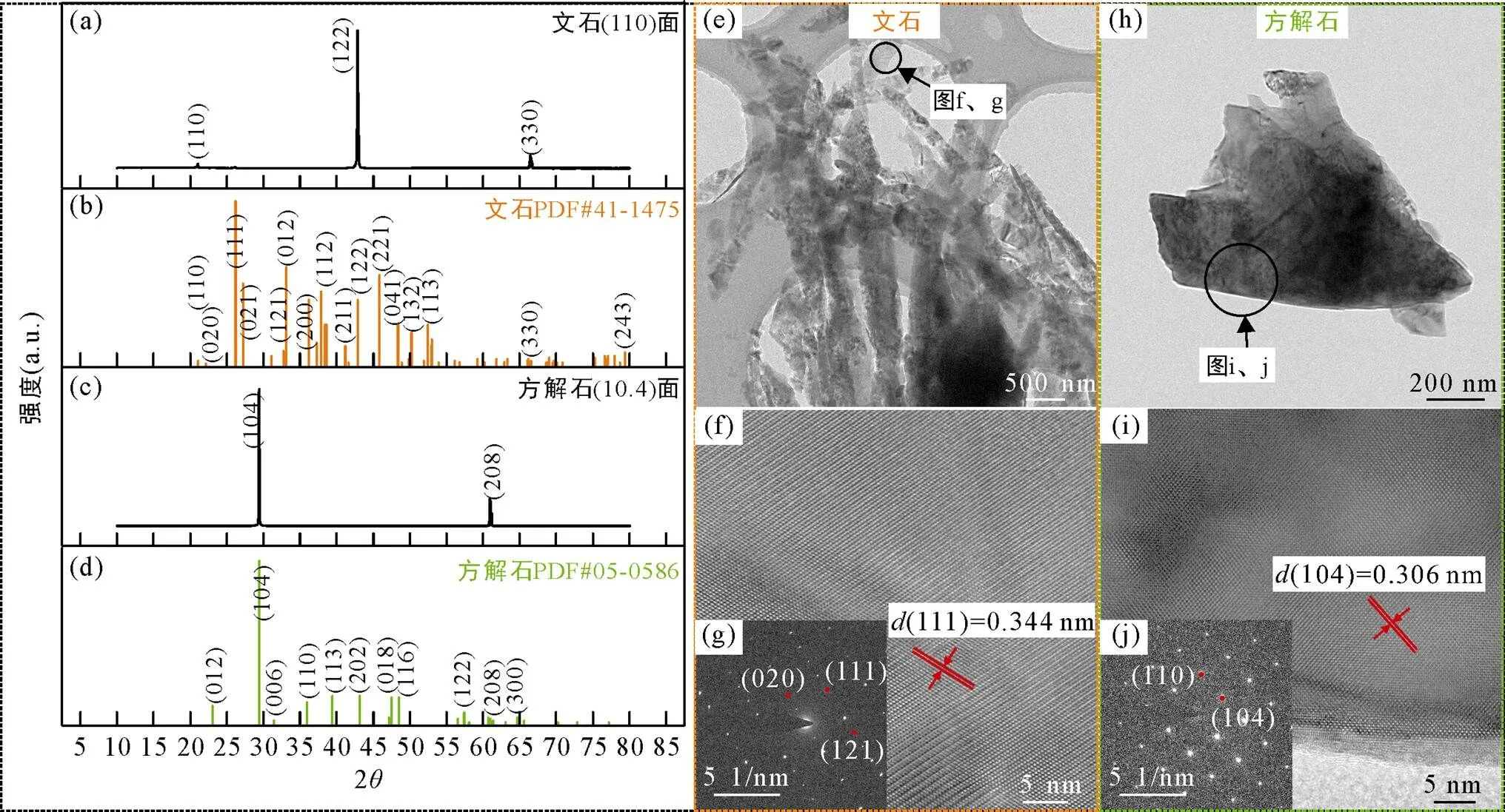
图1 文石(110)面(a),标准卡片PDF#41-1475(b),和方解石(10.4)面(c), 标准卡片PDF#05-0586(d)的XRD图; 文石粉末的TEM(e), HRTEM(f), SAED(g)图和方解石粉末的TEM(h), HRTEM(i), SAED图(j)

图2 方解石(10.4)面在pH=4.5的去离子水和流动的10 mmol/L Cu(NO3)2、CuCl2、CuSO4溶液中溶解的SPM高度图(据Tang et al., 2019)
2.4 文石与方解石在Cu(NO3)2溶液中溶解前后的表面结构变化
对文石(110)面在10 mmol/L Cu(NO3)2溶液中溶解前后进行了XPS分析(图6a~f), 其结果与方解石(10.4)面的现象类似(图6g~l)。文石(110)和方解石(10.4)面在10 mmol/L Cu(NO3)2溶液中溶解前, 均未探测到Cu 2信号(图6c、i); 而它们在该溶液中溶解后, 产生的Cu 2信号完全相同(图6f、l), 表明方解石和文石在Cu(NO3)2体系中溶解后, 产生了相同的含Cu物种(碱式碳酸铜)。此外, 文石(110)面反应前后的Ca 2和O 1信号也发生了明显变化。反应后的Ca 2核能级中出现了更高结合能的新信号(348.9 ± 0.1和352.5 ± 0.1 eV), 表明在文石的(110)面也形成了新的含Ca物种≡Ca–OH(图6d)。类似地, 反应前的O 1核能级信号包含了文石自身结构中的O(531.7 ± 0.1 eV)和表面吸附水中的O(533.8 ± 0.1 eV) (图6b) (Ni and Ratner, 2008), 而反应后的表面出现了新的O化学环境≡Ca–OH(533.2 ± 0.1 eV) (图6e)。Ca 2和O 1信号的变化, 共同指示了文石(110)面产生了与方解石(10.4)面相同的≡Ca–OH物种(Stipp and Hochella, 1991)。
对比文石(110)面和方解石(10.4)面在10 mmol/L Cu(NO3)2溶液中溶解后的表面物种相对含量变化, 发现文石(110)面产生的表面物种与体相物种之比(Ca和O分别为0.040和0.370)小于方解石(10.4)面的比值(Ca和O分别为0.093和0.590)(表1)。由于表面物种≡Ca–OH的含量与Cu2+占据矿物表面≡Ca+空位直接相关(Tang et al., 2019), 故Cu(NO3)2溶液中的Cu2+相对更难占据文石(110)表面上的≡Ca+空位。从文石与方解石晶体结构中Ca配位数来分析(文石中的Ca配位数为9, 方解石中的Ca配位数为6), Cu2+(水合离子中的配位数为6)更易进入后者的近表面结构之中。然而, 可能存在极少部分的Cu2+在文石表面短暂停留, 导致Cu–OH与表面≡Ca+共享–OH。

图3 文石(110)面在pH=4.5的去离子水和不同浓度Cu(NO3)2溶液中溶解的SPM高度图(图e中的溶液状态为流动10 min, 其他的溶液状态均为流动25 min)

图4 文石(110)面在pH=4.5的去离子水和不同浓度CuCl2溶液中溶解的SPM高度图(图d中的溶液状态为流动3 min, 其他的溶液状态为流动10 min)

图5 文石(110)面在pH=4.5的去离子水和不同浓度CuSO4溶液中溶解的SPM高度图(图d、f中的溶液状态为流动3 min, 其他的溶液状态为流动15 min)
Fig.5 SPM height images of the aragonite (110) surface dissolving in deionized water and solutions of different concentrations of CuSO4at pH 4.5
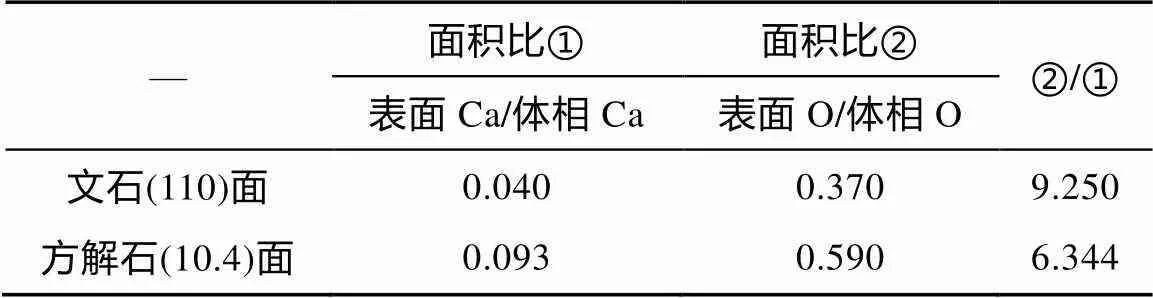
表1 文石(110)和方解石(10.4)面在10 mmol/L Cu(NO3)2溶液中溶解后的表面物种含量对比
2.5 文石与方解石在高浓度Cu2+溶液中的溶解–再沉淀产物
2.6 对Cu2+环境地球化学循环的指示意义
表生环境中的Cu2+具有强烈的生物毒性, 其存在形式受pH值影响较大。在较低的pH值环境中, Cu2+常以离子形态存在, 可迁移性极强; 当环境pH值升高, 便以含Cu2+沉淀的形式被固定(陈坚等, 2015), 可迁移性减弱。由于碳酸盐岩能够有效提升土壤和水体的碱度, 因而Cu2+迁移至富含碳酸钙的环境中时, 其可迁移性和生物毒性将急剧降低。本研究表明, 虽然Cu2+很难进入文石和方解石晶体的深层结构, 但这两种碳酸钙可通过溶解–再沉淀的方式固定Cu2+, 最终生成碱式碳酸铜沉淀。若该环境中同时富含足够的SO2− 4, 还会促进硬石膏的生成, 并进一步加速碳酸钙向孔雀石或蓝铜矿的转化。因此, 文石和方解石与含Cu2+溶液的界面溶解–再沉淀反应, 对降低Cu2+的生物毒性具有重要意义。
此外, 探明文石和方解石在含Cu2+溶液中的反应异同点, 将有助于认识碳酸钙同质多像矿物在含重金属离子溶液中的反应机理。研究发现, 在含Cu2+溶液中, 方解石(10.4)面产生的≡Ca–OH含量高于文石(110)面的≡Ca–OH含量, 但两种体系中生成的含铜次生矿物相同(孔雀石或蓝铜矿)。表明该体系中的文石和方解石在高浓度(10 mmol/L)含Cu2+溶液中的溶解–再沉淀, 均受溶液化学性质影响为主表面结构控制为辅, 且文石受到的表面结构控制弱于方解石。该发现有助于深入认识碳酸钙与重金属离子之间的界面作用, 并为理解Cu2+在富含不同类型碳酸钙的环境中的迁移和转化奠定了理论基础。
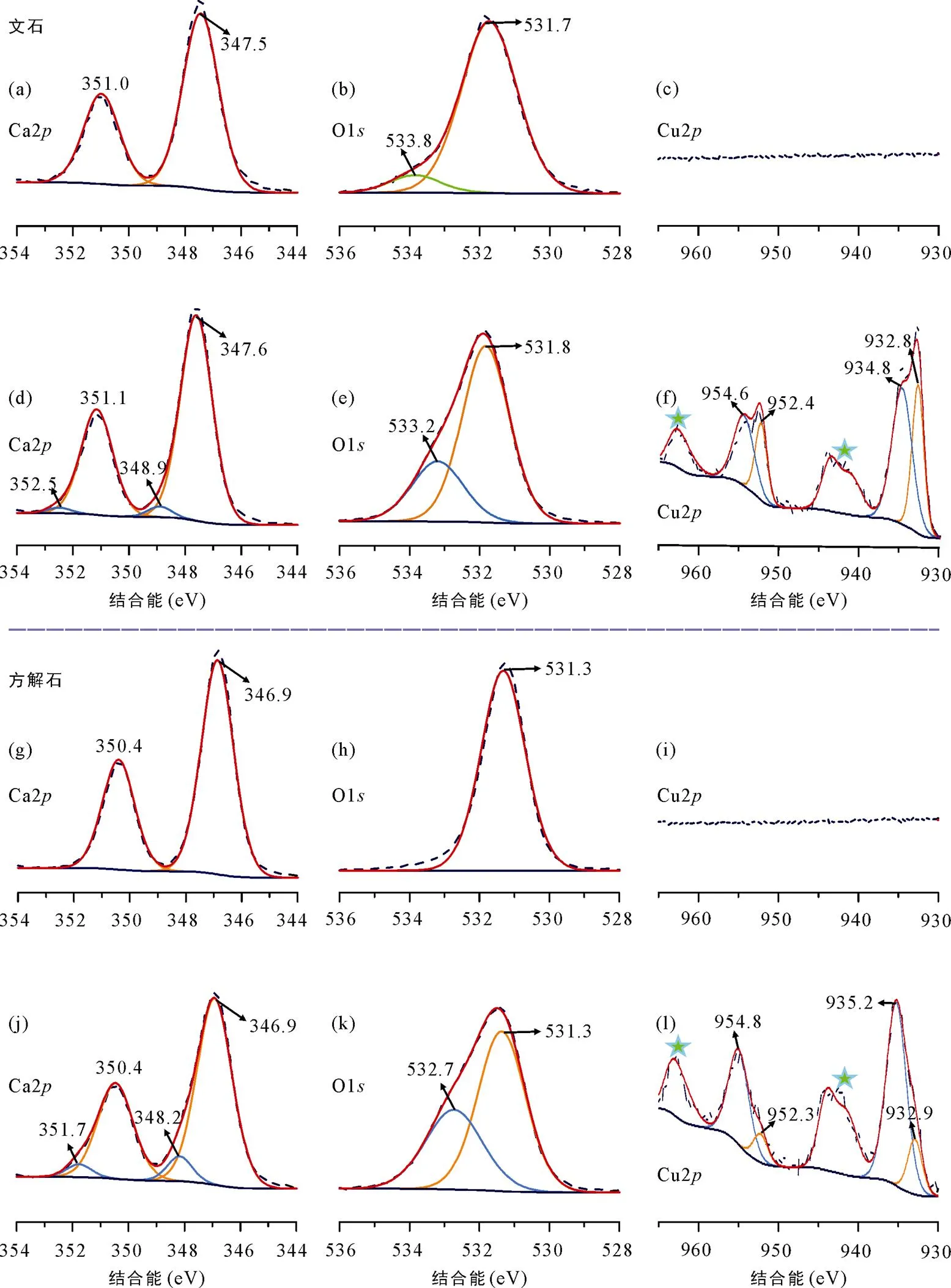
图6 文石(110)和方解石(10.4)面在pH=4.5的10 mmol/L Cu(NO3)2溶液中溶解前的XPS谱图(a~c、g~i)和溶解后的XPS谱图(d~f、j~l)(★表示卫星峰; 方解石的XPS数据引自Tang et al., 2019)

图7 文石在pH=4.5的10 mmol/L Cu(NO3)2溶液中分散 10个月后的STEM图(a)、HAADF STEM-EDS面扫图(b)、HRTEM图(c、d)、和SAED图(e、f)

图8 方解石在pH=4.5的10 mmol/L Cu(NO3)2溶液中分散10个月后的STEM图(a)、HAADF STEM-EDS面扫图(b)、HRTEM图(c、d)和SAED图(e、f)

图9 文石在pH=4.5的10 mmol/L CuCl2溶液中分散10个月后的STEM图(a)、HAADF STEM-EDS面扫图(b)、HRTEM图(c、d)和SAED图(e、f)

图10 方解石在pH=4.5的10 mmol/L CuCl2溶液中分散10个月后的STEM图(a)、HAADF STEM-EDS面扫图(b)、HRTEM图(c、d)和SAED图(e、f)

图11 文石在pH=4.5的10 mmol/L CuSO4溶液中分散10个月后的STEM图(a)、HAADF STEM-EDS面扫图(b)、HRTEM图(c~e)和SAED图(f~h)

图12 方解石在pH=4.5的10 mmol/L CuSO4溶液中分散10个月后的STEM图(a)、HAADF STEM-EDS面扫图(b)、HRTEM图(c~e)和SAED图(f~h)
3 结 论
(1) 在Cu(NO3)2溶液中溶解后, 文石(110)面的≡Ca–OH含量比方解石(10.4)面的≡Ca–OH含量少, 表明Cu2+占据前者表面≡Ca+空位的难度大于后者。
(2) 文石和方解石在不同阴离子类型的含Cu2+溶液中发生溶解–再沉淀界面过程, 伴随次生矿物孔雀石生成, 且在CuSO4溶液中还促进了硬石膏的沉淀。
(3) 文石和方解石在CuSO4溶液体系中均生成了硬石膏, 说明溶液体系中生成的CaSO4(aq)离子对, 是促进碳酸钙溶解的重要因素。
(4) 文石和方解石在高浓度(10 mmol/L)含Cu2+溶液中的溶解–再沉淀过程, 均受溶液化学性质影响为主、表面结构控制为辅, 且前者受到的表面结构控制弱于后者。该研究不但加深了对碳酸钙表面结构与反应性之间的认识, 还有助于进一步理解Cu2+在环境地球化学中的迁移、转化和归趋。
致谢:西南科技大学孙红娟教授和另一名匿名审稿专家对本文提出了宝贵的修改意见, TEM测试工作得到了中国科学院广州地球化学研究所杨宜坪博士的大力支持, 在此表示衷心感谢。谨以此文献礼中国科学院青年创新促进会成立十周年。
陈坚, 袁鹏, 蔡思鑫, 陶涛, 王凯军. 2015. 碳酸盐体系中pH对Cu2+诱导结晶过程的影响. 环境科学研究, 28(1): 96–102.
贺婧, 罗玲玲, 杨超. 2015. 碳酸钙对土壤固持重金属铅的影响. 湖北农业科学, 54(23): 5839–5842.
潘兆橹. 1993. 结晶学及矿物学. 北京: 地质出版社: 245–257.
宋志慧, 王庆伟. 2011. Cu2+、Cd2+和Cr6+对斑马鱼联合毒性作用和生物预警的研究. 生态毒理学报, 6(4): 361–366.
王萌, 李杉杉, 李晓越, 赵中秋, 陈世宝. 2018. 我国土壤中铜的污染现状与修复研究进展. 地学前缘, 25(5): 305–313.
吴宏海, 侯宝利, 胡勇有, 黄瑞敏. 2001. 重金属在碳酸钙–水界面间的沉淀反应特征. 矿物岩石, 21(2): 22–25.
吴宏海, 吴大清, 彭金莲. 1999. 重金属离子与方解石表面反应的实验研究. 岩石矿物学杂志, 18(4): 301–308.
Cubillas P, Köhler S, Prieto M, Causserand C, Oelkers E H. 2005. How do mineral coatings affect dissolution rates? An experimental study of coupled CaCO3dissolution-CdCO3precipitation., 69(23): 5459–5476.
Du Y, Lian F, Zhu L Y. 2011. Biosorption of divalent Pb, Cd andZn on aragonite and calcite mollusk shells., 159(7): 1763–1768.
Elzinga E J, Rouff A A, Reeder R J. 2006. The long-term fate of Cu2+, Zn2+, and Pb2+adsorption complexes at the calcite surface: An X-ray absorption spectroscopy study., 70(11): 2715–2725.
Ghizellaoui S, Euvrard M, Ledion J, Chibani A. 2007. Inhibition of scaling in the presence of copper and zinc by various chemical processes., 206(1): 185–197.
Kashem M A, Singh B R. 1999. Heavy metal contamination of soil and vegetation in the vicinity of industries in bangladesh., 115(1–4): 347–361.
Morse J W, Mackenzie F T. 1990. Geochemistry of sedimentary carbonates. Amsterdam: Elsevier: 1–707.
Ni M, Ratner B D. 2008. Differentiation of calcium carbonate polymorphs by surface analysis techniques-anXPS and TOF-SIMS study., 40(10): 1356–1361.
Spahić M, Sakan S, Cvetković Ž, Tančić P, Trifković J, Nikić Z, Manojlović D. 2018. Assessment of contamination, environmental risk, and origin of heavy metals in soils surrounding industrial facilities in Vojvodina, Serbia., 190(4): 208–228.
Stipp S L, Hochella M F. 1991. Structure and bonding environments at the calcite surface as observed with X-ray photoelectron spectroscopy (XPS) and low energyelectron diffraction (LEED)., 55(6): 1723–1736.
Tang H M, Xian H Y, He H P, Wei J M, Liu H M, Zhu J X, Zhu R L. 2019. Kinetics and mechanisms of the interactionbetween the calcite (10.4) surface and Cu2+-bearing solutions., 668: 602–616.
Xu M, Ilton E S, Engelhard M H, Qafoku O, Felmy A R, Rosso K M, Kerisit S. 2015. Heterogeneous growth of cadmium and cobalt carbonate phases at the (10.4) calcite surface., 397: 24–36.
Yuan K, Lee S S, De Andrade V, Sturchio N C, Fenter P. 2016. The replacement of calcite (CaCO3) by cerussite (PbCO3)., 50(23): 12984–12991.
Interfacial dissolution-reprecipitation of aragonite and calcite in Cu2+-bearing solutions
TANG Hongmei1, XIAN Haiyang2, 3*, ZHU Jianxi2, 3, LI Qin1, LI Jiangang1, HUANG Zhenxiong1
(1. Institute of Energy Research, Jiangxi Academy of Sciences, Nanchang 330096, Jiangxi, China; 2. CAS Key Laboratoryof Mineralogy and Metallogeny / Guangdong Provincial Key Laboratory of Mineral Physics and Materials,Guangzhou Institute of Geochemistry, Chinese Academy of Sciences, Guangzhou 510640, Guangdong, China; 3. CAS Center for Excellence in Deep Earth Science, Guangzhou 510640, Guangdong, China)
Specific interfacial interactions between calcium carbonate and heavy metal ions control the immobilization and transformation of heavy metal ions in the environment. However, it is not clear whether aragonite and calcite, which are two of the most common calcium carbonate polymorphs, have different or similar specific interfacial interactions with heavy metal ions. In this study, the interfacial dissolution-reprecipitation of aragonite and calcite in Cu2+-bearing solutions was investigated using X-ray diffractometry (XRD), in situ scanning probe microscopy (SPM), X-ray photoelectron spectroscopy (XPS), and transmission electron microscopy (TEM). The results demonstrated that (1) after dissolving in 10 mmol/L Cu(NO3)2solution, the ≡Ca–OH species is formed on both aragonite (110) and calcite (10.4) surfaces, with the species content in the former being lower than that in the latter; (2) the dissolution-reprecipitation of both aragonite and calcite powders in 10 mmol/L CuCl2, Cu(NO3)2, and CuSO4solutions forms the malachite mineral; (3) the dissolution of aragonite and calcite powders in 10 mmol/L CuSO4solution generates the CaSO4(aq) ion pairs and induces the formation of anhydrite, suggesting that the CaSO4(aq) ion pairs are critical factors controlling the dissolution process of calcium carbonate in the SO2− 4 system. This study not only improves the understanding of the “structure-activity” relationship between aragonite and calcite crystal faces but also helps clarify the migration and immobilization mechanism of Cu2+in an environment containing different types of anions and calcium carbonate.
aragonite; calcite; dissolution-reprecipitation; Cu2+-bearing solutions
P579; P572
A
0379-1726(2022)03-0251-10
10.19700/j.0379-1726.2022.03.001
2021-06-21;
2021-07-15
江西省科学院科研开发专项基金博士项目(2020-YYB-12)和中国科学院青年创新促进会资助项目(2021353)联合资助。
唐红梅(1992–), 女, 助理研究员, 矿物学、岩石学、矿床学专业。E-mail: tanghongmei2018@163.com
鲜海洋(1991–), 男, 副研究员, 主要从事矿物表/界面反应研究。E-mail: xianhaiyang@gig.ac.cn
——详解淄博文石皴纹及赏石文化

