黄芩苷通过PI3K-Akt-mTOR通路诱导淋巴瘤细胞凋亡和自噬
雷晓红,高树丽,岳云霄,史存真
1.平顶山市第一人民医院药学部,平顶山 467000;2.平顶山市第一人民医院药学部药剂科,平顶山 467000;3.平顶山市第一人民医院药学部临床药学室,平顶山 467000;4.郑州大学第一附属医院肿瘤科,郑州 450000
恶性淋巴瘤是指发生于淋巴结、具有较高异质性的肿瘤,最为常见的是非霍奇金淋巴瘤(non-hodgkin lymphoma,NHL)。B 细胞淋巴瘤(B cell lymphoma,BCL)病例约占NHL 总病例数的80%[1]。目前,针对BCL的治疗主要是环磷酰胺、阿霉素、长春新碱、强的松和抗CD20利妥昔单抗靶向药物的综合治疗[2]。
黄芩苷(baicalin,C21H18O11)是从唇形科植物黄芩(Scutellaria baicalensisGeorigi)的干燥根中提取的一种黄酮类化合物,具有抗病毒[3]、抗炎[4]、抗过敏[5]、抗氧化[6]、抗肿瘤[7]的作用以及对免疫系统[8]、神经系统[9]的保护等作用。
PI3K-Akt-m TOR 信号转导通路是细胞内重要的信号转导途径,该信号通路激活可维持细胞存活,是肿瘤细胞抵抗凋亡的重要机制之一[10]。本文探究黄芩苷对淋巴瘤细胞增殖的抑制作用,并基于PI3KAkt-m TOR 信号转导通路考察其作用机制。
1 仪器与材料
1.1 仪器
流式细胞仪(美国Becton,Dickinson and Company公司);TE77XP 型半干转膜仪系统(美国Hoefer公司);DYY-1C 型凝胶成像系统(北京六一生物科技有限公司);荧光显微镜(日本Nikon 公司);Power Pack HV 型电泳仪(美国Bio-Rad公司);倒置相差显微镜(德国Leica公司);Cytopro离心涂片机(美国ELITech Group公司);低温型高速离心机(美国Beckman Coulter公司)。
1.2 试药
十二烷基磺酸钠(sodium dodecyl sulfonate,SDS)、三乙醇胺缓冲盐水溶液(tris buffered saline,Tris)(p H 8.8与p H 6.8)、质量浓度300 mg·L-1聚丙烯酰胺、10×电泳液、ECL 发光显影液、50×TAE和TUNEL细胞凋亡检测试剂盒(编号C1062M)均购自碧云天生物技术有限公司;PARP 抗体、LC3抗体均购自Cell Signaling Technology 公司;Hoechst 33258购自碧云天生物技术有限公司;FITC-Annexin V/PI双染试剂盒购自南京凯基生物科技发展有限公司;p-PI3K、p-Akt、p-m TOR 抗体(一抗)均购自英国Abcam 公 司;LC3 抗 体(美 国Cell Signaling Technology公司);标记HRP 的GAPDH 抗体、DC蛋白测定试剂盒和PVDF 膜均购自美国Sigma-Aldrich公司;胰蛋白酶细胞消化液、RIPA 裂解液、PMSF均购自上海碧云天生物技术有限公司;HRP-兔二抗及鼠二抗、Dylight 488-兔二抗均购自美国Earthox Life Sciences公司。
黄芩苷(质量分数≥98%,货号A0016),购自成都曼思特生物科技有限公司,用DMSO 配制成质量浓度为80 g·L-1的储备液,-20℃密闭储存。
1.3 细胞
人Burkitt淋巴瘤细胞系Raji细胞株购自美国ATCC公司,并由平顶山市第一人民医院细胞室传代培养。Raji细胞在含有体积分数10%胎牛血清(Hyclone)和抗生素的RPMI-1640培养基中培养,并置于37℃、体积分数为5%的二氧化碳培养箱中孵育。
2 方法
2.1 CCK-8法检测淋巴瘤细胞活力
将处于对数生长期的淋巴癌Raji细胞接种于96孔板中,待细胞贴壁后分别加入终质量浓度为0、50、100、200、400、800μg·m L-1的黄芩苷处理。将细胞置于37℃、体积分数为5%的二氧化碳培养箱中培养24 h后,用CCK-8试剂盒检测细胞毒性,用酶标仪检测450 nm 处的吸光度。抑制率=[1-(实验组A值-空白组A值)/(对照组A值-空白组A值)]×100%。
2.2 台盼蓝染色检测淋巴瘤细胞增殖
将密度约为2.0×105个m L-1、处于对数生长期的淋巴瘤Raji细胞悬液均匀加入12孔板中,待细胞贴壁后分别加入终质量浓度为0、100、200、400μg·m L-1的黄芩苷进行孵育处理。分别于孵育8、12、24 h 进行台盼蓝染色,用细胞计数器进行计数,每组细胞平行计数5次,取平均数绘制生长曲线。
2.3 Annexin V-FITC/PI检测细胞凋亡
将密度约为1.5×106个·m L-1、处于对数生长期的淋巴瘤Raji细胞悬液均匀加入6 孔板,置于细胞培养箱中孵育至细胞贴壁,用不同质量浓度的黄芩苷处理。孵育24 h后,收集上清液及用不含EDTA的胰酶消化的细胞以1 000 r·min-1离心5 min(离心半径为7.5 cm),弃去上清液。用预冷的PBS轻轻重悬细胞洗涤,并转移至已灭菌的1.5 m L 试管中,以12 000 r·min-1离心15 min(离心半径为6 cm)。再次用预冷的PBS轻轻重悬细胞进行洗涤,每管样品加入300μL 已稀释好的1×binding buffer,轻轻重悬。每管样品加入3μL Annexin V-FITC 进行标记,轻轻混匀后,室温避光孵育15 min;之后加入3μL PI染色,于冰浴中轻轻吹打均匀,5 min后用流式细胞仪检测细胞凋亡情况并计算凋亡率。
2.4 DAPI染色法检测细胞凋亡
用细胞离心涂片机将经不同质量浓度黄芩苷处理的Raji细胞接种于载玻片上,并用质量浓度为40 g·L-1的多聚甲醛进行固定。在含质量浓度为2 g·L-1的Triton X-100的PBS中透化后,在质量浓度为30 g·L-1BSA 的PBS中室温封闭,用PBS漂洗3次,每次5 min,进行DAPI染色,并用盖玻片封片。在荧光显微镜下观察DAPI染色后细胞的凋亡形态并拍照。
2.5 免疫荧光实验
用细胞离心涂片机将经不同质量浓度黄芩苷处理的Raji细胞接种在载玻片上,并用质量浓度为40 g·L-1的多聚甲醛固定。在含质量浓度为2 g·L-1的Triton X-100的PBS中透化后,在质量浓度为30 g·L-1BSA 的PBS中室温封闭,用PBS漂洗3次,每次5 min,加入LC3一抗,4℃过夜。再用PBS漂洗3次,每次5 min,Dylight 488-兔二抗室温避光孵育1.5 h。于激光共聚焦显微镜下观察细胞自噬体的形成情况并拍照。
2.6 Western blot检测Raji细胞蛋白的表达
提取经不同质量浓度黄芩苷处理的Raji细胞的蛋白质样品,并计算各样品中蛋白的含量,用SDSSPAGE凝胶电泳分离蛋白质,用半干转膜仪进行转膜。用质量浓度为50 g·L-1的脱脂牛奶在低速摇床上封闭1 h,用PBS洗膜3次,每次10 min。用一抗进行封闭,一抗的比例分别为p-PI3K(1∶1 000)、p-Akt(1∶1 000)、p-m TOR(1∶1 000)、LC3-Ⅰ(1∶1 500)
和LC3-Ⅱ(1∶1 500),置于4℃孵育过夜。次日用PBST 在摇床上洗膜3次,每次10 min。加入与一抗种属相对应的HRP标记的二抗,在低速摇床上室温孵育1 h。用PBST 洗膜3次,方法同上。加入ECL发光、显色,以GAPDH 作为内参,用Image Pro Plus软件分析蛋白条带。
2.7 统计学方法
用Graphpad Prism7.0软件进行统计学分析,计量资料以均数±标准差(±s)表示,多组间比较用单因素方差分析,进一步两两比较用LSD-t检验。P<0.05为差异有统计学意义。
3 结果
3.1 CCK-8与台盼蓝染色实验结果
用不同质量浓度的黄芩苷处理Raji细胞后24 h,各组之间进行细胞抑制率比较,结果见图1A。与质量浓度0μg·m L-1比较,经质量浓度50、100、200、400、800μg·m L-1黄芩苷处理的细胞抑制率显著升高。将各组数据进一步两两比较,结果显示,各组间的差异均有统计学意义。
台盼蓝染色结果见图1B。用不同质量浓度的黄芩苷处理24 h后统计各组活细胞数,与经质量浓度为0μg·m L-1的黄芩苷处理的细胞比较,经质量浓度为50、100、200、400、800μg·m L-1的黄芩苷处理的细胞抑制率显著升高。进一步进行数据之间的两两比较,结果显示,各组间的差异均有统计学意义。
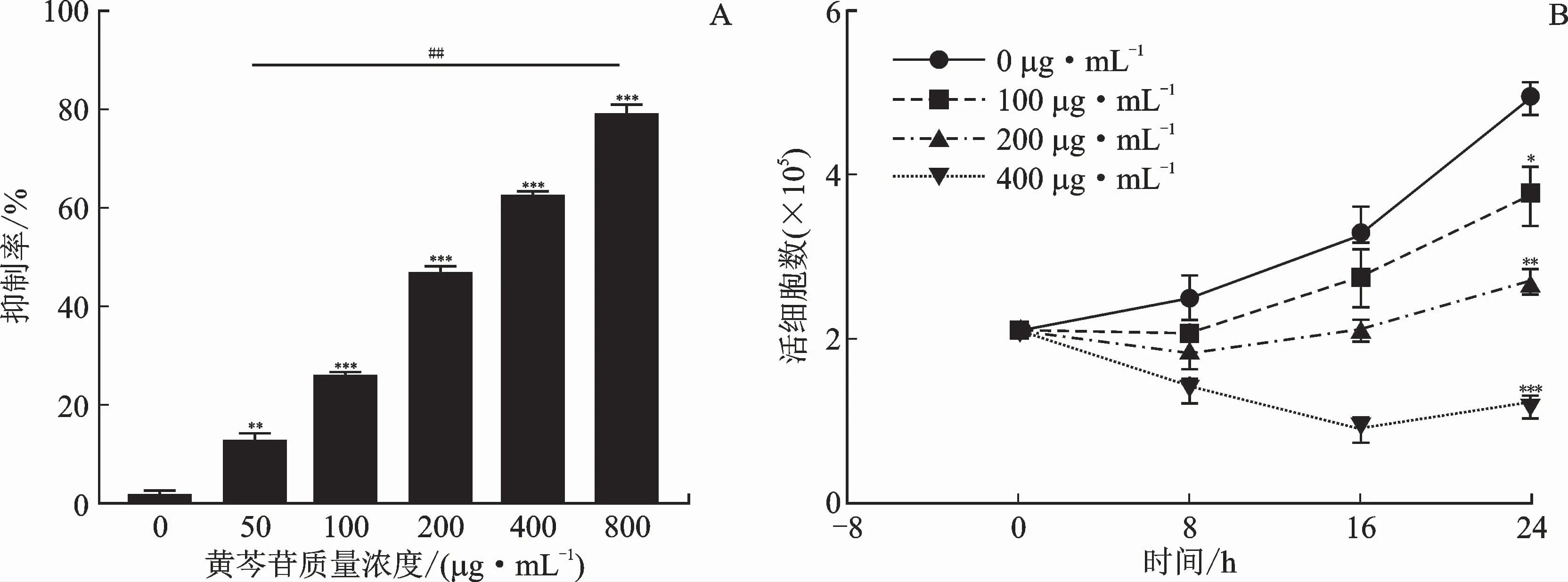
图1 黄芩苷对Raji细胞增殖的影响Fig.1 Inhibitory effects of baicalin on Raji cells
通过分析以上数据可知,用黄芩苷处理Raji细胞24 h后,IC50值为379.67μg·m L-1,黄芩苷在质量浓度为100~400μg·m L-1时就能显著抑制Raji细胞的增殖。因此,后续实验选取质量浓度梯度为0、100、200、400μg·m L-1的黄芩苷,来探究其对细胞凋亡和自噬过程的作用机制。
3.2 Annexin V-FITC/PI双染法实验结果
Annexin V/FITC-PI双染法流式细胞术检测结果见图2。不同质量浓度黄芩苷作用于Raji细胞24 h后,随着黄芩苷质量浓度的升高,Raji细胞的凋亡率逐渐上升。与用质量浓度为0μg·m L-1黄芩苷处理的细胞比较,用质量浓度为100、200、400μg·m L-1黄芩苷处理的细胞凋亡率显著上升。对数据进行进一步的两两比较,结果显示,各组间的差异均有统计学意义。

图2 不同质量浓度黄芩苷对Raji细胞凋亡的影响Fig.2 Effect of baicalin on the apoptosis of Raji cells with different mass concentration of baicalin
3.3 DAPI染色检测结果
经不同质量浓度黄芩苷处理后Raji细胞的细胞核发生形态变化,结果见图3。经质量浓度为0μg·m L-1黄芩苷处理的细胞,细胞核结构完整,呈均匀的卵圆形,无细胞核皱缩的现象;随黄芩苷质量浓度的升高(黄芩苷质量浓度为100、200、400μg·m L-1),细胞核发生变形、皱缩,甚至破裂的现象,说明黄芩苷能够诱导Raji细胞发生凋亡。
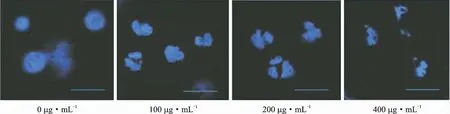
图3 不同质量浓度黄芩苷处理后Raji细胞核形态的变化Fig.3 Morphological changes of Raji cell nucleus after treatment with different mass concentration of baicalin
3.4 免疫荧光实验结果
为了检测Raji细胞凋亡过程中是否形成自噬体,用免疫荧光实验检测内源LC3,结果显示,经不同质量浓度黄芩苷处理的细胞,自噬体的分布呈现显著差异。经质量浓度为0μg·m L-1黄芩苷处理的细胞,呈现相对均匀的弥漫性荧光,经100、200、400μg·m L-1黄芩苷处理的Raji细胞呈现斑点状荧光,结果见图4,表明LC3在自噬体中发生了再分配。
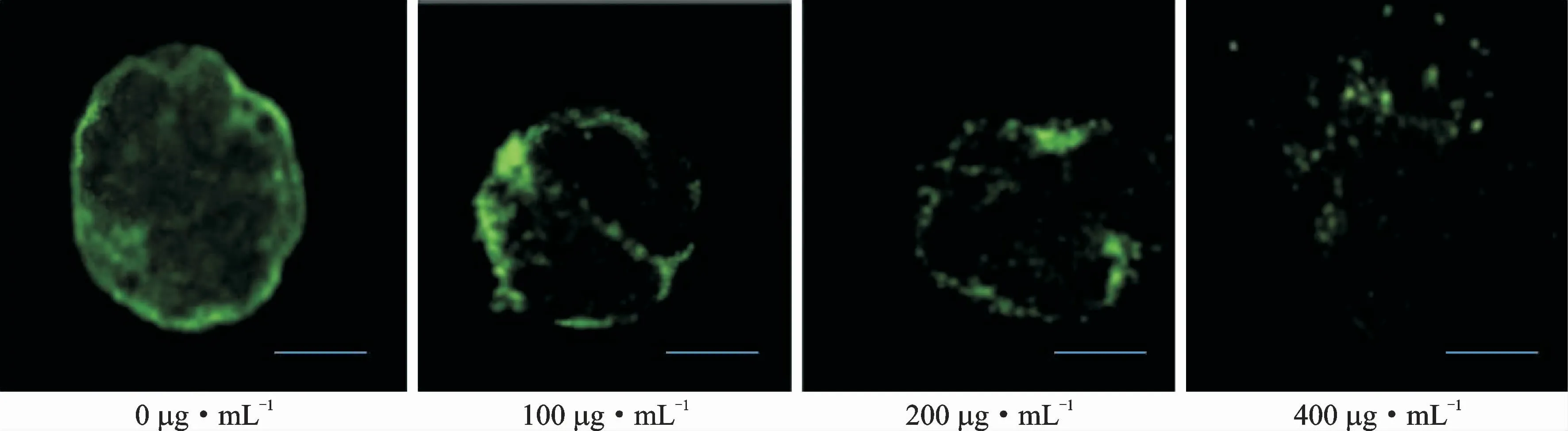
图4 不同质量浓度黄芩苷处理后Raji细胞内自噬体的分布情况Fig.4 Distribution of autophagosomes in Raji cells after treatment with different mass concentration of baicalin
3.5 Western blot检测相关蛋白的表达
为了检测黄芩苷诱导的细胞凋亡情况,实验检测了经不同质量浓度黄芩苷处理后Raji细胞PI3K、Akt和m TOR 的表达水平,及其相关磷酸化蛋白p-PI3K、p-Akt和p-m TOR 的表达水平,结果见图5。与经质量浓度为0μg·m L-1黄芩苷处理的细胞比较,经质量浓度100、200、400μg·m L-1黄芩苷处理的细胞PI3K、Akt和m TOR 的蛋白表达水平无差异,p-PI3K、p-Akt和p-m TOR 的表达量显著升高,p62蛋白的表达量显著降低。
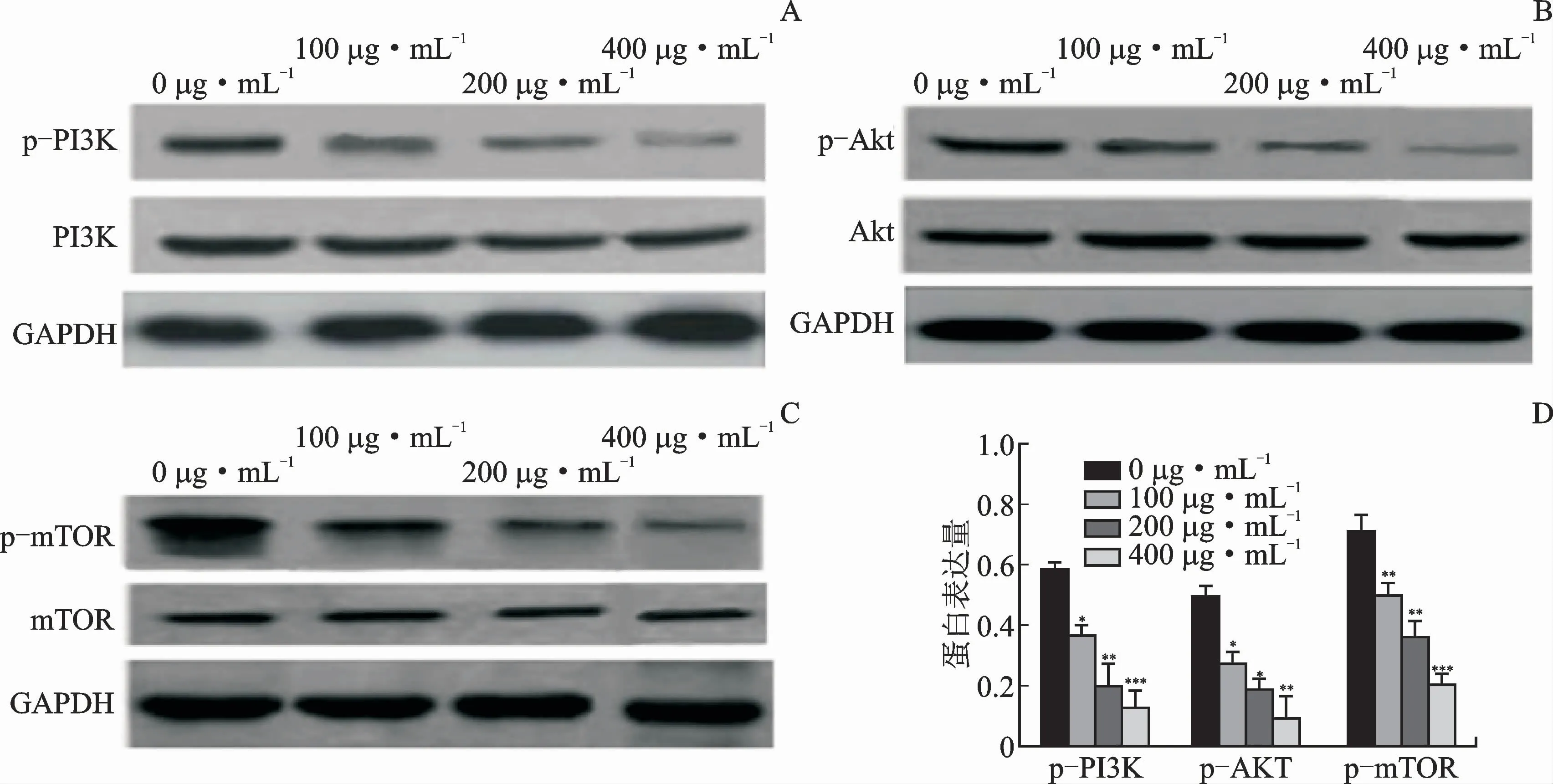
图5 不同质量浓度黄芩苷对Raji细胞相关蛋白表达量的影响Fig.5 Effect of baicalin on the expression of related proteins in Raji cells with different mass concentration of baicalin
为了检测自噬在黄芩苷诱导细胞凋亡中的作用,实验检测了经不同质量浓度黄芩苷处理后的Raji细胞中自噬相关因子LC3-Ⅰ、LC3-Ⅱ和p62蛋白的表达水平,结果见图6。与经质量浓度0μg·m L-1黄芩苷处理的细胞比较,经质量浓度100、200、400μg·m L-1黄芩苷处理的细胞LC3-Ⅰ和LC3-Ⅱ的表达水平显著升高,p62蛋白的表达量显著降低。

图6 不同质量浓度黄芩苷对Raji细胞自噬相关蛋白表达的影响Fig.6 Effects of baicalin on protein expression in Raji cells related to autophagy with different mass concentration of baicalin
4 讨论
天然中药是近现代治疗肿瘤的宝贵资源,经其提取的化合物的抗肿瘤作用也被越来越多的发现[11]。黄芩苷是具有显著活性的黄酮类化合物,目前已证明其对某些肿瘤具有治疗作用[12],然而其在淋巴瘤治疗中的作用尚未见报道。
本研究揭示了黄芩苷通过调控PI3K-Aktm TOR 通路,诱导淋巴瘤Raji细胞凋亡和自噬体的发生,进一步促进细胞凋亡及自噬的过程。
细胞凋亡和细胞自噬是细胞中2种主要的程序性死亡,在某些条件的作用下,二者能够共同作用,诱导细胞凋亡[13]。诱导细胞凋亡和自噬的发生一直是治疗血液性恶性肿瘤的重要策略。用CCK-8法和台盼蓝染色法对经不同质量浓度黄芩苷处理的Raji细胞进行染色,结果表明,黄芩苷对淋巴瘤Raji细胞的增殖具有显著的抑制作用,且在质量浓度为100~400μg·m L-1时抑制作用明显,故选取质量浓度梯度为0、100、200、400μg·m L-1进行后续研究。Annexin V-FITC/PI双染法流式细胞术实验结果显示,黄芩苷能够有效诱导Raji细胞的凋亡。细胞凋亡过程涉及一系列基因的激活、表达以及调控等,并伴随凋亡小体的生成和细胞核的皱缩等表现。DAPI染色结果发现,经黄芩苷处理24 h的Raji细胞,其细胞核发生明显的变形和皱缩。为探究Raji细胞凋亡过程中是否发生自噬,进行了内源LC3免疫荧光检测。自噬死亡,即Ⅱ型程序性细胞死亡,通常以自噬体的出现为典型特征。无自噬发生时,LC3 融合蛋白弥散在细胞质中;自噬发生时,LC3融合蛋白转位至自噬体膜,在荧光显微镜下呈现出许多明亮的绿色荧光斑点,一个斑点相当于一个自噬体,因此可以通过计数来评价自噬活性的高低[14]。结果显示,随着黄芩苷质量浓度逐渐增大,显微镜下Raji细胞状态由弥漫性荧光转变为斑点状荧光,表明黄芩苷能够有效诱导Raji细胞发生自噬。
为探究黄芩苷抑制Raji细胞增殖及诱导其凋亡的机制,用Western blot检测相关通路蛋白的表达情况。PI3K-Akt-m TOR 作为肿瘤细胞内重要的信号转导通路之一,与肿瘤的发生和发展关系密切,在多种恶性肿瘤中都可以检测到PI3K-Akt-m TOR 信号通路的转导异常,表明该通路在肿瘤治疗中扮演重要的角色[15]。PI3K 作为信号转导分子,能够激活人体细胞膜上的磷脂酰肌醇,参与调节多种细胞功能。PI3K 磷酸化的最佳靶点是Akt,磷酸化的PI3K 即p-PI3K 将信号传递给Akt后,激活Akt,使Akt磷酸化为p-Akt。一方面p-Akt可以通过其他途径抑制细胞凋亡,另一方面其可直接激活m TOR,使后者的活性增加,进而导致其发生磷酸化最终对细胞凋亡产生抑制作用[16]。Western blot结果显示,黄芩苷处理24 h后,Raji细胞内PI3K、p-PI3K 和Akt蛋白的表达水平无明显变 化,p-Akt、m TOR 和p-m TOR 蛋白的表达水平显著降低,表明黄芩苷能够抑制PI3KAkt-m TOR 通路的信号转导,降低其对于凋亡的抑制作用,进而达到诱导细胞凋亡的作用。
为进一步探究自噬在由黄芩苷诱导的细胞凋亡中的作用,实验检测了经不同质量浓度黄芩苷处理后的Raji细胞中自噬相关因子LC3-Ⅰ、LC3-Ⅱ和p62蛋白的表达水平。LC3 是一种自噬体标志蛋白,其存在2 种可相互转化的形式,即LC3-Ⅰ和LC3-Ⅱ。细胞质内可溶形式为LC3-Ⅰ,LC3-Ⅰ经剪切和修饰,转变为位于胞内自噬体膜上的膜结合形式的LC3-Ⅱ。LC3-Ⅰ、LC3-Ⅱ随自噬体膜的增多而增多。因此,可通过Western blot检测LC3-Ⅰ、LC3-Ⅱ的表达水平,进而判断细胞的自噬活性[17]。p62 是一种泛素结合蛋白,它能与LC3直接作用,参与自噬过程并被降解。p62蛋白的水平与自噬的活性成反比,在自噬被抑制时,p62蛋白的表达水平升高,因此,p62蛋白的表达水平可反映自噬活性的强弱[18]。Western blot结果显示,黄芩苷能够显著提高LC3-Ⅰ、LC3-Ⅱ的表达水平,显著降低p62的表达水平,表明黄芩苷能够通过提高LC3-Ⅰ、LC3-Ⅱ的表达水平,抑制p62的表达,从而提高自噬的活性,减弱溶酶体的降解作用,进而诱导Raji细胞自噬的发生。
综上所述,黄芩苷能够诱导Raji淋巴癌细胞凋亡和自噬的发生,其可能通过下调PI3K-Akt-m TOR 信号转导通路相关蛋白的表达水平发挥作用。

