血红蛋白氧载体的研究与应用进展
李 菂,韩樾夏,杨 芳
(1. 东南大学生物科学与医学工程学院 江苏省生物材料与器件重点实验室,江苏 南京 210096)(2. 中国科学院空间应用工程与技术中心,北京 100094)
1 前 言
氧在自然界中分布非常广泛,更是生命之源。对于生物与医疗来说,许多病症均伴随着氧气的缺乏,因此不断开发与更新性能良好的医用载氧材料成为热门的研究课题。血红蛋白来源于生物体本身,作为红细胞的主要组成部分,依靠分子中心的铁原子承担机体氧气运输的功能,在携氧能力、安全性或生物相容性方面,均具有独特的优势。由此,以血红蛋白为基础的氧载体在生物医学领域的相关研究应运而生。血红蛋白氧载体通常由血红蛋白加以化学修饰,或由多种材料组成的膜壳结构包封构成,应用于多种由于缺氧引起或呈现乏氧症状的疾病的治疗。如图1所示,本文对近年来血红蛋白氧载体的制备研究与临床应用进展进行综述。

图1 血红蛋白氧载体构建与应用示意图Fig.1 Construction and application of hemoglobin oxygen carrier
2 血红蛋白的化学修饰
血红蛋白因其对氧的攫取和运载能力而成为人工氧载体的良好选择。然而,裸露在血液中的血红蛋白容易被人体固有免疫系统识别并迅速清除。且游离于血液中时,血红蛋白分子中的2对珠蛋白链构成的四聚体极易降解为二聚体,使其不仅失去载氧功能,而且产生肾毒性[1, 2],危害人体健康。为了克服这一问题,研究者需要对血红蛋白氧载体进行表面化学修饰或包封,以保证安全性与良好的携氧能力,从而延长循环时间,提高载氧效率。在化学修饰层面,多使用偶联、交联或物理吸附等方式增加血红蛋白的稳定性。
2.1 氧化葡聚糖修饰血红蛋白
Hickey等[3]通过控制乙醇的浓度沉淀血红蛋白,合成了粒径约为250 nm的去溶剂化血红蛋白纳米颗粒,如图2所示,其以氧化葡聚糖作为有效的表面稳定剂,保持粒子的完整性,改善了普通聚合血红蛋白材料颗粒大小和形状不均匀等缺点。Kloypan等[4]也进行了氧化葡聚糖交联血红蛋白的制备研究,该材料溶血率低,不影响白细胞的吞噬功能,也不会引起血小板的活化,因此具有良好的血液相容性,是很有前景的氧气及药物载体。氧化葡聚糖的修饰步骤相对简单,虽然在材料携氧量上不具有附加优势,但可基本维持血红蛋白的化学稳定性,并规避体内屏障,保障顺利运氧。
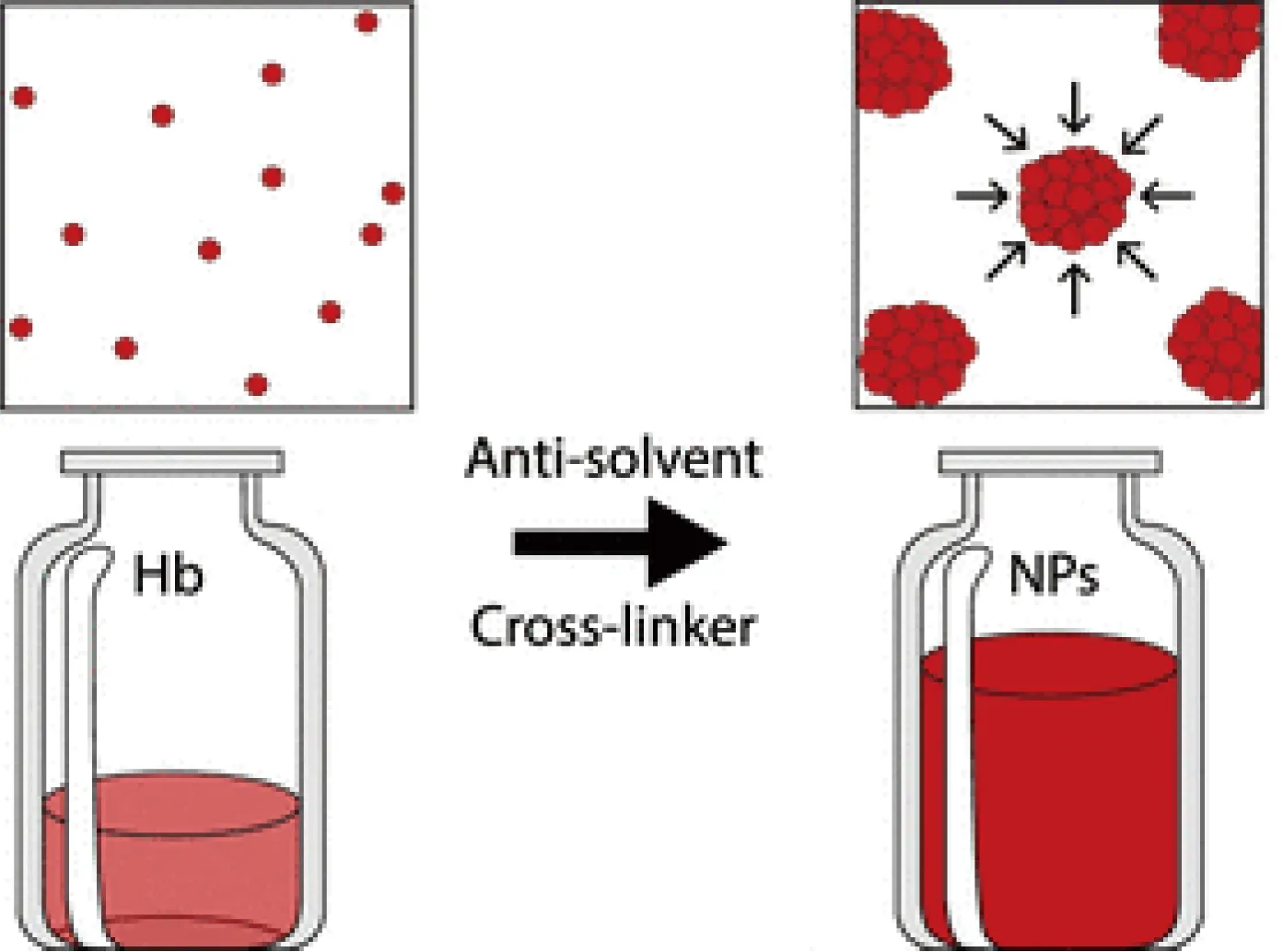
图2 去溶剂化血红蛋白纳米颗粒合成示意图[3]Fig.2 Synthesis schemitc of desolvent hemoglobin nanoparticles[3]
2.2 戊二醛多聚血红蛋白
Gu等[5]制备了具有不同交联密度的超高分子量(>500 kDa)的结合氧气(松弛态,R态)或未结合氧气(紧张态,T态)的戊二醛聚合牛血红蛋白(PolybHbs),如图3所示,其均具有良好的携氧能力,其中T态PolybHbs的氧气卸载速率明显更高。Belcher等[6]尝试了气体交换和试剂添加的控制方法,采用完全耦合的小型切向流超滤系统对合成的聚合人血红蛋白(PolyhHb)分子进行纯化和浓缩,从而更精确地控制PolyhHb分子的尺寸、形貌及其分散性,保留其携氧能力、氧亲和力和氧卸载特性。戊二醛多聚血红蛋白可根据应用要求调节聚合物分子量大小,从而调节材料的氧亲和力,聚合产物分子量越高,氧亲和力越强;但其缺点是导致血红蛋白自氧化性能增加[7],使部分血红蛋白失去携氧能力。

图3 T态和R态聚合牛血红蛋白合成示意图[5]Fig.3 Synthesis schematic of T-and R-state PolybHb [5]
2.3 有机基团共轭血红蛋白
早在1983年,Iwashita等[8]通过酰胺键将血红蛋白分别与聚乙二醇、聚丙二醇以及环氧乙烷和环氧丙烷等聚合物共价偶联,研制出一类含血红蛋白或血红蛋白衍生物的有机聚合物载氧材料。1986年,Iwasaki等[9]则公开发布了其血红蛋白的化学修饰结构,通过聚环氧乙烷的端基和血红蛋白的氨基之间的键结合,形成—CH2—O—CH2—CONH—Hb的结构。Christoforidis等[10]研制了牛源聚乙二醇化碳氧血红蛋白为基础的氧载体,用以向缺氧组织释放氧。该氧载体可在软脑膜小动脉血管舒张、抗肿瘤和抗炎等方面发挥作用,并可向严重缺氧组织输送氧气,在减缓急性脑卒中缺血性损伤方面显示出良好的应用前景。
2.4 血红蛋白与其他材料结合
Prapan等[11]通过2次、3次沉淀法对人血清白蛋白、透明质酸和丙氨酸进行了表面吸附研究,结果表明,不同表面修饰的血红蛋白亚微米颗粒不仅会影响氧的结合能力,还会影响对抗血红蛋白抗体、免疫球蛋白和触珠蛋白的结合。Xia等[12]将金纳米粒子血红蛋白复合物纳米粒子负载于血小板上(Au-Hb@PLT),如图4所示,这些Au-Hb@PLT体积小,能使金纳米粒子血红蛋白复合物深入肿瘤组织,作为放射增敏剂来增强肿瘤细胞对X射线的敏感性,同时血红蛋白作为氧载体来缓解缺氧,从而增强低剂量放疗的治疗效果。将血红蛋白联合各类材料,在应用层面除可以更精确地调节释氧量外,也可进行病灶靶向联合其它疗法进行治疗,使血红蛋白载体材料功能更丰富,更有针对性。

图4 Au-Hb@PLT材料合成示意图[12]Fig.4 Synthesis schematic of Au-Hb@PLT[12]
3 血红蛋白的微囊封装技术
为进一步提高血红蛋白氧载体的携氧能力并增加载体功能,研究者运用多种材料制备膜壳结构,封装血红蛋白,形成尺度为微纳级别的囊泡,构成更加稳定和多元的氧运载系统。微囊封装的方式不仅增加了血红蛋白包封率,更使血红蛋白内核的功能得以完善保留。与此同时,不同膜壳材料本身的分子特性丰富了微囊载体的功能,并且可以提升其生物相容性,以适应更为复杂的生物环境,使血红蛋白氧载体拥有更广泛的应用前景。
3.1 脂质体包载血红蛋白
Arifin等[13]研究了脂质体包裹的四聚血红蛋白分散体,其通过挤压的方式制备而成,膜壳使用物质的量的比为10∶9∶1的二嘧磺酰磷脂酰胆碱、胆固醇和二嘧磺酰磷脂酰甘油的脂质混合物,具有较高的血红蛋白包封效率、较低的高铁血红蛋白水平,以及较好的氧结合特性。Awasthi等[14]则使用聚乙二醇二硬脂酰磷酸酯酰乙醇胺作为脂质体包封膜壳,以中性或负电荷的血红蛋白为载体。聚乙二醇降低了网状内皮系统对血红蛋白载体材料的截留,从而降低其肝脏摄取率,而增加了脾脏摄取率。聚乙二醇化的材料设计不仅提高了囊泡内血红蛋白的含量,同时改善了血红蛋白载体在循环系统内的传输作用,为后续应用提供了更多可能。Li等[15]则继续引入肌动蛋白基质,制备了脂质体包裹的肌动蛋白-血红蛋白的分散体。相比单纯的聚乙二醇化血红蛋白的循环特性,增加肌动蛋白基质将进一步延长氧载体的循环半衰期,从而拓展了脂质体包裹血红蛋白氧载体的应用前景。同时,脂质体由于磷脂分子的双亲性特质,赋予了材料更加多元化的载药方向,也根据粒径和包载形式的不同而具有不同的体内分布特性,并且具有更高的生物相容性。
3.2 聚合物囊泡包载血红蛋白
Arifin等[16]将牛血红蛋白包封在聚丁二烯-聚乙二醇(PBD-PEO)聚合物囊泡中,构成两亲性多聚体包裹血红蛋白的分散体。与传统脂质体相比,该聚合物囊泡具有更长的PEG链和更厚的疏水膜,其血红蛋白载量也高于脂质凝胶包裹的血红蛋白颗粒和纳米水凝胶包裹的血红蛋白颗粒。囊泡平均半径大于50 nm,氧亲和力与人红细胞相当,可以发展成为一种有效的氧疗法。Rameez等[17]开发了由聚环氧乙烷(PEO)、聚己内酯(PCL)和聚丙交酯(PLA)组成的两亲性二嵌段共聚物自组装包裹血红蛋白的材料。在两亲性二嵌段共聚物中,PEO作为亲水性嵌段,而PCL或PLA则可作为疏水性嵌段;其中PCL和PLA可生物降解,而PEO、PCL和PLA均是生物相容性聚合物。因此该材料具有可生物降解和生物相容性,血红蛋白负载能力较好。聚合物囊泡包裹的血红蛋白氧载体携氧性能良好,且在体内的循环时间延长,作为治疗性氧载体具有良好前景。
4 血红蛋白氧载体的治疗应用
血红蛋白氧载体的应用范围非常广泛,如作为细胞培养添加剂,可提升细胞增殖率、增强细胞活力等[18]。而在临床上,许多疾病是由缺氧引起的,由适合的氧载体递送氧气常常可以直接减轻症状。虽然输血技术在今天已经逐步趋于安全和完善,但相比于输血,运用人工氧载体进行输氧具有不可替代的优势,例如氧载体与所有血型的相容性、避免交叉配血、可用性高、感染风险低等,并且能够满足长期储存的需要。以血红蛋白为基的氧载体正在作为一种“氧桥”,取代或补充标准输血在危及生命的极端状况下的需要,例如在偏远地区、条件恶劣的战场或患者由于宗教反对拒绝血液用品等。除此之外,很多伴随症状出现的乏氧情况,也可以通过人工氧载体补充氧气得以治疗。而使用人工氧载体联合化疗或光动力疗法等,更加速了治疗的进程,具有非常可观的应用前景。
4.1 红细胞替代品
血红蛋白氧载体作为红细胞替代品的研发,40多年来已历经3代,其修饰手段从化学修饰逐渐演变为封装在合成膜中[19]。Jansman等[20]制备了聚丙交酯-乙交酯核(PLGA),随后用血红蛋白和纳米酶修饰。血红蛋白被聚多巴胺包被,以保持蛋白质的结构和功能,如图5所示。Romito等[21]使用聚乙二醇偶联牛源碳氧血红蛋白,在血液稀释过程中可增加组织氧输送并减少失血,适合等容血液稀释,可在心脏手术的体外循环中更好地保存血液。Rubinstein等[22]将牛血红蛋白氧载体HBOC-201运用于纯红细胞再生障碍性贫血(PRCA)的治疗中。PRCA患者网织红细胞绝对值减少,骨髓中红细胞前体细胞缺失或严重减少。在接受HBOC-201治疗后,患者出现了红细胞计数恢复的迹象,加予免疫抑制治疗,最终改善红细胞生成。
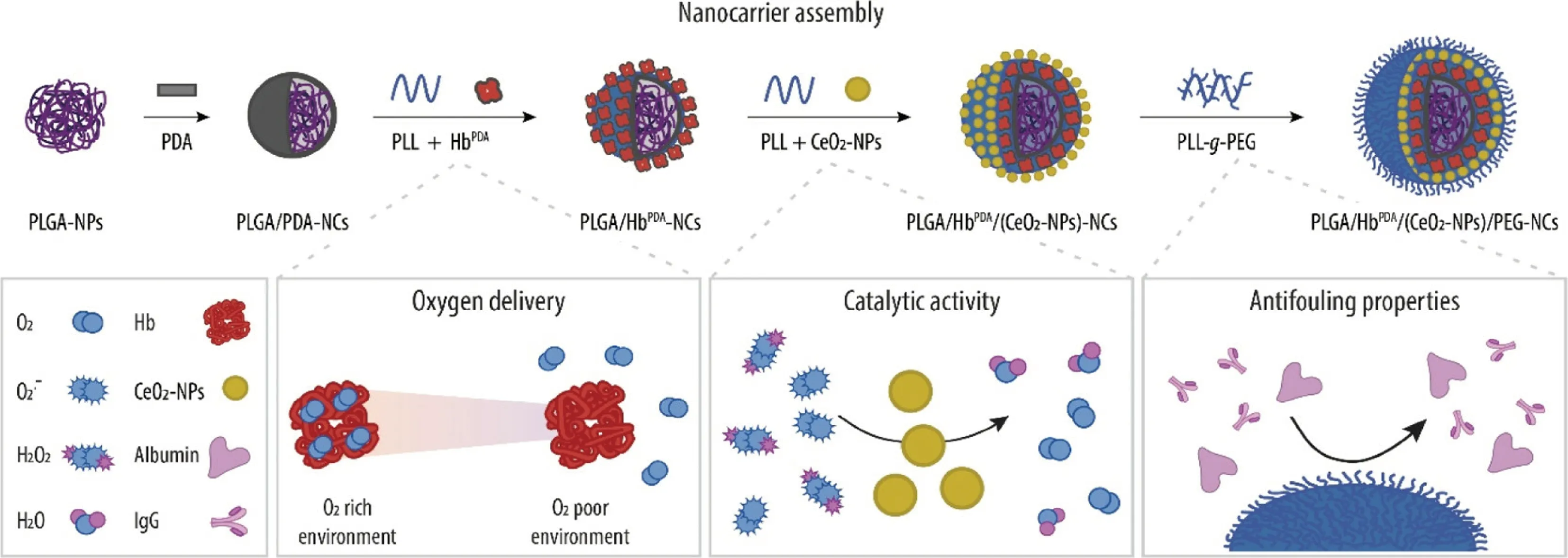
图5 不同功能组分吸附至聚乳酸-羟基乙酸共聚物(PLGA)核合成示意图[20]Fig.5 Synthesis of different functional components adsorbed to PLGA core[20]
4.2 心脑缺氧程度缓解
Ito等[23]将血红蛋白载氧与局部冷灌注疗法结合起来,对脑缺血再灌注损伤等产生更强的神经保护作用。他们在大鼠短暂性大脑中动脉闭塞模型中,采用一种核壳结构的血红蛋白-白蛋白簇与局部灌注进行联合治疗,灌注7 d后对神经功能缺损和梗死体积减少的疗效显著,脑血流减少、脑水肿和蛋白质外渗也有明显改善,是一种对严重缺血性中风很有前景的神经保护策略。Gekka等[24]发现了血红蛋白-白蛋白簇构成的氧载体显著抑制缺氧及复氧处理细胞中活性氧的产生,具有良好的微血管灌注和氧输送能力及可能的抗氧化作用,同样对短暂性脑缺血具有神经保护作用。
4.3 恶性肿瘤治疗
4.3.1 改善恶性肿瘤乏氧微环境
Jiang等[25]开发了一种由血红蛋白联合化疗药物卡巴唑构成的脂质体人工氧载体系统,能够有效地向肿瘤输送氧气,并抑制肿瘤生长与转移。该载体不仅能减轻肿瘤缺氧的程度,缓解肿瘤乏氧微环境,有效地将癌细胞滞留在肿瘤部位,而且能下调低氧诱导因子(HIF)的表达,有利于降低肿瘤的恶性程度。同时将血红蛋白氧载体注入体循环,也可以通过缓解实体瘤缺氧情况的方式提高化疗药物的疗效。Belcher等[26]设计了计算模型来模拟人体肿瘤结构,进行了聚合人血红蛋白增强肿瘤氧合的模拟,以确定氧载体在肿瘤中的异质性血管结构下的潜在有效性。Belcher等[27]也研究对比了结合氧气(松弛态,R态)和未结合氧气(紧张态,T态)的聚合人血红蛋白调节低氧(FME)和常氧(LOX)人黑色素瘤异种移植物中的氧输送情况。通过对FME和LOX肿瘤异种移植物的生长率、血管和局部血流的观察,输注低氧亲和力的T态血红蛋白载体材料,从而使缺氧肿瘤组织氧合增加,血流量减少,血管生成减少,肿瘤生长减少。然而,输注T态和R态的血红蛋白载体材料在常氧性肿瘤中则并无改善。因此,肿瘤本身的氧气状态是输注血红蛋白氧载体材料的效用和结果的主要决定因素。因此,面对肿瘤治疗,血红蛋白氧载体类材料的研究更需要聚焦于乏氧微环境的靶向与调控,精准释氧,以发挥最大效益。
4.3.2 光动力疗法联合治疗
光动力疗法因其无创性、副作用小等优点,已成为一种具有前瞻性与热度的肿瘤治疗方法。然而,肿瘤部位由于癌细胞的增殖而缺氧的内环境,严重阻碍了光动力疗法的治疗效果。因此,及时补充氧气,提高活性氧的生成,可以有效辅助肿瘤的光动力治疗。其中,依赖肿瘤内源性过氧化氢分解的原位制氧,并结合血红蛋白或全氟化碳高载氧量的氧传递方式,成为光动力疗法联合治疗的良好选择。原位制氧技术对肿瘤具有很高的特异性,但其制氧效率受到肿瘤内过氧化氢水平的限制。与此相反,输氧法虽然缺乏肿瘤特异性,但具有载氧效率高的优点。将血红蛋白作为氧载体运载于脉管系统中,可以更高效和更具普适性地提升光动力疗法的有效性。Zheng等[28]采用共沉淀法将血红蛋白掺杂到碳酸钙中,再将碳酸钙交联去除,得到血红蛋白微粒,以吲哚菁绿(ICG)溶液孵育得到血红蛋白/ICG颗粒(HbIPs),并保持了载氧能力,比游离的ICG产生更多的活性氧,杀死比游离ICG多22%的癌细胞,很好地起到了补充光动力治疗效果的作用。Luo等[29]通过二硫键重组将血红蛋白和白蛋白进行杂交,同时包埋阿霉素,制备了肿瘤靶向性杂交蛋白氧载体,作为纳米药物用于精确的肿瘤氧合,同时联合化疗和光动力治疗,提供更佳疗效,如图6所示。

图6 肿瘤靶向性杂交蛋白氧载体合成示意图[29]Fig.6 Synthesis schematic of Tumor targeted hybrid protein oxygen carrier[29]
4.4 缺血性休克与复苏
失血过多是导致创伤或失血性休克患者死亡的主要原因,而目前用于急救的院前复苏液提供的作用仅是纠正低血容量,保障有效的血输出量和器官的血流灌注。
若材料可增加携氧能力,则可减轻失血性休克时的微血管缺血和组织缺氧,对血液功能也是一种有效补充。William等[30]验证了聚乙二醇化碳氧基团修饰的血红蛋白的氧载体(PEG-COHb)对失血性休克大鼠全身及微循环的影响,证明PEG-COHb能有效改善心血管参数,降低乳酸含量,延长机体存活时间。同时复苏后未检测到高血压,进一步支持了该载体材料对失血性休克症状缓解的效果。Philbin等[31]评价了HBOC-201对猪的合并软组织损伤导致失血性休克的复苏效果,该氧载体组别平均动脉压、平均肺动脉压和全身血管阻力指数较高,心脏指数、血流动力学和组织氧合恢复快,并减少了液体量需求,是一种效果较好的复苏液体。
4.5 骨骼肌氧合
Horn等[32]研究发现无基质牛血红蛋白溶液对骨骼肌组织氧合具有影响,该氧载体的治疗有助于升高平均动脉压和平均肺动脉压并提高吸氧率,在严重动脉狭窄期间,增加氧摄取,改善骨骼肌组织氧合。Kawaguchi等[33]研究了高氧亲和力的脂质体包裹血红蛋白对骨骼肌人工输送氧气的作用。他们设计了大鼠快型跖肌(PLT)和慢型比目鱼肌(SOL)原位抗疲劳试验,原位分离PLT和SOL的远端肌腱并分别连接到力传感器上,记录对同侧坐骨神经刺激产生的张力。结果表明,该氧载体额外的氧气供应可能会加速含有丰富线粒体的慢型有氧溶胶肌肉中的三羧酸循环与电子传递链,并有助于更快地去除如乳酸等的肌肉疲劳物质。
4.6 器官及肢体灌注
Bodewes等[34]提出使用血红蛋白氧载体进行供体肝脏的离体机器灌注,以起到维持器官活力和细胞功能的关键作用。在心肌梗塞治疗中,心肌缺血缺氧,可利用血红蛋白氧载体保持毛细血管充分开放,使心肌得到有效灌注,使平均动脉压升高,更大程度地加快氧的运输[35]。George等[36]检测并证明了血红蛋白氧载体HBOC-201具有在急性、严重心肌缺血再灌注时减少梗死面积并提高心肌存活率的功效。Mahboub等[37]研究了肾脏逐渐复温过程中以血红蛋白氧载体代替简单扩散碳流充氧的效果。该研究模拟了循环死亡肾移植后的供体,结果表明,在循环死亡的肾脏经历从10到37 ℃的逐渐复温过程中,与无氧复温相比,使用血红蛋白氧载体的组别呈现了良好的肾功能,超滤率增加,肾小球滤过率提高,钠重吸收也有所改善。Aburawi等[38]则证明了合成血红蛋白氧载体在人体肾脏常温灌注中使用的可行性。Meur等[39]研究了细胞外血红蛋白M101作为器官保存液添加剂对缺血及再灌注损伤的优势,同时证实了M101的安全性。相比标准冷藏保存,离体常温肢体灌注(EVNLP)方式保存下的肢体存活能力更好;而与无细胞灌注液相比,含有填充红细胞的灌注液则可改善预后。但该灌注方式也具有局限性,包括可用性有限、交叉配血的需要、机械性溶血和促炎蛋白的激活等。Said等[40]对使用聚合牛血红蛋白的氧载体HBOC-201制备EVNLP材料的可行性进行了研究,HBOC-201具有免疫原性低、无溶血反应危险、增强对流以及扩散氧传递等优点。通过猪前肢灌注,对结晶和破坏特征进行观察,发现线粒体超微结构得到了更好的保存,肌肉收缩力也得到更好的保留。
5 结 语
近年来,研究者通过偶联、交联、吸附等各种方式进行化学修饰,以及利用脂质体、聚合物等各种材料进行微囊包埋,不断研发和更新血红蛋白氧载体,其应用多处于临床研发阶段,包含贫血、脑损伤、恶性肿瘤、缺血性休克、骨骼肌疲劳以及器官肢体灌注等方面,使传输和供给氧气更加便捷和高效。血红蛋白氧载体由于不存在完整的细胞结构,其释氧速率快于天然红细胞,需要进行表面修饰优化以达到缓释的目的。未来血红蛋白作为氧载体的研究可能会更加聚焦于开发更合适的包埋和修饰材料,使其理化性质更加稳定,更加适应瞬息万变的机体环境;连接靶向物质,实现面对病灶的定向特异性供氧,使治疗范围更精准;联合一氧化氮等材料,逆转治疗中的肺动脉高压等情况,减轻血红蛋白氧载体的不良反应,进一步提升治疗的安全性。