缺血性脑卒中后3~6个月认知障碍影响因素的Meta分析
汤爱洁,戴秀娟,胡鑫淼,汪夏云,吴茜
卒中后认知障碍(post-stroke cognitive impairment,PsCI)指在卒中这一临床事件发生后3~6个月内出现的达到认知障碍诊断标准的一系列综合征,是缺血性脑卒中患者常见后遗症之一[1]。研究表明,卒中后3~6个月内PsCI发生率为58%~69%,且PsCI严重影响卒中患者康复与预后[2-4]。2016年,美国心脏协会联合美国卒中协会发布了首部《成人卒中康复指南》,并强调了认知功能评估在卒中康复治疗中的重要性[5]。
OH等[6]进行的一项为期两年的随访研究发现,卒中后第3~6个月认知功能变化最快,且PsCI发生率在卒中后第3个月最高,在卒中后第6个月最低,在卒中后第12、24个月趋于平缓,提示PsCI是动态发展、持续变化的,卒中后3~6个月是认知功能变化最为不稳定且PsCI发生风险较高的一个时间段。因此,将卒中后3~6个月作为观察卒中后认知功能的时间段,一方面是由于该阶段是卒中患者的重要康复期,另一方面探索该阶段PsCI的影响因素有利于为早期减少PsCI的发生提供参考。
目前研究发现的PsCI的影响因素主要包括年龄、受教育程度、高血压、糖尿病等,但多数研究对PsCI的评估时间点不同且研究质量参差不齐,部分研究结果尚存在争议[7-9]。此外,既往研究多集中于卒中后痴呆,而对认知功能损伤程度尚未达到痴呆标准的PsCI关注较少。本研究聚焦于卒中后3~6个月这一时间段,通过Meta分析方法探讨缺血性脑卒中后3~6个月认知障碍的影响因素,旨在为PsCI的预防和干预提供循证医学证据。
本研究主要发现:
卒中后认知障碍(PsCI)是缺血性脑卒中患者常见并发症之一,本研究通过Meta分析证实年龄、受教育程度、高血压、糖尿病、心房颤动、卒中史、Fazakas评分、入院时美国国立卫生研究院卒中量表(NIHss)评分、高同型半胱氨酸血症、饮酒是缺血性脑卒中后3~6个月认知障碍的影响因素,为PsCI的预防和干预提供了循证医学证据,医务人员可根据上述影响因素和患者具体情况制定个性化康复治疗方案。
1 资料与方法
1.1 文献检索策略 采用计算机检索 the Cochrane Library、PubMed、EMBase、CINAHL、Web of science、中国知网、中国生物医学文献服务系统(sinoMed)、维普网(VIP)、万方数据知识服务平台,通过主题词结合自由词的方式筛选关于缺血性脑卒中后3~6个月认知障碍影响因素的病例对照研究,检索时限为建库至2020年12月。中文检索词包括缺血性脑卒中、腔隙性脑梗死、脑栓塞、脑血栓形成、脑梗死、认知功能障碍、认知障碍、认知功能减退、认知损伤、卒中后认知功能障碍、影响因素、危险因素、相关因素;英文检索词包括 Brain Ischemia、Cerebral Infarction、Lacunar stroke、Lacunar Infarct、Brain Thrombosis、Cerebral Thrombus、Poststroke、Cognitive Dysfunction、Cognitive Impairment、Cognitive Deficit、Cognitive Decline、Cognition Disorders、Influencing Factors、Risk Factors。以 PubMed 为例,本研究文献检索策略见表1。
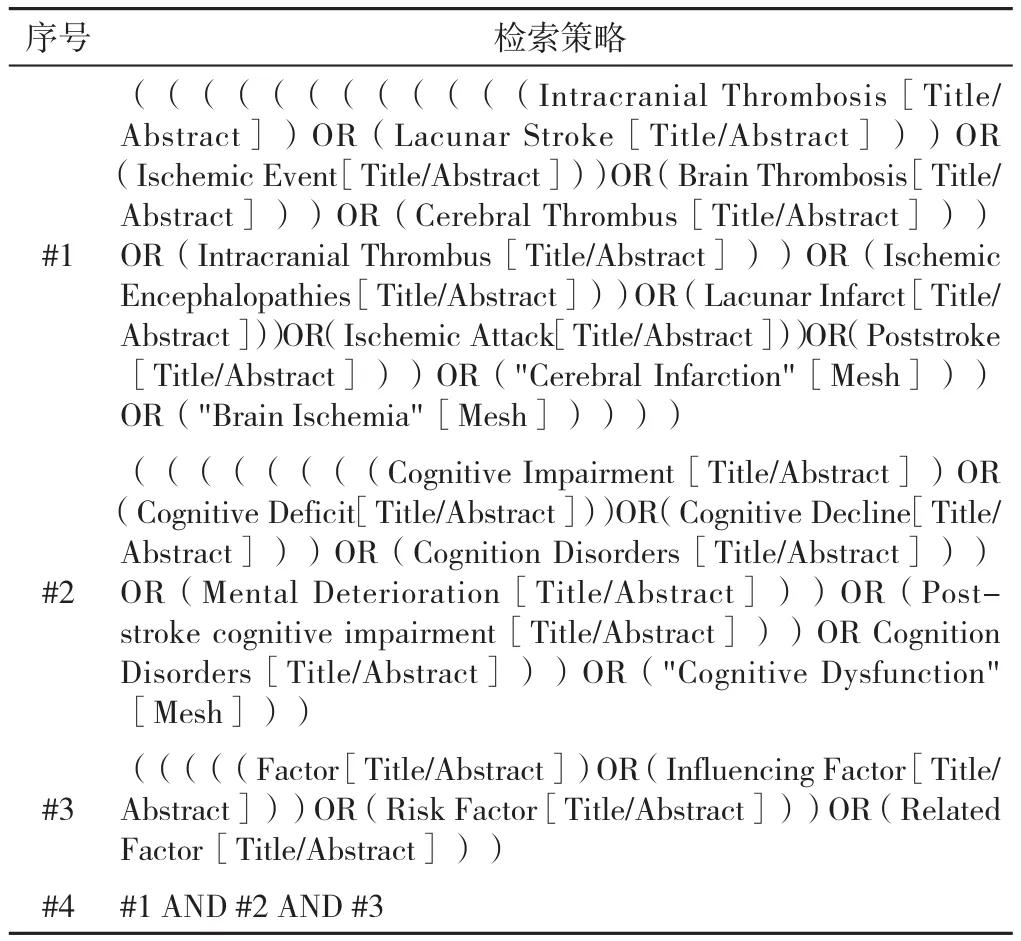
表1 PubMed文献检索策略Table 1 strategy for searching cohort studies about influencing factors of cognitive impairment 3 to 6 months after ischemic stroke in PubMed
1.2 文献纳入与排除标准
1.2.1 文献纳入标准 (1)研究类型:队列研究或病例对照研究;(2)研究对象:缺血性脑卒中后3~6个月患者,年龄、性别不限;(3)影响因素:年龄、受教育程度、高血压、糖尿病、心房颤动、卒中史、Fazakas评分、入院时美国国立卫生研究院卒中量表(NIHss)评分、高同型半胱氨酸血症、饮酒。(4)结局指标:缺血性脑卒中后3~6个月认知障碍发生率。
1.2.2 文献排除标准 (1)研究内容为缺血性脑卒中之外的其他脑血管疾病患者认知障碍的影响因素,或缺血性脑卒中合并其他疾病(包括其他中枢神经系统疾病、卒中前认知障碍、心力衰竭、呼吸衰竭、严重肝肾疾病、恶性肿瘤、血液及免疫系统疾病等)患者认知障碍的影响因素;(2)无法获取全文;(3)综述和会议论文;(4)研究质量较低。
1.3 资料提取 由两名研究者采用预先设计的资料提取表独立提取资料并进行交叉核对,意见不一致时请第三名研究者定夺,提取内容包括:(1)纳入研究的基本信息,如第一作者姓名、发表年份、PsCI与非PsCI患者例数、研究对象来源等;(2)结局指标。
1.4 方法学质量评价 参照WELLs等[10]制定的非随机对照研究方法学质量评价工具——纽卡斯尔-渥太华量表(Newcastle-Ottawa scale,NOs),由两名研究者独立评价纳入研究的方法学质量,评价内容包括人群选择、组间可比性、暴露或结局3个方面,评分越高表明研究质量越高;两名研究者意见不一致时请第三名研究者定夺。
1.5 统计学方法 采用RevMan 5.3软件完成Meta分析,具体步骤如下:(1)对所纳入研究数据进行转换[11]并建立数据库,若研究中报告β或OR值及其95%CI,则效应量=ln(OR)=β,效应量的标准误=ln(95%CI上限-95%CI下限)/3.92。(2)综合考虑Q检验结果与I2以判断纳入研究异质性,Q检验对应的P值≥0.05表示纳入研究间无异质性,对应的P值<0.05则表示纳入研究间存在异质性;I2<50%表示纳入研究间无异质性,I2≥50%表示纳入研究间存在异质性,需进行敏感性分析以判断异质性来源。纳入研究间无异质性时采用固定效应模型进行效应量合并,反之则采用随机效应模型进行效应量合并。(3)计算合并OR值及其95%CI,绘制森林图和倒漏斗图。
2 结果
2.1 文献检索结果及筛选流程 检索数据库共获得文献3 373篇,剔除重复文献后获得文献2 086篇,阅读文题和摘要后获得文献256篇,阅读全文并结合文献纳入与排除标准获得文献43篇,进一步阅读全文进行复筛后最终获得文献27篇[12-38],其中病例对照研究 21 项[12,14-16,21,23-38],队列研究 6 项[13,17-20,22]。文献筛选流程见图1。

图1 文献筛选流程Figure 1 Flow chart for literature screening
2.2 纳入研究的基本特征及方法学质量评价 纳入的27篇文献中英文文献17篇[12-28],中文文献10篇[29-38],包含8 677例患者,其中PsCI患者4 322例,非PsCI患者4 355例)。纳入研究NOs总分为9分者1篇[13],8分者16篇[14-22,24,27-30,32,38],7 分者 10 篇[12,23,25-26,31,33-37],方法学质量总体较高(表2)。
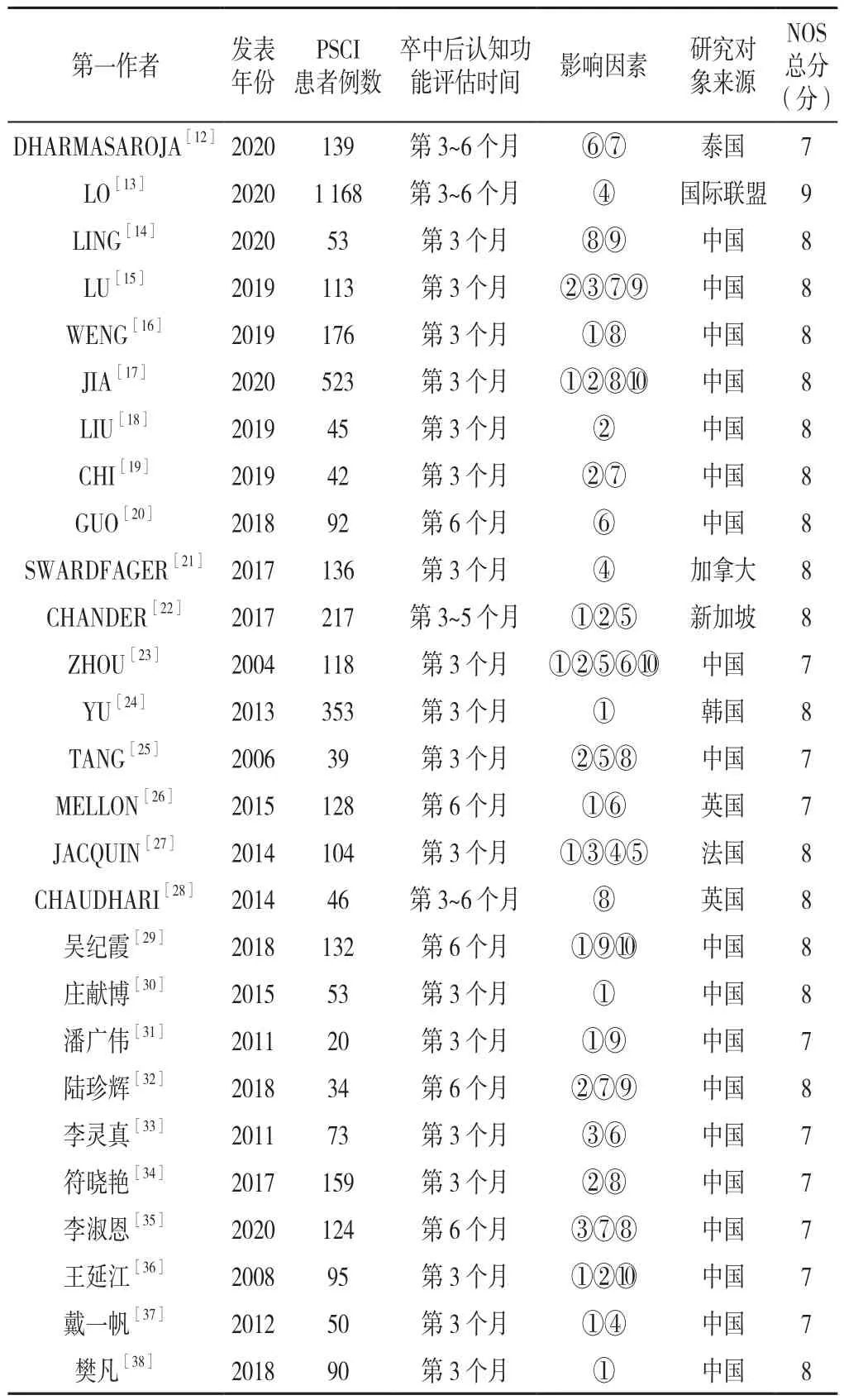
表2 纳入研究的基本特征及方法学质量评价Table 2 Basic characteristics and evaluation of methodological quality of included studies
2.3 Meta分析结果
2.3.1 年龄 13 项研究[16-17,22-24,26-27,29-31,36-38]结局指标涉及年龄,各研究间存在异质性(I2=89%,P<0.000 01),经敏感性分析后异质性未见明显改变,采用随机效应模型进行Meta分析,结果显示,年龄是缺血性脑卒中后3~6个认知障碍的影响因素〔OR=1.10,95%CI(1.06,1.14),P<0.000 01〕,见图2。

图2 年龄与缺血性脑卒中后3~6个月认知障碍关系的森林图Figure 2 Forest plot for relationship between age and cognitive impairment 3 to 6 months after ischemic stroke
2.3.2 受教育程度 10 项研究[15,17-19,22-23,25,32,34,36]结局指标涉及受教育程度,各研究间无异质性(I2=45%,P=0.06),采用固定效应模型进行Meta分析,结果显示,受教育程度是缺血性脑卒中后3~6个月认知障碍的影响因素〔OR=0.82,95%CI(0.78,0.85),P<0.000 01〕,见图3。
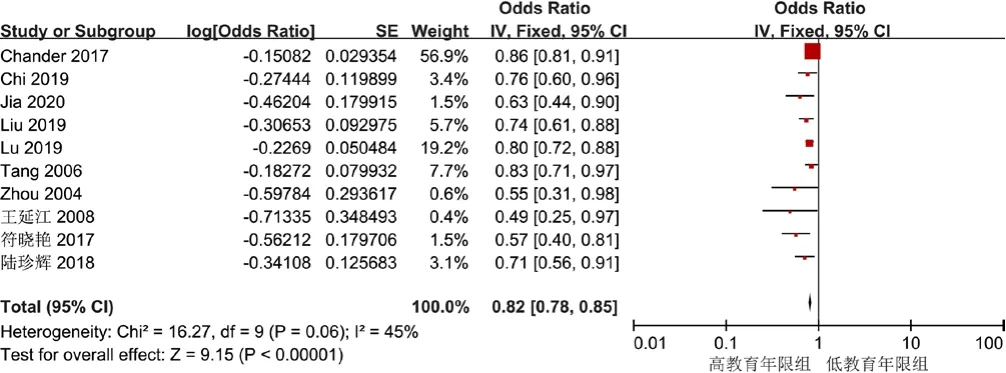
图3 受教育程度与缺血性脑卒中后3~6个月认知障碍关系的森林图Figure 3 Forest plot for relationship between educational level and cognitive impairment 3 to 6 months after ischemic stroke
2.3.3 高血压 4项研究[15,27,33,35]结局指标涉及高血压,各研究间无异质性(I2=35%,P=0.20),采用固定效应模型进行Meta分析,结果显示,高血压是缺血性脑卒中后3~6个月认知障碍的影响因素〔OR=2.69,95%CI(1.90,3.81),P<0.000 01〕,见图4。
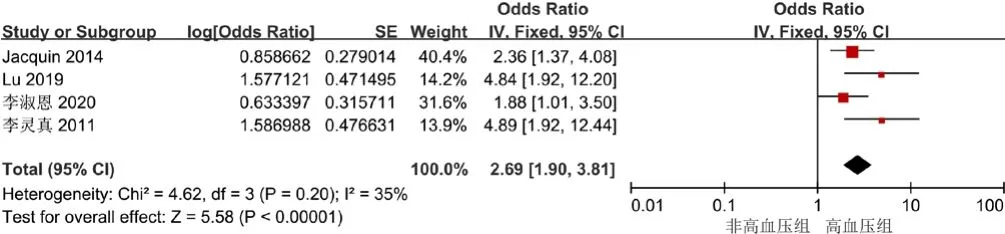
图4 高血压与缺血性脑卒中后3~6个月认知障碍关系的森林图Figure 4 Forest plot for relationship between hypertension and cognitive impairment 3 to 6 months after ischemic stroke
2.3.4 糖尿病 4项研究[13,21,27,37]结局指标涉及糖尿病,各研究间无异质性(I2=40%,P=0.17),采用固定效应模型进行Meta分析,结果显示,糖尿病是缺血性脑卒中后3~6个月认知障碍的影响因素〔OR=1.95,95%CI(1.58,2.39),P<0.000 01〕,见图5。

图5 糖尿病与缺血性脑卒中后3~6个月认知障碍关系的森林图Figure 5 Forest plot for relationship between diabetes and cognitive impairment 3 to 6 months after ischemic stroke
2.3.5 心房颤动 4 项研究[22-23,25,27]结局指标涉及心房颤动,各研究间无异质性(I2=0%,P=0.63),采用固定效应模型进行Meta分析,结果显示,心房颤动是缺血性脑卒中后3~6个月认知障碍的影响因素〔OR=2.92,95%CI(1.92,4.45),P<0.000 01〕,见图6。
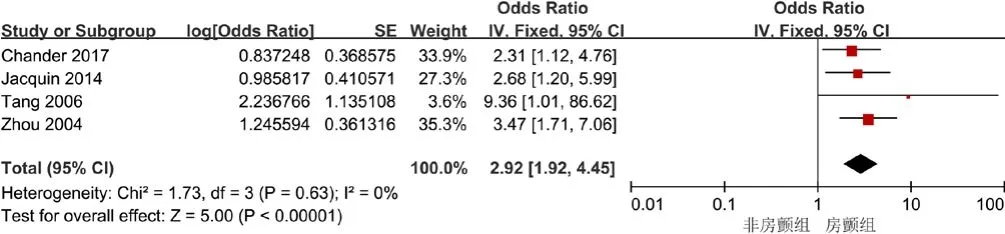
图6 心房颤动与缺血性脑卒中后3~6个月认知障碍关系的森林图Figure 6 Forest plot for relationship between atrial fibrillation and cognitive impairment 3 to 6 months after ischemic stroke
2.3.6 卒中史 5 项研究[12,20,23,26,33]结局指标涉及卒中史,各研究间无异质性(I2=0%,P=0.69),采用固定效应模型进行Meta分析,结果显示,卒中史是缺血性脑卒中后3~6个月认知障碍的影响因素〔OR=2.68,95%CI(1.95,3.68),P<0.000 01〕,见图7。

图7 卒中史与缺血性脑卒中后3~6个月认知障碍关系的森林图Figure 7 Forest plot for relationship between history of stroke and cognitive impairment 3 to 6 months after ischemic stroke
2.3.7 Fazakas评分 5 项研究[12,15,19,32,35]结局指标涉及Fazakas评分,各研究间无异质性(I2=32%,P=0.21),采用固定效应模型进行Meta分析,结果显示,Fazakas评分是缺血性脑卒中后3~6个月认知障碍的影响因素〔OR=1.86,95%CI(1.57,2.21),P<0.000 01〕,见图8。

图8 Fazakas评分与缺血性脑卒中后3~6个月认知障碍关系的森林图Figure 8 Forest plot for relationship between Fazakas score and cognitive impairment 3 to 6 months after ischemic stroke
2.3.8 入院时 NIHss 评分 7 项研究[14,16-17,25,28,34-35]结局指标涉及入院时NIHss评分,各研究间存在异质性(I2=74%,P=0.000 9),经敏感性分析后异质性未见明显改变,采用随机效应模型进行Meta分析,结果显示,入院时NIHss评分是缺血性脑卒中后3~6个月认知障碍的影响因素〔OR=1.44,95%CI(1.17,1.77),P=0.000 6〕,见图9。
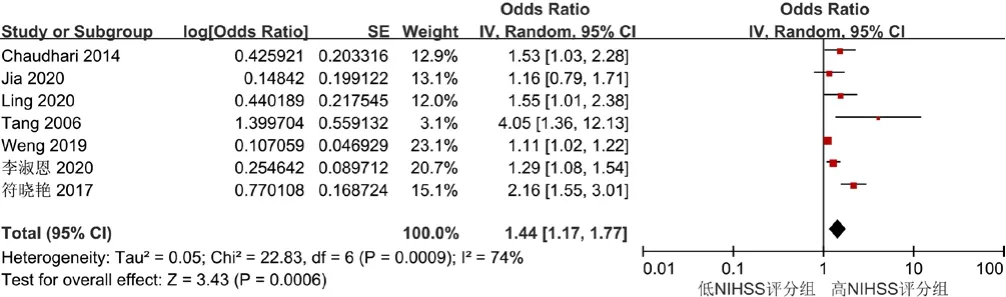
图9 入院时NIHss评分与缺血性脑卒中后3~6个月认知障碍关系的森林图Figure 9 Forest plot for relationship between NIHss score at admission and cognitive impairment 3 to 6 months after ischemic stroke
2.3.9 高同型半胱氨酸血症 5项研究[14-15,29,31-32]结局指标涉及高同型半胱氨酸血症,各研究间存在异质性(I2=61%,P=0.04),采用随机效应模型进行Meta分析,结果显示,高同型半胱氨酸血症是缺血性脑卒中后3~6个月认知障碍的影响因素〔OR=1.08,95%CI(1.02,1.14),P=0.006〕,见图10。经敏感性分析发现,吴纪霞等[29]研究是异质性的主要来源,并可能与该研究纳入的研究对象高同型半胱氨酸发生率较低、两组研究对象基线特征存在统计学差异有关;排除该研究后,各研究间无异质性(P=0.14,I2=45%),采用固定效应模型进行Meta 分析,其结果与剔除该研究前的Meta分析结果差异并不明显〔OR=1.08,95%CI(1.04,1.13),P<0.000 01〕。

图10 高同型半胱氨酸血症与缺血性脑卒中后3~6个月认知障碍关系的森林图Figure 10 Forest plot for relationship between hyperhomocysteinemia and cognitive impairment 3 to 6 months after ischemic stroke
2.3.10 饮酒 4 项研究[17,23,29,36]结局指标涉及饮酒,各研究间无异质性(I2=0%,P=0.65),采用固定效应模型进行Meta分析,结果显示,饮酒是缺血性脑卒中后3~6个月认知障碍的影响因素〔OR=2.85,95%CI(2.00,4.04),P<0.000 01〕,见图11。

图11 饮酒与缺血性脑卒中后3~6个月认知障碍关系的森林图Figure 11 Forest plot for relationship between drinking and cognitive impairment 3 to 6 months after ischemic stroke
2.4 敏感性分析 根据Meta分析结果,采用不同的效应模型进行敏感性分析,结果显示两种效应模型的OR值、95%CI、P值基本一致,提示Meta分析结果稳定性较高(表3)。

表3 Meta分析结果的敏感性分析Table 3 sensitivity analysis of Meta-analysis results
2.5 发表偏倚分析 绘制倒漏斗图并对Meta分析中纳入研究数量≥10项者进行发表偏倚分析,结果显示,年龄、受教育程度相关文献发表偏倚的倒漏斗图不完全对称,存在一定发表偏倚(图12)。
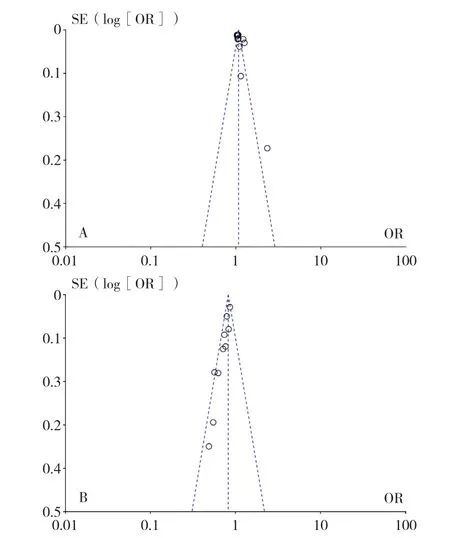
图12 年龄、受教育程度相关文献发表偏倚的倒漏斗图Figure 12 Funnel plot assessing the potential risk of bias in studies estimating relations of age and education level with cognitive impairment 3 to 6 months after ischemic stroke
3 讨论
认识障碍是卒中常见并发症之一,也是血管性痴呆的“前期症状”,在卒中后3~6个月发生率较高。随着对卒中及其相关认知障碍的研究深入,PsCI已成为当前国内外卒中领域研究热点之一。近年来,国际上开展了多项关于PsCI的影响因素的研究,但研究结果间尚存在争议。本研究聚焦于卒中后3~6个月,对卒中后认知功能的主要影响因素进行Meta分析,最终纳入了27项方法学质量较高的病例对照研究,研究对象来源于亚洲、欧洲、北美洲,覆盖面较广、具有一定代表性;Meta分析结果显示,年龄、受教育程度、高血压、糖尿病、心房颤动、卒中史、Fazakas评分、入院时NIHss评分、饮酒、高同型半胱氨酸血症是缺血性脑卒中后3~6个月认知障碍的影响因素。
增龄是导致认知功能减退的最直接的因素。王茂松等[39]研究表明,年龄越大、文化程度越低的患者脑可塑性降低越明显、智能储备越少,所表现出的智能障碍更加突出。我国一项社区老年人认知障碍调查结果显示,随着年龄增长,即使是非卒中患者也会在未干预和预防的情况下出现认知功能减退[40];另有研究表明社区老年人认知障碍发病率为12%~26%[41]。因此,对于卒中患者来说,即使由卒中造成的应激性认知功能损伤可能在短期内随着卒中病情好转、脑供血恢复和神经元代偿而减轻,但年龄本身仍是导致认知功能变化的一个重要因素,在今后的认知功能相关研究中,尤其是在关于长期认知功能变化及其临床结局的评价研究中,应充分考虑年龄对认知功能的影响。至于受教育程度对认知功能的影响,目前比较公认的观点是“接受更多的教育可能会延缓和推迟认知功能减退”。sHIN等[42]研究认为,受教育程度越高的患者认知储备越多,有助于预防与年龄相关的认知功能减退。总之,尽管年龄与受教育程度是不可控因素,但对于年龄较大、受教育程度较低的卒中患者,医护人员仍要主动对其进行认知障碍疾病知识与预防、干预相关指导,以降低PsCI发生风险。
既往研究证实,高血压会促使机体加快降解弹性纤维并增加细胞或结缔组织成分,长期高血压会导致脑血管、内皮细胞损伤并引发动脉粥样硬化[43],而这也是痴呆症的主要病理过程[15]。微血管功能障碍在糖尿病患者中普遍存在,而成年糖尿病患者脑微血管功能障碍也很明显,由于微血管参与调节多个大脑过程,因此糖尿病患者出现脑微血管功能障碍时认知功能也会受损[44]。CHATTERJEE等[45]研究发现,2型糖尿病患者认知障碍发生风险较非糖尿病患者升高约60%,且女性糖尿病者认知障碍发生风险较男性糖尿病患者升高约19%,但国内尚无相关研究证实糖尿病患者认知障碍发生风险存在性别差异,分析其原因可能与研究人群基线特征存在差异有关。心房颤动可能会导致患者血流动力学不稳定、引起脑组织灌注不足、造成神经元及神经胶质细胞缺血/缺氧,引发卒中时存在发生PsCI的高风险[46]。一项Meta分析结果显示,心房颤动导致的认知障碍可能是通过卒中介导而产生的,但尚不能证明心房颤动与认知障碍有直接关系,这与纳入研究的高异质性有关[47]。分析高同型半胱氨酸血症导致卒中后认知障碍的原因如下:高同型半胱氨酸血症会导致乙酰胆碱及其代谢产物减少,进而破坏脑血管内皮功能并造成局部脑组织缺血,累及额叶、颞叶等部位时导致记忆力下降、认知功能减退[15]。一项Meta分析结果显示,血液同型半胱氨酸水平每升高5 μmol/L则阿尔茨海默病发生风险增加15%[48],这为血液高水平同型半胱氨酸与阿尔茨海默病发生风险较高有关的观点提供了一定证据,但该证据是否适用于缺血性脑卒中后3~6个月认知障碍的发生尚待证实。鉴于高血压、糖尿病、心房颤动、高同型半胱氨酸血症等疾病也是老年人常见慢性病,因此积极控制血压、血糖、心房颤动、同型半胱氨酸等也是预防缺血性脑卒中后3~6个月认知障碍的关键。此外,还应对出院后的缺血性脑卒中患者进行健康宣教,使其积极戒酒、保持良好的生活方式,以减少认知障碍的发生。
大面积、多发病灶、反复发作的卒中对脑组织造成的损伤必然重于小面积、单发病灶、初发卒中,发生PsCI的可能性更大或更严重[49]。脑白质疏松是由多种原因引起的双侧对称性脑室旁及半卵圆中心区白质弥漫性斑片样改变,而Fazakas评分(总分0~6分)主要用于评定脑白质疏松严重程度[50],与磁共振成像(MRI)等临床监测脑白质疏松的影像学检查手段相比具有省时、信度和效度较好等优点,在临床上使用较为普遍。sZELEs等[51]研究表明,脑白质疏松患者可能同时存在多个认知领域损伤,并以视空间和执行能力、延迟回忆功能损伤最为明显。入院时NIHss评分是反映卒中严重程度的重要指标,不仅与患者住院期间康复效果有关,还与患者出院后预后紧密相关。研究表明,早期神经功能缺损或严重恶化会直接影响患者认知功能、生存时间、活动能力及后续康复治疗费用,进而增加患者及其照顾者经济、心理负担[52]。尽管本Meta分析纳入的结局指标涉及入院时NIHss评分的研究存在一定异质性,但仍提示入院时NIHss评分是缺血性脑卒中后3~6个月认知障碍的影响因素。因此,对于缺血性脑卒中患者,医护人员应注意早期评估其病情严重程度、积极治疗原发病以预防神经功能恶化,最终减少PsCI的发生。
综上所述,从研究对象来源看,人群分布于亚洲、欧洲、北美洲,覆盖面较广、具有一定代表性;从方法学质量来看,总体质量较高,研究结果具有一定可信度;从评估标准来看,不同研究使用了不同的认知功能评估量表,可能会导致结果出现差异,而由于各研究样本量、人群亦具有一定差异,因此部分研究间存在异质性;从敏感性分析结果来看,采用随机效应模型与固定效应模型得出的效应值变化不大,说明本Meta分析结果稳定性较好。需要指出的是,由于本Meta分析纳入的研究所涉及影响因素多为疾病相关指标、缺乏社会心理学因素,因此,今后的研究还应适当关注缺血性脑卒中患者心理状态以明确其对认知功能的影响。
总而言之,现有研究证据表明年龄、受教育程度、高血压、糖尿病、心房颤动、卒中史、Fazakas评分、入院时NIHss评分、高同型半胱氨酸血症、饮酒是缺血性脑卒中后3~6个月认知功能的影响因素,医务人员应根据上述影响因素和患者具体情况制定个性化康复治疗方案,以减少PsCI的发生。
作者贡献:汤爱洁负责文章的撰写、数据收集与整理;戴秀娟、胡鑫淼进行统计学处理、结果分析与解释;汪夏云进行论文的修订;吴茜负责文章的质量控制及审校,对文章整体负责、监督管理。
本文无利益冲突。

