低磁场冷冻对鲢鱼肌原纤维蛋白的作用
逯晓燕,刘 丽,黄文哲,丛海花,*,李 昊
(1.大连海洋大学食品科学与工程学院,辽宁 大连 116023;2.海洋食品精深加工关键技术省部共建协同创新中心,辽宁 大连 116034;3.西北农林科技大学机械与电子工程学院,陕西 杨凌 712100;4.英都斯特(无锡)感应科技有限公司,江苏 无锡 214000;5.长春皓月集团,吉林 长春 130062)
鲢鱼()是一种广泛养殖的淡水鱼,2021年产量达到381.29 万t,是新兴的鱼糜加工原料。鲢鱼肌原纤维蛋白(myofibrillary protein,MP)是鱼肉中最重要的蛋白质,约占总蛋白含量的50%~55%,在加工贮藏过程中,延缓MP变性很重要。冷冻和冷藏是长期保存鱼糜的重要方法,因为低温会抑制微生物生长,减缓酶的活性,并保留原始风味和营养成分。而在实际的冷冻过程中形成的冰晶会刺穿细胞,导致品质劣化,如持水力下降、汁液损失严重和蛋白变性等,这会对最终产品质量产生负面影响,所以亟需新的冷冻方案来优化。
低磁场冷冻是近年来新兴的冷冻方式,已经逐渐应用于果蔬、畜产品、微生物和医学材料的冷冻,其作用方式是将小的水分子团或单个分子转变为微冰晶形态,并加速通过冷冻相变阶段,保护细胞免受冰晶损伤。磁场冷冻最初被用于保存生物细胞和器官等医疗用途,例如:0.01 mT磁场、15 min保持时间和-30 ℃冷冻温度下,全牙细胞冷冻保存1 年后并未发现细胞损伤;Lin Chunyen等的研究小组在施加0.8 T的静磁场下,先在-5 ℃条件下保持10 min,之后以1 ℃/min的速率连续冷却到-55 ℃,最后在-80 ℃的冷冻机中贮藏24 h,结果发现,可使冻融红细胞的相对存活率提高20%。近几年低磁场在食品冷冻领域被广泛研究及应用,例如:在冷冻过程中,对牛肉施加磁场使其发生共振干扰了水分子结晶,显著降低了冰晶的增长速率和肉品的解冻损失;施加2 mT的静磁场,在-20 ℃条件下冷冻48 h后进行冻融实验,发现其可以显著保护冷冻面团免受冷冻损伤,使得谷蛋白结构更加稳定(解聚率降低24.26%);使用15.98 mT的永久磁场处理MP,发现其成核温度、相变时间和过冷时间分别降低2.79 ℃、1.76 min和0.80 min,这均证明了磁场有利于提高食品质量和降低能耗。
本研究主要通过测定表面疏水性、巯基含量、溶解度、浊度、热稳定性、傅里叶变换红外光谱、内源荧光光谱和紫外吸收光谱,研究低磁场冷冻对鲢鱼MP功能和结构变化的影响,为低磁场技术在食品冷冻和保鲜中的应用、进一步研究该技术与保鲜剂、抗冻剂等协同作用及相关产品的消化特性提供理论参考。
1 材料与方法
1.1 材料与试剂
鲜活白鲢鱼,购于辽宁省大连市熟食品交易中心。
三羟甲基氨基甲烷(tris-hydroxy-methy-laminomethane,Tris) 青岛捷世康生物科技有限公司;氯化钠 辽宁泉瑞试剂有限公司;尿素、十二烷基硫酸钠(sodium dodecyl sulfate,SDS) 国药集团化学试剂有限公司;8-苯胺基-1-萘磺酸钠(8-aniline-1-naphthalenesulfonic acid sodium,ANS)、5,5’-二硫代双(2-硝基苯甲酸)(5,5’-dithiobis-(2-nitrobenzoic acid),DTNB) 上海麦克林生化科技有限公司;乙二胺四乙酸(ethylene diamine tetraacetie acid,EDTA)天津致远化学试剂有限公司;乙醇 天津北联精细化学品开发有限公司;溴化钾(光谱纯) 天津大茂化学试剂厂;以上试剂均为分析纯。
1.2 仪器与设备
BL-310电子天平 北京赛多利斯仪器系统有限公司;UV-9000紫外-可见分光光度计 上海元析仪器有限公司;MFl-F1磁场冷冻冷藏箱 英都斯特(无锡)感应科技有限公司;TD5A-WS立式高速冷冻离心机湖南赫西仪器装备有限公司;PHSJ-4F精密数显pH计山东晨拓科学仪器有限公司;Synergy H1/H1M酶标仪美国伯腾仪器有限公司;F-2700荧光分光光度计 日本Hitachi公司;SL-Ⅲ数控层析冷柜、Scientz-30D真空冷冻干燥机 宁波新芝科技股份有限公司;Q20差示扫描量热仪 美国TA仪器公司;NEXUS670红外光谱仪 美国PerkinElmer公司;HH-6数显恒温水浴锅 国华电器有限公司; BCD-336WDPC冷藏箱 青岛海尔股份有限公司。
1.3 方法
1.3.1 鲢鱼MP的提取
参考李学鹏等的方法进一步修改。选取鲢鱼背部白肉,加入4 倍体积10 mmol/L Tris-HCl缓冲液(pH 7.2、4 ℃),均质15 s后于5 000 r/min离心15 min,取沉淀加入4 倍体积10 mmol/L Tris-HCl缓冲液(含0.6 mol/L NaCl、pH 7.2、4 ℃)混匀,均质10 s后于4 500 r/min离心20 min,取上清液用双缩脲法测定MP质量浓度。
1.3.2 样品冷冻处理
将提取的鲢鱼MP使用MFl-F1磁场冷冻冷藏箱采用2 mT低磁场(low magnetic field,LMF)结合-20 ℃冷冻,记为LMF组,0 mT磁场(no magnetic field,NMF)结合-20 ℃冷冻,记为NMF组,作为空白对照,用BCD-336WDPC冷藏箱-30 ℃常规冷冻(conventional freezing,CF),记为CF组,作为阳性对照,冷冻时间为28 d。表1为不同组别MP的冻藏条件。在测定各项指标之前,样品在4 ℃解冻过夜。

表 1 MP冻藏条件Table 1 Freezing conditions for MP
1.3.3 表面疏水性和巯基含量测定
表面疏水性的测定参考Shui Shanshan等的方法进一步修改。制备质量浓度分别为0.1、0.2、0.3、0.4、0.5 mg/mL的MP溶液,取2 mL溶液与10 µL ANS(含10 mmol/L ANS、20 mmol/L Tris,pH 7.5)充分混匀,避光冷藏(4 ℃)10 min。设置参数:激发波长375 nm,发射波长485 nm,增益50。以荧光强度为纵坐标,质量浓度为横坐标绘制标准曲线,斜率代表表面疏水性。
总巯基含量的测定参考Zhang Bin等的方法进一步修改。取5 mg/mL的MP溶液0.5 mL,加入4.5 mL缓冲液(含0.2 mol/L Tris、8 mol/L尿素、2 g/100 mL SDS,10 mmol/L EDTA,pH 6.8),取4 mL混合液与0.4 mL DTNB溶液混合,将溶液40 ℃水浴25 min后在412 nm波长处测定吸光度。
活性巯基含量的测定参考Hu Xin等的方法进一步修改。取0.5 mL 5 mg/mL MP溶液与4.5 mL缓冲液(含0.2 mol/L Tris、10 mmol/L EDTA,pH 6.8)混合,取2.5 mL混合液加入0.25 mL DTNB溶液,1 h避光反应(4 ℃)后在412 nm波长处测定吸光度。总巯基含量、活性巯基含量和二硫键含量分别按式(1)~(2)计算。


式中:为除去空白试剂后样品于412 nm波长处吸光度;为稀释倍数;为MP质量浓度/(mg/mL)。
1.3.4 溶解度和浊度测定
参考Amiri等的方法,取0.5 mL 5 mg/mL的MP溶液,用双缩脲法测定5 500 r/min、15 min离心前后的质量浓度。溶解度按式(3)计算。

式中:为离心后上清液MP质量浓度/(mg/mL);为离心前MP质量浓度/(mg/mL)。
参考严红波等的方法进一步修改。将1 mg/mL的MP溶液混匀,静置20 min,在340 nm波长处测定吸光度表示浊度。
1.3.5 热稳定性测定
参考Liu Shulai 等的方法进一步修改。取10 mg/mL的MP溶液,置于铝制坩埚进行称量(样品称量范围为12.0~18.0 mg),后压盖密封,以空坩埚为空白,在40~80 ℃温度扫描范围下,以10 ℃/min的升温速率进行扫描。
1.3.6 傅里叶变换红外光谱测定
参考蓝蔚青等的方法进一步修改。将0.002 g冻干样品与0.1 g干燥后的固体溴化钾混合。设置参数:分辨率4 cm,扫描范围500~4 000 cm,扫描次数40 次。对混合物进行光谱分析,用Peakfit软件对酰胺Ⅰ带(1 600~1 700 cm)进行拟合,计算二级结构相对含量。1.3.7 内源性荧光光谱和紫外吸收光谱测定
参考Niu Jianzhen等的方法进一步修改。使用荧光分光光度计对1 mg/mL MP溶液进行扫描,设置参数:激发波长295 nm,扫描范围300~450 nm。
参考Qiu Chunjiang等的方法进一步修改。使用紫外-可见分光光度计对1 mg/mL MP溶液进行扫描,以Tris-HCl缓冲液(含0.6 mol/L NaCl,pH 7.2)作为对照,扫描范围190~700 nm。
1.4 数据处理
所有指标数据均进行3 次平行实验,结果用平均值±标准差表示。用Origin 2021软件进行数据绘图。采用SPSS 22.0软件进行单因素方差分析,用Duncan’s法分析数据间差异显著性,<0.05表示差异显著。
2 结果与分析
2.1 不同冷冻处理对MP表面疏水性和巯基含量的影响
表面疏水性是评价蛋白质变性的一个重要指标,可以反映蛋白质中疏水氨基酸残基含量。由图1A可知:LMF组的表面疏水性显著低于NMF组(<0.05),说明冻藏期间施加低磁场可以显著抑制蛋白质疏水基团的暴露,其原因可能是磁场条件下,水分子倾向于重新定向和有序排列,从而在冷冻过程中实现固定传热,形成细小、均匀、光滑的冰晶,保护细胞免受破坏,从而使疏水基团的暴露减少;CF组的表面疏水性显著低于NMF组(<0.05),说明相同冷冻条件下,冷冻温度越低,抑制蛋白质疏水基团暴露的能力越大,这一发现与李学鹏等的研究相似,在-80 ℃冻藏条件下,大黄鱼的表面疏水性缓慢增加,且比-18 ℃的上升幅度小;LMF组(-20 ℃)与CF组(-30 ℃)并无显著差异,说明针对MP的表面疏水性,2 mT的低磁场作用可以节约10 ℃的冷冻温差,达到减少能源消耗的目的,这可能是由于低磁场能够加速样品冷冻降温过程导致的。
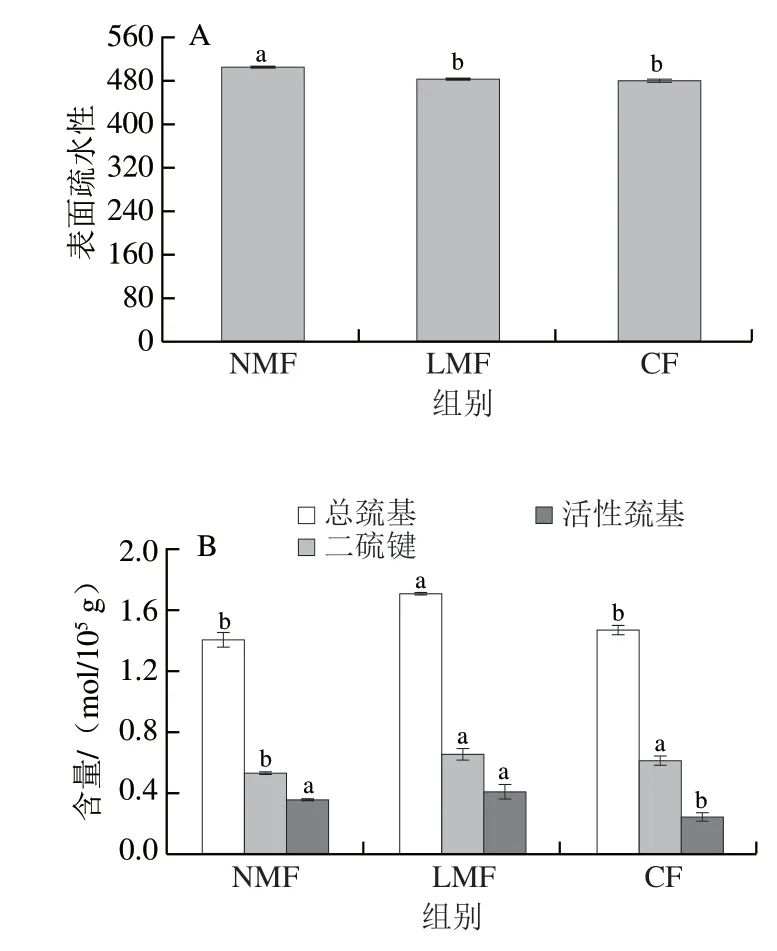
图 1 不同冷冻处理MP的表面疏水性(A)和总巯基、活性巯基及二硫键含量(B)Fig. 1 Surface hydrophobicity (A) and total sulfhydryl, active sulfhydryl and disulfdie bonds contents (B) of MP with different freezing treatments
巯基被认为是蛋白质中最具活性的官能团之一。随着蛋白质结构的展开,埋入蛋白质中的巯基可能暴露在表面,并被氧化成二硫键,导致巯基含量降低。由图1B可知,LMF组的总巯基和二硫键含量显著高于NMF组(<0.05),分别提高21.3%和24.4%,活性巯基含量差异不显著。Wu Di等发现,3 mT直流磁场可以使低盐MP凝胶的总巯基含量从1.58 μmol/g显著增加到3.21 μmol/g(<0.05),其原因是低磁场破坏了蛋白质分子中原有的二硫键,分子间二硫键的断裂使一些碎片分子聚集和重排,最后使得总巯基含量增加。最初埋藏在MP中的活性巯基在磁场作用下逐渐暴露到MP表面,导致活性巯基含量升高,然而也不排除分子间二硫键断裂的可能性;NMF组的总巯基含量略低于CF组,活性巯基含量显著高于CF组(<0.05),二硫键含量显著降低(<0.05),说明常规冷冻处理可以使得大量的活性巯基被氧化转变为二硫键,这是因为低温冷冻引起的蛋白质浓缩效应增加了分子间二硫键的交换反应,最终使得蛋白质变性;LMF组的总巯基和活性巯基含量显著高于CF组(<0.05),二硫键含量明显高于CF组,说明低磁场可以减缓活性巯基向二硫键转变,延缓MP变性。总之,低磁场会减小MP活性巯基含量的下降程度,从而抑制氧化,减少二硫键生成,使得MP变性程度减小。
2.2 不同冷冻处理对MP溶解度和浊度的影响
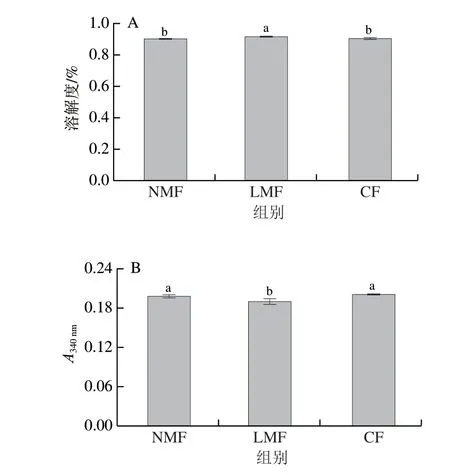
图 2 不同冷冻处理MP的溶解度(A)和浊度(B)Fig. 2 Solubility (A) and turbidity (B) of MP with different freezing treatments
溶解度是蛋白质重要的功能性质之一,蛋白质的变性和聚集会影响其溶解度的大小。由图2A可知:LMF组的MP溶解度显著高于NMF组(<0.05),说明低磁场冷冻延缓了MP溶解度的降低,改善了MP的功能性质;CF组略高于NMF组,这与Badii等的研究结果一致:低温可以使蛋白质溶解度下降速率减慢;LMF组与CF组相比,溶解度显著增加1.04%(<0.05),说明低磁场会促进MP溶解,这一结果与表面疏水性的结果一致。总的来说,低磁场冷冻会抑制MP中的疏水基团从内部暴露,增加了表面疏水性,减缓其变性程度,从而使得MP溶解度升高。
浊度是衡量MP聚集程度的指标。由图2B可知:LMF组的浊度显著低于NMF组(<0.05),降低4.44%,说明低磁场可以延缓MP氧化,延缓聚集的形成;CF组和NMF组的浊度差异不显著,但CF组的浊度更大,冷冻引起的MP氧化会导致MP中的官能团融合,从而形成聚集,使得浊度增加,说明-30 ℃的低温加剧了MP的聚集反应;与CF组(-30 ℃)相比,LMF组(-20 ℃)的浊度显著降低(<0.05),这一结果与溶解度结果一致,说明低磁场可以促进MP溶解,延缓MP的聚集,且效果非常明显。
2.3 不同冷冻处理对MP热稳定性的影响

表 2 不同冷冻处理MP的变性温度(Td) 与变性焓(ΔH)Table 2 Denaturation temperature (Td) and enthalpy (ΔH) of MP with different freezing treatments
和Δ是蛋白质热稳定性的重要指标。由表2可知,LMF组的显著高于NMF组和CF组(<0.05),分别增加20.13%和32.61%,说明低磁场可以显著提高MP的热稳定性(<0.05)。由于施加低磁场会使分子内氢键受到影响,水团破碎,从而造成自由水簇的减小,增加非冻结合水含量,从而保持其良好的热稳定性。NMF组的显著高于CF组(<0.05),这与Qian Shuyi等的研究相反,其认为冷冻温度越低,越高,原因可能是设备不同所造成的误差,还需进一步研究。此外,Δ也可表示蛋白质变性所需的能量。NMF组的Δ显著高于LMF和CF组(<0.05),说明NMF组的抗变性能力较强,所需的能量较少;LMF组和CF组的Δ无显著差异,表明低磁场冷冻和常规冷冻在诱导蛋白变性时需要相似的能量,而在这2 种冷冻方式下,LMF会节省10 ℃的冷冻温差,从而减少能源消耗,因此,选择低磁场更符合当下市场的要求。
2.4 不同冷冻处理对MP傅里叶变换红外光谱的影响
傅里叶变换红外光谱是观察蛋白质二级结构变化的重要方法。蛋白质的酰胺键有几种不同的振动模式,其中蛋白质二级结构(-螺旋、-折叠、-转角和无规卷曲)主要由酰胺Ⅰ带(1 600~1 700 cm)引起C=O伸缩振动。鲢鱼MP在500~4 000 cm的红外光谱如图3A所示。对不同冷冻处理的MP红外光谱进行拟合,根据-螺旋(1 650~1 660 cm)、-折叠(1 600~1 640 cm)、-转角(1 660~1 700 cm)和无规卷曲(1 640~1 650 cm)的特征峰识别MP经冷冻后的二级结构含量,结果如图3B所示。已有文献报道,-螺旋结构主要由多肽链的羰基氧(-CO)和氨基氢(-NH)之间的氢键维持,这些氢键会受到冷冻过程中物理效应(水分迁移、蛋白质的机械损伤和冰结晶)的影响而被干扰或破坏,使得蛋白质构象不稳定。

图 3 不同冷冻处理MP的傅里叶变换红外光谱(A)和二级结构含量(B)Fig. 3 Fourier transform infrared spectra (A) and secondary structure content (B) of MP with different freezing treatments
由图3A可知:1 645 cm附近的特征吸收峰是酰胺Ⅰ带C=O的伸缩振动,1 548 cm附近的特征吸收峰是酰胺Ⅱ带C-N的伸缩和C-H的弯曲;对比NMF组的红外谱图,经低磁场处理后的MP红外光谱中特征峰明显增强,表明低磁场可以保护MP结构免受破坏并抑制二级结构的转化。由图3B可知:与NMF组相比,LMF组的-螺旋含量相对较高,而-折叠含量较低,且-转角和无规卷曲含量相同。这与Zhou Hongling等研究的直流磁场冷冻对面团中谷蛋白二级结构的影响结果相似,证明低磁场能够抑制蛋白-螺旋结构的展开,从而减弱其转换成-折叠结构的作用,保持MP在冷冻期间的二级结构稳定性。NMF组的-螺旋含量高于CF组,提高22%;CF组的-转角和无规卷曲含量总体上高于LMF组,并且这2 种结构含量代表着蛋白质的聚集程度,说明经常规冷冻处理后,MP结构变得松散且不稳定,而低磁场冷冻可以更好维持MP二级结构的稳定性。这些结果表明,使用低磁场对MP进行冷冻处理,可以减少MP的损伤,抑制-螺旋结构的展开,证明MP变性程度更小,构象更稳定。且经过低磁场冷冻处理的MP氧化程度降低,活性巯基含量的变化同样证实了这一点。猜测由于低磁场改变了冰晶的形态,抑制了冰晶的生长,减少了冷冻过程中冰结晶的干扰破坏,维持一定的二级结构稳定性,但还有待进一步实验验证。
2.5 不同冷冻处理对MP内源性荧光和紫外吸收光谱的影响

图 4 不同冷冻处理MP的内源性荧光光谱(A)、最大荧光强度(B)和紫外吸收光谱图(C)Fig. 4 Endogenous fluorescence spectra (A), maximum fluorescence intensity (B)and UV absorption spectra (C) of MP with different freezing treatments
荧光强度通常受荧光能量照射影响,主要通过芳香族氨基酸(主要是色氨酸)的照射量来确定MP的三级结构变化。有研究报道,盐溶性MP的冷冻变性是因其分子间共价键或非共价键的形成而导致的聚集变性。由图4A可知,NMF、LMF和CF组的最大发射波长并没有发生移动,说明在不同的冷冻方式下,色氨酸所处的极性环境并不会发生变化。由图4B可知:NMF、LMF和CF组的最大荧光强度分别为211.93、210.6和285.67;LMF组的最大荧光强度与NMF组并无显著差异,说明无论低磁场是否存在都显示出较低的荧光强度;与CF组相比,LMF和NMF组的荧光强度显著降低(<0.05),分别下降35.6%和34.8%,说明不同的冷冻温度和低磁场冷冻均可延缓MP的聚集变性,但低磁场的效果更明显。
色氨酸和酪氨酸的残基侧链可以在紫外吸收光谱中产生相应的吸收峰。由图4C可知:MP在270~280 nm附近有特征吸收峰出现,LMF组和NMF组的吸收强度并无明显差异;与CF组相比,LMF组和NMF组的吸收强度均降低,一方面是由于冷冻温度所引起的,冷冻过程中MP聚集体的形成使暴露在外面的显色氨基酸基团再次被隐藏,导致NMF组的紫外吸收强度明显降低,且有研究表明,冷冻产生的冰晶会破坏蛋白质的三级结构,将部分埋藏的氨基酸残基暴露,导致吸收强度升高,因此,猜测另一方面的原因可能是磁场冷冻导致水分子倾向于重新有序排列,形成的冰晶可以减少对细胞的破坏,使氨基酸基团减少暴露,导致LMF组的吸收强度降低,表面疏水性的结果也证实了这一点。此外,LMF组的下降幅度较小,说明低磁场冷冻能维持MP三级结构的稳定性,氧化过程中巯基含量的降低也证明了低磁场可以维持三级结构的完整性。
3 结 论
研究低磁场冷冻对鲢鱼MP的影响,发现低磁场(-20 ℃、2 mT)处理可抑制MP内部残基的暴露和重排,并对蛋白结构有一定的保护作用。结果表明:与0 mT磁场冷冻相比,低磁场冷冻处理可以延缓表面疏水性升高,抑制疏水基团的暴露,也可以减缓活性巯基氧化成二硫键,保持结构的完整性,溶解度和浊度的结果同样证明了低磁场冷冻可以抑制MP的聚集,使MP具有良好的功能特性,低磁场冷冻还可以保持较高的热稳定性和二、三级结构的稳定性;常规冷冻处理同样也使得表面疏水性、活性巯基含量和热稳定性显著降低,而总巯基含量、溶解度和浊度无显著差异,且有更多的-螺旋转变为-折叠,使得MP结构不稳定;而0 mT磁场冷冻和常规冷冻处理之间内源性荧光光谱、紫外吸收光谱指标并无显著差异,说明0 mT磁场冷冻可以节约10 ℃的冷冻温差,减少能源损耗,以上结果可以说明低磁场冷冻比常规冷冻更适合用于MP冷冻,且是一种环保、减能的冷冻技术。
低磁场冷冻(2 mT)对同等条件下0 mT磁场冷冻的MP荧光强度和紫外吸收强度的影响并不显著,有待进一步实验验证。低磁场冷冻可以减少MP的氧化、聚集和变性,使MP的构象更稳定,并为低磁场冷冻工业化提供了基础依据,也为进一步研究该技术与保鲜剂、抗冻剂等协同作用及相关产品的消化特性提供了基础数据。

