宣肺调肠法治疗脓毒症相关急性呼吸窘迫综合征的临床观察
熊翼 江峰 陈鹏
(湖北省武汉市第七医院,湖北 武汉 430061)
脓毒症是由于宿主对感染应答失调所致的威胁其生命安全的器官功能障碍的全身性炎症反应[1]。由于肺脏是脓毒症早期最易累及的器官,脓毒症所致急性呼吸窘迫综合征(ARDS)发生率高达40%,其病死率随脓毒症加重而逐渐升高[2]。目前西医治疗脓毒症相关ARDS主要从积极治疗原发病、控制感染、呼吸支持、改善通气等方面出发[3],而中医学将脓毒症相关ARDS纳入“喘脱”“暴喘”“喘证”等疾病范畴,属本虚标实之证。近年来中西医结合治疗脓毒症相关ARDS在临床应用广泛[4-5],有助于进一步改善患者的临床症状,缓解机体炎症反应和改善呼吸功能。本研究主要探讨宣肺调肠法治疗脓毒症相关ARDS的临床效果。现报告如下。
1 资料与方法
1.1 病例选择 1)诊断标准:脓毒症符合文献[6]的诊断标准[6];ARDS诊断符合欧洲危重症协会制定的柏林定义和诊断标准[7];中医诊断参照《中医内科病证诊断疗效标准》[8]中气虚痰热腑实证的辨证标准。2)纳入标准:符合中西医诊断;年龄18~75岁;接受机械通气;自愿参与本次研究且签署知情同意书。3)排除标准:合并严重肝肾功能衰竭者;合并其他免疫性疾病、恶性肿瘤者;不能经鼻饲或灌肠给药者;过敏体质或已知对本研究所用中药成分过敏者;处于妊娠期或哺乳期的妇女。
1.2 临床资料 选取2018年8月至2020年12月本院收治的134例脓毒症相关ARDS患者为研究对象,按照患者入院顺序编号后,采用随机数字表法将其分为观察组与对照组各67例。观察组中男性41例,女性26例;年龄56~72岁,平均(65.25±2.58)岁;急性生理与慢性健康Ⅱ(APACHEⅡ)评分平均(22.05±1.97)分。对照组中男性44例,女性23例;年龄58~75岁,平均(65.59±2.42)岁;APACHEⅡ评分平均(22.36±1.85)分。两组临床资料比较,差异无统计学意义(P>0.05)。
1.3 治疗方法 对照组患者参照脓毒症指南[10]中脓毒症相关ARDS内容予以西医常规治疗,包括合理应用抗菌药物、积极治疗脓毒症原发病、营养支持、机械通气、稳定循环、肺保护通气策略等。观察组患者在对照组治疗基础上采用宣肺调肠法,组方:大黄、枳实、青皮各12 g,桑白皮、葶苈子各20 g,厚朴9 g。药材由本院制剂科提供制备,水煎取汁200 mL,分早晚饭后口服或胃饲,每日1剂。两组均治疗7 d。
1.4 观察指标 1)炎症因子:分别于治疗前、治疗后采集两组患者的外周静脉血样本,采用酶联免疫吸附法(ELISA)检测两组患者血清白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)水平,采用免疫发光法检测患者血清降钙素原(PCT)水平,操作严格遵循试剂盒说明书进行。2)血气分析指标:分别于治疗前、治疗后检测两组患者的动脉血气,包括二氧化碳分压(PaCO2)、酸碱度(pH),并计算氧合指数(PaO2/FiO2)。3)预后指标:记录两组患者治疗前后的APACHEⅡ评分和改良Marshall评分,得分越高提示临床预后越差。4)临床指标:记录两组患者ICU住院时间、累积机械通气时间和不良反应发生情况。
1.5 统计学处理 应用SPSS25.0统计软件。符合正态分布的计量资料以(±s)表示,比较用t检验;计数资料采用“%”表示,两组比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 两组治疗前后炎症因子水平比较 见表1。两组治疗后IL-6、TNF-α、PCT水平较治疗前明显下降(P<0.05),观察组治疗后IL-6、TNF-α、PCT水平显著低于对照组(P<0.05)。
表1 两组治疗前后炎症因子水平比较(±s)
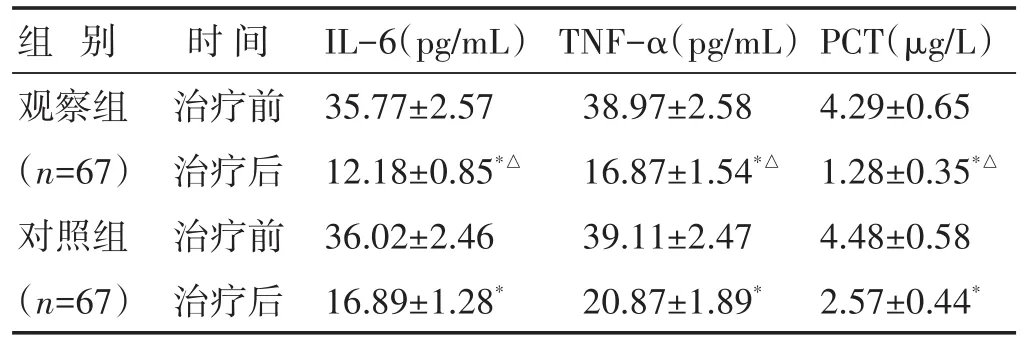
表1 两组治疗前后炎症因子水平比较(±s)
注:与本组治疗前比较,*P<0.05;与对照组治疗后比较,△P<0.05。下同。
组别观察组(n=67)对照组(n=67)时间治疗前治疗后治疗前治疗后IL-6(pg/mL)35.77±2.57 12.18±0.85*△36.02±2.46 16.89±1.28*TNF-α(pg/mL)38.97±2.58 16.87±1.54*△39.11±2.47 20.87±1.89*PCT(μg/L)4.29±0.65 1.28±0.35*△4.48±0.58 2.57±0.44*
2.2 两组治疗前后血气分析指标比较 见表2。两组治疗后PaCO2水平较治疗前明显下降,PaO2/FiO2水平较治疗前明显上升(P<0.05),观察组治疗后PaCO2、PaO2/FiO2水平显著优于对照组(P<0.05),两组治疗前后pH水平比较,差异无统计学意义(P>0.05)。
表2 两组治疗前后血气分析指标比较(±s)
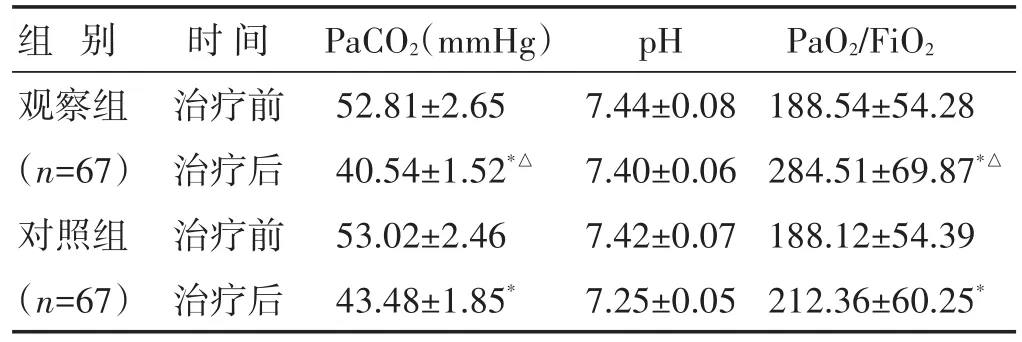
表2 两组治疗前后血气分析指标比较(±s)
注:1 mmHg≈0.133 kPa。
组别观察组(n=67)对照组(n=67)时间治疗前治疗后治疗前治疗后PaCO2(mmHg)52.81±2.65 40.54±1.52*△53.02±2.46 43.48±1.85*pH 7.44±0.08 7.40±0.06 7.42±0.07 7.25±0.05 PaO2/FiO2 188.54±54.28 284.51±69.87*△188.12±54.39 212.36±60.25*
2.3 两组治疗前后APACHEⅡ评分和改良Marshall评分比较 见表3。两组治疗后APACHEⅡ评分和改良Marshall评分较治疗前明显降低(P<0.05),观察组评分均显著低于对照组(P<0.05)。
表3 两组治疗前后APACHEⅡ评分和改良Marshall评分比较(分,±s)

表3 两组治疗前后APACHEⅡ评分和改良Marshall评分比较(分,±s)
组 别 时 间APACHEⅡ评分 改良Marshall评分观察组(n=67)对照组(n=67)治疗前治疗后治疗前治疗后22.05±1.97 11.25±0.81*△22.36±1.85 14.89±1.26*13.41±2.16 5.56±0.65*△13.72±2.32 7.81±1.72*
2.4 两组临床指标比较 见表4。观察组ICU住院时间和累积机械通气时间显著短于对照组(P<0.05),两组不良反应总发生率比较,差异无统计学意义(P>0.05)。

表4 两组临床指标比较
3 讨论
脓毒症患者发生相关ARDS时,常伴有腑气不利等情况,与中医学中的“肺与大肠相表里”理论相契合,即肺与大肠互为表里,肺失宣降则气不下行、津不下达,造成大肠传导失司,糟粕内阻,秽浊填塞中焦,腑气不通,加重肺气壅塞,出现喘促、暴喘等症,而肺气壅塞与腑气不通相互影响,进一步加重病情;同时热毒内陷脏腑,肺为娇脏,首先被犯,毒瘀阻滞于肺络逐渐加重,热移于肠,热结肠燥,气机壅滞,上逆为喘,肺功能进一步受损,毒瘀日久至痼,肺气骤虚,气虚则无以行气血,内生浊邪,外来邪毒与内生浊邪相搏结,损伤元气,致使脏腑虚衰[11]。现代医学研究认为肠道是机体最大的细菌库和内源性毒素的源头[12],因此本研究治疗脓毒症相关ARDS主要遵循肺肠同治法。
既往研究发现[13],将“肺肠同治法”应用于肺系疾病中效果良好,可通过黏膜免疫、神经系统等方面调控机体肺-肠微生态,进而提高临床疗效。本研究所用的宣肺调肠法则是根据“肺与大肠相表里”理论制定而成。方中大黄通腑泻热、泻下攻积,枳实化痰除痞,厚朴行气导滞,降逆平喘,三药合用共起“通腑”之功效;桑白皮泻肺平喘,葶苈子泻肺平喘,青皮消积化滞,三药合用起“宣肺调肠”之功效,诸药合用,共奏通腑宣肺调肠、平喘祛痰之功效。现代药理学研究发现,大黄可显著缓解机体炎症反应,发挥保护血管内皮、保护肺泡上皮的作用[14]。枳实具有良好的兴奋胃平滑肌作用,有助于促进肠道蠕动[15]。相关实验研究指出[16-17],肺肠组织黏膜免疫的同步反应在ARDS的“肺肠同病”中发挥着重要作用,而通过应用宣肺调肠法能够进一步改善机体肺部通气功能和肠屏障功能,缓解机体局部炎症反应水平,进一步减轻临床症状,延缓病情进展。
国内外学者研究指出[18-19],大量炎性细胞因子合成释放导致血清中促炎因子,如IL-6、TNF-α等水平迅速升高,是反映ARDS患者病情严重程度的重要指标。PCT是一种降钙素前体蛋白,机体出现炎症后可迅速升高,与机体预后和病情严重程度存在密切关联。本研究通过选取IL-6、TNF-α、PCT为炎症反应的观察指标,结果显示:观察组患者经过治疗血清IL-6、TNF-α、PCT水平明显低于对照组,表明宣肺调肠法治疗脓毒症相关ARDS,可进一步降低患者血清IL-6、TNF-α、PCT水平,有助于降低机体炎症反应。本研究中观察组治疗后PaCO2、PaO2/FiO2水平显著优于对照组;APACHEⅡ评分和改良Marshall评分显著低于对照组,ICU住院时间和累积机械通气时间显著短于对照组,进一步证实了宣肺调肠法在脓毒症相关ARDS的治疗中应用效果良好,可改善其动脉血气指标,缩短ICU住院时间和累积机械通气时间,缓解病情严重程度。此外两组不良反应发生率无统计学差别,提示宣肺调肠法治疗脓毒症相关ARDS不会增加不良反应发生率,安全性良好。
综上所述,宣肺调肠法治疗脓毒症相关ARDS效果良好,在抑制机体炎症反应、改善动脉血气指标、缩短ICU住院时间和累积机械通气时间以及缓解病情严重程度等方面效果显著优于单纯西医治疗,且安全性良好。由于本研究时间和设备有限,关于宣肺调肠法治疗脓毒症相关ARDS的具体作用机制有待进一步研究。

