补肺颗粒含药血清对哮喘气道平滑肌细胞及气道血管生成的影响研究*
刘 健 孙 洁 曹慧丹
(1.天津中医药大学第二附属医院,天津 300250;2.天津中医药大学,天津 300193)
支气管哮喘(哮喘)是常见的慢性呼吸道疾病,气道重塑被认为是引起哮喘气道高反应性和不可逆性气道阻塞的病理基础,是哮喘难治的根本原因[1-2]。抑制气道重塑这一病理过程,对于改善哮喘患者肺功能、提高生活质量具有很重要的意义。全球哮喘防治倡议组织(GINA)推荐哮喘的一线治疗方案包括吸入糖皮质激素及支气管扩张剂等,虽有部分数据显示,其可能通过干预气道慢性炎症间接改善或延缓气道重塑,但并无证据表明其直接疗效,其作用有限且长时间使用糖皮质激素也存在一系列不良反应[3]。因此,亟待研究新的气道重塑干预药物和手段。
中药复方补肺颗粒针对哮喘长期反复发作出现“气虚血瘀”的病理变化,能起到补益肺肾之气、活血通络祛瘀之用。前期临床研究表明,补肺颗粒能够有效改善哮喘缓解期患者的气道阻塞并改善小气道通气功能,提高哮喘患者的控制水平,减少哮喘症状急性发作[4-5]。本研究旨在观察补肺颗粒对哮喘气道平滑肌细胞及气道血管生成的影响,探讨其作用机制。
1 材料与方法
1.1 实验动物 健康清洁BALB/C雌性SPF级小鼠30只,6~8周,体质量18~22 g。所有小鼠均购自北京华阜康生物科技股份有限公司,许可证号:SCXK(京)2019-0008。饲养于天津中医药大学动物实验中心动物房,温度20~26℃,湿度40%~70%,通风次数为15次/h全新风,光照为12 h明、12 h暗。
1.2 试剂与药物 1)药物:补肺颗粒由天津中医药大学第二附属医院药剂室提供。主要成分为党参20 g,熟地黄20 g,山茱萸肉20 g,赤芍20 g,当归20 g,炙麻黄6 g,陈皮20 g,紫菀10 g,黄芩 10 g,桑白皮20 g,甘草6 g。将其制成1 g/mL的水溶液备用。2)试剂:OVA Al(OH)3混合液:以10 mg卵蛋白干粉(Sigma,批号:SLCG1876)溶于5 mL生理盐水中,摇匀。取其中1 mL加入4 mL 0.9%氯化钠注射液,再加入等体积(5 mL)氢 氧 化 铝(Thermo Fisher Scientific,批 号 :VC298268)摇匀。每次使用前需新鲜配制。兔抗VEGF单克隆抗体(abcam,批号:Ab52917),兔抗内皮抑素单克隆抗体(abcam,批号:Ab207162),兔抗羊IgG二抗(中杉金桥生物技术,批号:ZB-2301),Anti-GAPDH(bioworld,批号:AP0063)。
1.3 实验仪器 纯水仪(宁波丹斯博顿环保科技责任有限公司,CM-RO-C2);紫外分光光度计(上海让奇仪器科技有限公司,D8PCS);研磨器(上海净信实业发展有限公司,MY-10);电泳仪(北京六一生物科技有限公司,DYY-6C);电泳槽(北京六一生物科技有限公司,DYCZ-40D);转膜槽(北京六一生物科技有限公司,DYCZ-40G);凝胶玻璃板、固定夹(北京六一生物科技有限公司);万分位天平(奥豪斯国际贸易有限公司,PR SERIES);全自动化学/荧光/凝胶成像分析系统(北京赛智创业科技有限公司,Champchemi 610 plus);制冰机(常熟市雪科电器有限公司,IMS-50);低温高速离心机(北京新时代北利医疗仪器设备有限公司,GTR16-2);摇床(泰州诺米医疗,NMYA-60);-80℃医用冰箱(海尔,DW-86L338J);鼓风式干燥箱(上海锦屏仪器仪表有限公司,101-3);实时定量PCR仪(美国应用生物系统公司);PCR仪(珠海黑马医学仪器有限公司,Hema9700)。
1.4 含药血清制备 BALB/C小鼠18只随机分为对照组、高剂量组和低剂量组,每组小鼠各6只,实验前先禁食12 h。参照文献[6]中动物体表面积比率换算等效剂量,低剂量组、高剂量组分别按照1.42 g/(kg·d)、2.84 g/(kg·d)剂量给予中药灌胃,每日2次,连续给药3 d。对照组给予等量生理盐水灌胃。在末次给药后,于无菌条件下自心脏处采血,离心血清(3 000 r/min,4℃,20 min),血清经56℃、30 min灭活,0.22 μm微孔滤膜过滤除菌后分装,于-20℃条件下冷冻备用。
1.5 模型制备 BALB/C小鼠12只,参照文献[7],以OVA Al(OH)3混合液腹腔注射致敏及雾化吸入OVA激发的方法制作哮喘小鼠模型,具体制作模型方法如下:小鼠经适应性饲养1周后,于造模第1日、第14日腹腔注射0.1 mL OVA Al(OH)3混合液,自第21日起予以0.1%OVA溶液雾化吸入,隔日1次,每次30 min,共雾化18次。
1.6 支气管平滑肌细胞(ASMC)分离培养、分组及干预 小鼠造模成功后处死,分离肺组织并剥脱肌层、剪碎,用0.25%胰蛋白酶,38.5℃水浴消化2 h左右。1 000 r/min离心5 min后,弃上清。加入培养基,在20%O2、5%CO2、37 ℃培养箱培养,每2~3天换液1次,待14 d左右时观察90%细胞融合后,传代培养,实验选用2~5代细胞。接种于96孔板,培养24 h后,中药组分别给予中药低、高剂量含药血清,对照组予正常血清。同时换用含体积分数10%胎牛血清的RPMI1640培养基继续培养24 h后,进行后续实验。
1.7 观察指标 1)测定ASMC增殖率:在96孔板中接种细胞悬液每孔100 μL,细胞的接种数量约为每孔5 000个细胞。每孔加入10 μL的CCK8溶液,以加相应量的细胞培养基和CCK8不加细胞的孔作为空白对照,在细胞培养箱内继续孵育4 h。用酶标仪测定在450 nm处的吸光度值。Graphpad5.0计算抑制率。抑制率(%)=(1-OD给药组/OD对照组)×100%。2)Western blotting测定ASMC血管内皮生长因子(VEGF)、内皮抑素(ES)相对表达:提取总蛋白,用BCA法蛋白定量。随后进行蛋白凝胶电泳,当电泳完成后,通过转移电泳方式转印至固相支持物上。5%脱脂奶粉封闭1 h。分别加兔抗VEGF单克隆抗体(1∶10 000稀释)及兔抗内皮抑素单克隆抗体(1∶5 000稀释)孵育过夜。加入酶标记的兔抗羊IgG(1∶5 000稀释)二抗孵育2 h。以甘油醛-3-磷酸脱氢酶(GAPDH)为内参。用Image J软件分析灰度值。3)RT-PCR检测ASMC VEGF mRNA及ES mRNA相对表达:制备组织细胞总RNA,计算RNA浓度,按照RT-PCR试剂盒进行反转录反应,产物于-20℃保存。利用PubMed查找相关基因序列,并利用引物合成软件Primer Premier5.0设计引物(表 1)。RT-PCR反应体系:体积为 25 μL;Oligo(dT)18(50 pmol/μL)1 μL,RNA模板1 μg,DEPC水加水补齐至13.4 μL,70 ℃ 5 min,冰冻10 min,MLV(RT)1 μL,5×Buffer 5 μL,Dntp 5 μL,Recombinant Rnase Inhibitor 0.6 μL,42℃,60 min。反应程序:50℃预变性2 min,95℃预变性2 min,95℃变性15 s,56~58℃退火加延伸1 min,45个循环。

表1 RT-PCR引物系列
1.8 统计学处理 应用SPSS22.0统计软件。计量资料以(±s)表示。两样本均数比较采用t检验,多个样本均数比较行单因素方差分析,不符合正态分布的采用秩和检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组小鼠ASMC增殖情况比较 见表2。结果显示,与对照组相比,中药高剂量组和低剂量组的OD值显著降低,差异有统计学意义(P<0.01)。
表2 各组小鼠ASMC增殖情况比较(%,±s)
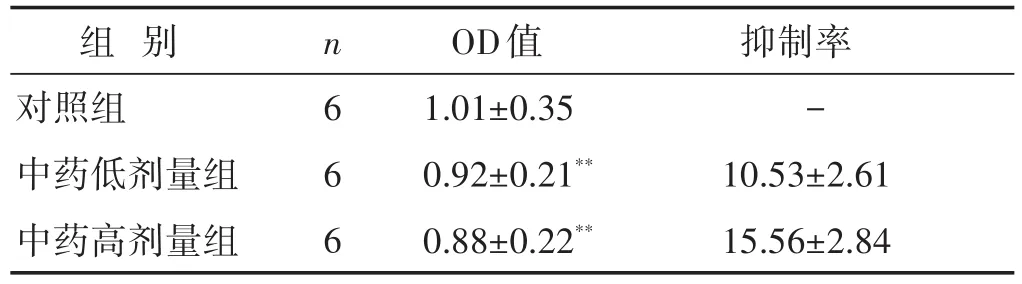
表2 各组小鼠ASMC增殖情况比较(%,±s)
注:与对照组比较,*P<0.05,**P<0.01;-为无数据。下同。
组别对照组中药低剂量组中药高剂量组n 6 6 6 OD值1.01±0.35 0.92±0.21**0.88±0.22**抑制率-10.53±2.61 15.56±2.84
2.2 各组小鼠ASMC VEGF及ES相对表达量的比较 见表3,图1。分析结果显示,中药低剂量组和高剂量组的VEGF及内皮抑素的相对表达显著降低,与对照组比较,差异有统计学意义(P<0.05)。
表3 各组小鼠ASMC VEGF及ES相对表达量的比较(±s)
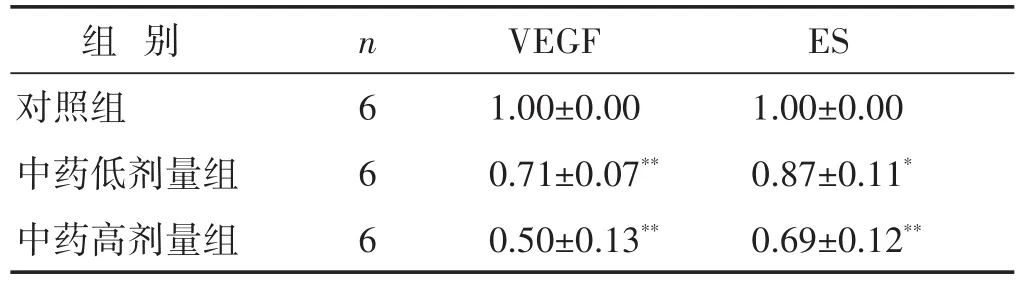
表3 各组小鼠ASMC VEGF及ES相对表达量的比较(±s)
组别对照组中药低剂量组中药高剂量组n 6 6 6 VEGF 1.00±0.00 0.71±0.07**0.50±0.13**ES 1.00±0.00 0.87±0.11*0.69±0.12**
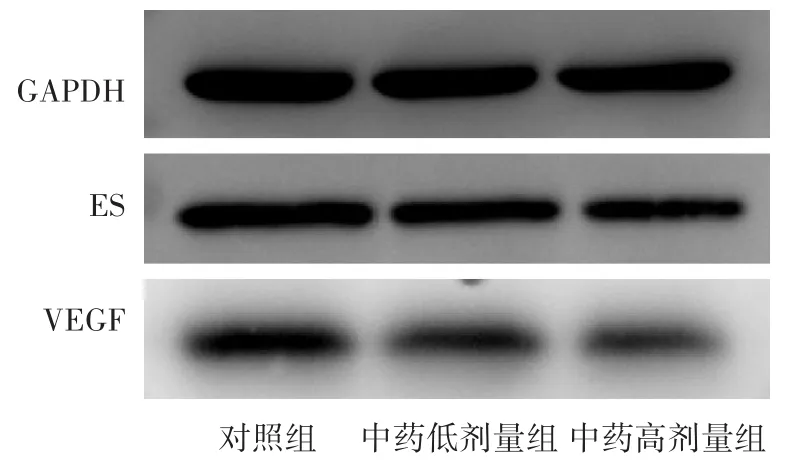
图1 各组ASMC VEGF及ES表达
2.3 各组小鼠VEGF mRNA及ES mRNA相对表达量的比较 见表4。分析结果显示,中药高剂量组的VEGF mRNA及ES mRNA的相对表达显著降低,与对照组比较,差异有统计学意义(P<0.01)。低剂量组ASMC VEGF及ES相对表达有下降趋势,但差异无统计学意义(P>0.05)。
表4 各组小鼠VEGFmRNA及ESmRNA相对表达量的比较(±s)
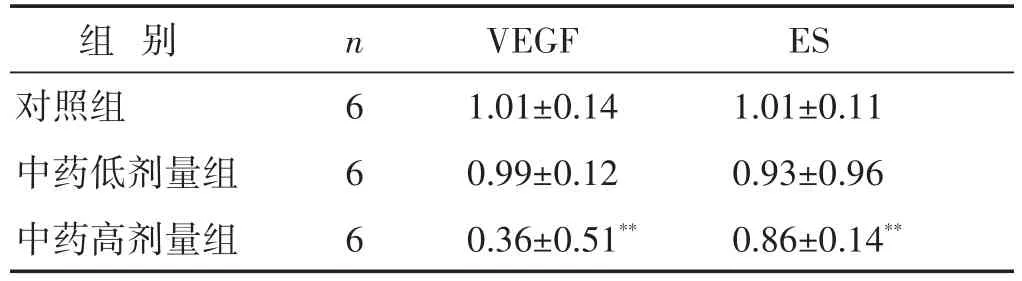
表4 各组小鼠VEGFmRNA及ESmRNA相对表达量的比较(±s)
组别对照组中药低剂量组中药高剂量组n 6 6 6 VEGF 1.01±0.14 0.99±0.12 0.36±0.51**ES 1.01±0.11 0.93±0.96 0.86±0.14**
3 讨 论
哮喘患者ASM质量的增加是与哮喘严重程度、肺功能下降和气道收缩增强相关的气道重塑关键特征。目前,除了支气管扩张剂外,尚无其他临床批准的有效药物专门针对ASM收缩和增生。炎症细胞分泌的多种生长因子和细胞因子参与了ASMC的生长和分裂,其中VEGF是内皮细胞生长、血管生成和增加血管通透性的强效诱导剂,在促进血管生成、重塑中发挥重要作用[8-9]。因此抑制VEGF的分泌能够降低基底膜厚度、减少杯状细胞增生[10]。最近研究发现,由ASMC分泌的VEGF在纤维连接蛋白分泌、细胞外基质调节、平滑肌肥大和重构中发挥重要作用[11]。因此,Sung-Ho Kim等通过抑制VEGF诱导的信号传导通路实现了对ASMC增殖的抑制作用[12]。ES作为内皮细胞增殖、迁移和血管生成的专一性抑制因子,具有强大的抑制血管生成的作用,这为抗血管生成治疗提供了理论依据。Asai等[13]研究发现哮喘患者诱导痰中VEGF与ES水平存在相关性,且二者的不平衡会导致血管生成,从而对哮喘发病有重要影响。Kim等[14]发现ES等阻断VEGF与受体结合及其下游分子磷酸化过程,最终抑制VEGF的促血管生成作用,且内皮抑素对VEGF促血管生成作用的抑制率能达到50%。因此,调节VEGF及ES水平对于调节哮喘气道血管生成有重要意义。这些为我们的治疗提供了思路。
传统中医理论认为“久病入瘀”,由于哮喘的反复发作,肺气不能布津行血而致血行不畅,瘀血内生,且痰浊阻滞,气血不畅,亦可生瘀。痰凝血瘀伏藏于肺,影响肺脏正常的宣发肃降功能,导致哮喘发作。因此“气虚血瘀”是哮喘反复发作的主要病理变化。这种痰瘀气阻的病理特征使病情迁延,缠绵难愈,与现代医学关于哮喘气道重塑细胞外基质沉积,支气管平滑肌增生,血管通透性增加,炎性分泌物增多,气道壁血管增生重塑,结果导致气道狭窄,缺血缺氧,严重影响气道通气功能的认识有相通之处[15],这些都符合哮病“气虚血瘀”的基本病机。因此哮病“气虚血瘀”病机与哮喘气道重塑及血管生成必然的相关性。针对这一病理变化孙增涛教授制定了“补气活血”的基本法则,以补肺颗粒干预哮喘旨在起到补益肺肾之气、活血通络祛瘀之用。前期临床研究表明,补肺颗粒能够有效改善哮喘缓解期患者的气道阻塞并改善小气道通气功能,提高哮喘患者的控制水平,减少哮喘症状急性发作[4-5]。
本次实验表明,补肺颗粒含药血清能有效抑制哮喘气道平滑肌细胞的增殖,且随着药物剂量增加其抑制作用随之增强。补肺颗粒含药血清可显著降低气道平滑肌细胞VEGF及ES的相对表达,且随着药物剂量增加其降低作用更明显。尤其是高剂量含药血清能够降低气道平滑肌细胞VEGF mRNA及ES mRNA的相对表达,这一点与低剂量组有差异,提示药物剂量与效果之间有一定关联,临床中需要足量给药能够更好地发挥作用。
综上所述,补肺颗粒含药血清能通过有效抑制哮喘小鼠气道平滑肌细胞增殖,进而改善哮喘气道重塑状态。其作用机制可能与抑制VEGF及内皮抑素表达,调节气道血管生成有关。

