脉冲式高容量血液滤过治疗脓毒症多脏器功能衰竭患者的疗效评价
刘晓刚
(郑州大学附属郑州中心医院重症医学科 河南 郑州 450000)
脓毒症为重症医学科常见病,与革兰阴性菌感染有关,相关调查数据显示,全球每年约有1 900 万以上脓毒症患者,其中因治疗不及时导致死亡的患者可达530 万人,而随着人们饮食、生活习惯等改变,这一数值还在持续增长,已成为全球一个重大公共卫生问题。脓毒症典型症状为少尿、寒战、发热、意识障碍等,不同患者临床表现也有所差异,随着病情的进一步发展,大量促炎、抗炎介质大量溢出,将引发酸碱平衡失调、应激性溃疡、多脏器功能衰竭(MOF)等并发症,严重威胁患者生命安全[1~2]。血液净化为现阶段脓毒症MOF 的常用治疗手段,其借助外界过滤装置将患者机体中有害物质予以清除,可减少机体炎症介质,降低并发症发生率,延长患者生存期,提高患者的生活质量,对于患者的身体健康有着重要意义[3]。脉冲式高容量血液滤过(PHVHF)、连续性静脉-静脉血液滤过(CVVH)为目前常用血液净化模式,优劣性不一。基于此,本研究选取脓毒症MOF 患者,旨在探讨PHVHF 的应用效果。现报道如下:
1 资料与方法
1.1 一般资料 选取郑州大学附属郑州中心医院重症医学科2018 年4 月至2020 年3 月收治的82例脓毒症MOF 患者,依照随机数字表法分PHVHF组和CVVH 组,各41 例。PHVHF 组女18 例,男23例;年龄52~67 岁,平均(59.23±3.42)岁;发病时间1~24 d,平均(12.53±3.17)d;体质量51~58 kg,平均(54.35±1.58)kg;感染疾病类型:重症肺炎19 例(46.34%)、肠道感染5 例(12.20%)、重症胰腺炎10例(24.39%)、腹腔感染7 例(17.07%)。CVVH 组女16 例,男25 例;年龄53~68 岁,平均(60.46±3.64)岁;发病时间1~26 d,平均(13.09±3.74)d;体质量52~57 kg,平均(54.62±1.08)kg;感染疾病类型:重症肺炎20 例(48.78%)、肠道感染4 例(9.76%)、重症胰腺炎12 例(29.26%)、腹腔感染5 例(12.20%)。两组一般资料均衡可比(P>0.05)。本研究经医院医学伦理委员会批准同意(伦理号:202243)。
1.2 入组标准 (1)纳入标准:符合《中国脓毒症/脓毒性休克急诊治疗指南(2018)》诊断标准[4];存在不同程度水肿、少尿、血肌酐增高、低氧血症等现象;年龄52~68 岁;病例资料完整;患者及家属均知情本研究,签署知情同意书。(2)排除标准:合并脑血管疾病、急性心脏损伤、恶性肿瘤;合并原发性免疫系统病、血液系统病、急性传染性病;合并血流动力学不稳,无法行血液滤过;拒绝或中途退出本研究。
1.3 治疗方法 入院后对两组均采用抗感染、抗休克、营养支持、控糖、护胃等常规治疗,调节患者机体酸碱平衡,改善水电解质紊乱症状,之后行血液净化治疗,治疗前由专门的医护人员对患者及家属进行健康宣教,增加患者对血液净化治疗方法、作用机理、预期效果、注意事项等相关知识的了解,提高患者对治疗的配合度,获取家属对医护工作的理解。本研究所用仪器设备:股静脉置管、CRRT 机(百特公司)、血滤器(德国费森尤斯AV600S),血流量为200~250 ml/min,置换液稀释比例为3:2。CVVH 组采用CVVH 治疗,置换液剂量为45 ml/(kg·h),治疗时间为48 h。PHVHF 组采用PHVHF 治疗,开始置换液剂量为90 ml/(kg·h),持续8 h,置换液剂量调整为45 ml/(kg·h),持续16 h,24 h 为一个循环周期,持续治疗2 个循环周期。
1.4 观察指标 (1)两组病情程度。以脓毒症相关性器官功能衰竭评分(SOFA)、急性生理与慢性健康状况Ⅱ评分(APACHE Ⅱ)评定。SOFA:0~24 分,得分越高病情越重;APACHE Ⅱ:0~71 分,得分与病情程度呈正相关。(2)两组血清炎症介质水平。取3 ml静脉血,离心(3 000 r/min,10 min),分离,取上清液,以酶联免疫吸附法测定两组血清肿瘤坏死因子-α(TNF-α)、白细胞介素-10(IL-10)、C 反应蛋白(CRP)水平,试剂盒购自美国Genzyme 公司。(3)两组血管内皮功能。空腹取3 ml 静脉血,离心(3 000 r/min,10 min),分离,取上清液,以双抗体夹心酶联免疫吸附法测定两组血管性假血友病因子(vWF)水平,试剂盒购自上海钰博生物科技公司,以放射免疫法测定两组内皮素-1(ET-1)水平,试剂盒购自上海远慕生物公司。(4)分别记录两组患者治疗前后白细胞计数(WBC)、谷丙转氨酶(ALT)、天门冬氨酸氨基转移酶(AST)水平变化,了解患者病情状况。
1.5 统计学方法 采用SPSS22.0 统计学软件处理数据,计量资料以(±s)表示,用t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组SOFA、APACHE Ⅱ评分对比 治疗前,两组SOFA、APACHE Ⅱ评分对比无显著差异(P>0.05);治疗后,两组SOFA、APACHE Ⅱ评分均降低,且PHVHF 组低于CVVH 组(P<0.05)。见表1。
表1 两组SOFA、APACHE Ⅱ评分对比(分,±s)

表1 两组SOFA、APACHE Ⅱ评分对比(分,±s)
注:与同组治疗前比较,*P<0.05。
SOFA 评分治疗前 治疗后PHVHF组CVVH组组别 n APACHE Ⅱ评分治疗前 治疗后41 41 t P 28.42±3.23 27.64±3.08 1.119 0.267 11.96±1.56*14.35±2.10*5.850 0.000 12.41±2.24 12.87±2.72 0.836 0.406 7.34±1.02*9.15±1.38*6.754 0.000
2.2 两组IL-10、TNF-α、CRP 水平对比 治疗前,两组血清IL-10、TNF-α、CRP 水平对比无显著差异(P>0.05);治疗后,两组血清IL-10、TNF-α、CRP 水平均较之前有显著降低,且PHVHF 组各项水平低于CVVH 组(P<0.05)。见表2。
表2 两组IL-10、TNF-α、CRP 水平对比(±s)

表2 两组IL-10、TNF-α、CRP 水平对比(±s)
注:与同组治疗前比较,*P<0.05。
CRP(ng/L)治疗前 治疗后PHVHF 组CVVH 组组别 n IL-10(pg/ml)治疗前 治疗后TNF-α(pg/ml)治疗前 治疗后41 41 t P 108.52±17.43 112.26±21.35 0.869 0.388 58.39±6.78*72.14±9.37*7.612 0.000 42.75±7.21 41.08±6.64 1.091 0.279 22.58±4.01*31.23±4.46*9.235 0.000 93.28±8.23 94.11±8.18 0.458 0.648 65.29±8.13*71.99±8.09*3.740 0.000
2.3 两组WBC、ALT、AST 水平对比 治疗前,两组患者的WBC、ALT、AST 水平比较,差异无统计学意义(P>0.05);治疗后,两组患者的WBC、ALT、AST水平均较治疗前有明显下降,且PHVHF 组均明显低于CVVH 组,差异有统计学意义(P<0.05)。见表3。
表3 两组WBC、ALT、AST 水平对比(±s)

表3 两组WBC、ALT、AST 水平对比(±s)
注:与同组治疗前比较,*P<0.05。
AST(U/L)治疗前 治疗后PHVHF 组CVVH 组组别 n WBC(×109/L)治疗前 治疗后ALT(U/L)治疗前 治疗后41 41 t P 9.57±1.23 9.46±1.15 0.418 0.677 3.41±1.27*4.09±1.14*2.551 0.013 194.87±32.47 195.03±30.25 0.023 0.982 78.36±15.05*86.23±15.28*2.350 0.021 389.87±16.42 388.09±16.73 0.486 0.628 79.19±10.23*87.13±10.08*3.540 0.001
2.4 两组vWF、ET-1 水平对比 治疗前,两组血清vWF、ET-1 水平比较无显著差异(P>0.05);治疗后,两组血清vWF、ET-1 水平均降低,且PHVHF 组低于CVVH 组(P<0.05)。见表4。
表4 两组vWF、ET-1 水平对比(±s)
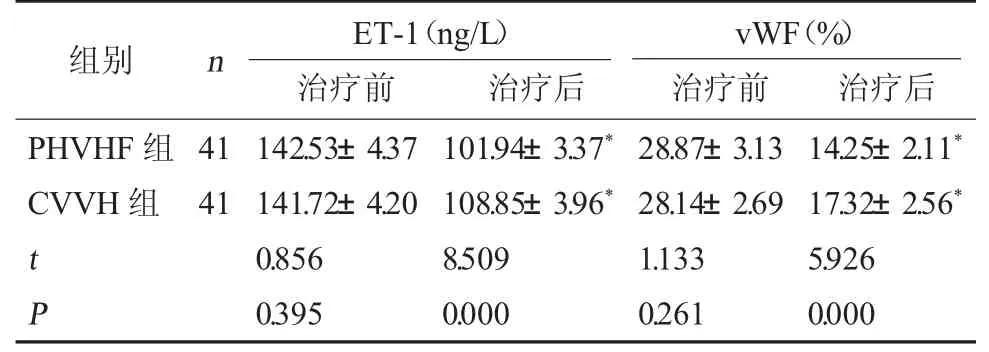
表4 两组vWF、ET-1 水平对比(±s)
注:与同组治疗前比较,*P<0.05。
vWF(%)治疗前 治疗后PHVHF 组CVVH 组组别 n ET-1(ng/L)治疗前 治疗后41 41 t P 142.53±4.37 141.72±4.20 0.856 0.395 101.94±3.37*108.85±3.96*8.509 0.000 28.87±3.13 28.14±2.69 1.133 0.261 14.25±2.11*17.32±2.56*5.926 0.000
3 讨论
脓毒症为重症医学科常见危重症,其中肺部感染是导致患病的主要原因,可占到患者总数的50%,其次为腹腔感染、泌尿道感染等,营养不良、酗酒、免疫力低下、长时间静脉置管等诸多因素均会一定程度增大脓毒症患病风险,应予以警惕[5]。脓毒症具有患病率高、死亡率高、并发症严重等特点,若未及时治疗,可发展为MOF,调查指出,其死亡率可达50%,严重威胁患者生命安全[6]。因此临床应及时采用科学治疗方案,以控制病情,降低病死率,改善预后。
血液滤过为脓毒症MOF 常用治疗手段,利用弥散、对流原理可有效清除机体炎症介质,降低并发症发生风险。相关研究指出,血液滤过清除能力和治疗方式、剂量有关,通常认为治疗剂量为45 ml/(kg·h)时其炎症清除能力、清除量有限[7]。相比之下,PHVHF 采用高容量置换液80~100 ml/(kg·h),其清除游离间隙、循环组织细胞因子及炎症介质剂量较大;同时治疗早期PHVHF 可快速起到清除作用,减轻脓毒症后期瀑布样效应,以降低并发症风险,提高生存率;另外接下来进行低容量血液滤过,血浆、组织中炎症介质水平达到再平衡,可为下一周期血液滤过储备浓度,并降低置换液用量,减少成本[8]。SOFA 评分、APACHE Ⅱ评分可用于评估脓毒症MOF 患者病情严重程度,当评分下降时表示患者的病情有所好转,在本研究中两组患者治疗前上述评分相近,治疗后PHVHF 组两项评分下降幅度远高于CVVH 组(P<0.05),表明PHVHF 组患者病情控制效果更好,可改善患者MOF 症状[9]。TNF-α 为脓毒症炎症递质复合网络中心环节,是造成炎症递质释放的主要促炎因子;而IL-10 由Th2 细胞分泌,可抑制巨噬细胞、单核细胞分泌的白细胞介素-8(IL-8)、白细胞介素-6(IL-6)等炎症介质表达、合成[10];CRP是由肝脏合成的一种急性时相蛋白,其本身可直接参与炎症反应,升高程度可以反映出炎症组织大小或活动性,CRP 可合成刺激因子IL-6,加剧对心、肺、肝等脏器损伤,同时还可以抑制T 淋巴细胞,降低机体免疫力。本研究结果显示,与CVVH 组比较,治疗后PHVHF 组SOFA、APACHEⅡ评分及血清TNF-α、IL-10、CRP 含量均较低(P<0.05),可见PHVHF 治疗脓毒症MOF 患者可显著减轻病情,降低促炎作用,纠正抗炎、促炎反应失衡状态。vWF、ET-1 为血管内皮损伤标志物,其中ET-1 分布于血管平滑肌细胞、内皮细胞,可抑制增殖因子、内皮细胞衍生松弛因子,具有升高血压、收缩血管、促进平滑肌细胞增殖作用;而vWF 为一种糖蛋白,由内皮细胞分泌,当内皮细胞损伤时,其可参与血栓形成、纤维蛋白原沉着、血小板聚集过程[11]。治疗后PHVHF 组血清vWF、ET-1 水平均低于CVVH 组(P<0.05),提示PHVHF 治疗脓毒症MOF 可减轻机体血管内皮损伤。脓毒症患者机体外周阻力下降,肝动脉血流相应减缓,过度炎症反应可促使机体产生大量氧自由基,加剧对肝功能的损伤,诱发MOF,增加临床治疗难度。AST、ALT 主要分布在肝细胞内,小部分处于肌肉细胞内,生理情况下血清转氨酶活性较低,当肝脏受损时,肝细胞膜通透性增强,AST、ALT 会随之进入到血液中,提示肝脏疾病的发生。WBC 是一种人类免疫细胞,其可以协助机体抵抗病毒的入侵,多用于诊断身体炎症反应,在机体发生炎症反应时,WBC 含量会迅速升高,吞噬机体中病原体,其含量可以反映出脓毒症患者的病情严重程度,当患者病情有所好转时,WBC 水平也会相应下降[12]。在本研究中,通过对比分析发现治疗后PHVHF 组WBC、ALT、AST 水 平 均 明 显 低 于CVVH 组(P<0.05),反映了PHVHF 治疗脓毒症MOF 的有效性,可以提高患者的预后效果。综上所述,脓毒症MOF 患者采用PHVHF 治疗可显著减轻病情,缓解炎症反应,调节血管内皮功能。

