结直肠癌组织中miRNA-371-5p表达意义的研究
韩 悦,王贲士
(1山东省立第三医院胃肠外科,济南 250031;2山东省肿瘤医院胃肠外科,济南 250106)
结直肠癌(Colorectal cancer,CRC)是常见的恶性肿瘤,其发病率位于所有恶性肿瘤的第3 位,死亡率位于第2位[1]。癌转移是导致CRC患者死亡的重要原因之一,近年来CRC 的防治取得了长足的进步,但是晚期和转移患者5年生存率仅为15%[2]。因此寻找预测肿瘤病情进展的标记物,探究影响预后的相关因素非常重要。微小RNA(miRNA)是单链非编码RNA,在基因转录水平和转录后水平进行负性调控[3]。既往研究已证实,miRNA 与CRC 的发生和发展密切相关[4-5]。研究发现,miRNA-371-5p属于基因间miRNA,miRNA-371-5p 可以抑制CRC LoVo 和SW620 细胞的增殖,对凋亡无明显影响[6]。本研究检测CRC 组织及细胞中miRNA-371-5p 的表达,分析miRNA-371-5p 与患者生存预后的关系,在体外研究中观察上调miRNA-371-5p 对CRC 细胞增殖、侵袭和迁移的影响,现报道如下。
1 资料与方法
1.1 一般资料以2011 年1 月-2013 年1 月山东省立第三医院胃肠外科收治的186 例CRC 患者为研究对象,回顾性分析患者的基本资料:男性112例,女性74例;年龄32~85岁,平均年龄(65.5±6.2)岁;肿瘤位于结肠88 例,直肠98 例;肿瘤直径≥5 cm 96 例,<5 cm 90 例;有淋巴结转移86 例,无转移100 例;高分化10例,中分化145 例,低分化31 例;肿瘤淋巴结转移分类(Tumor node metastasis classification,TNM)分期为Ⅰ期28 例,Ⅱ期58 例,Ⅲ期75 例,Ⅳ期25 例。本研究通过山东省立第三医院伦理委员会批准,所有患者签署知情同意书。
1.2 细胞和试剂结肠癌细胞HT29、SW480、SW620和HCT116,正常人肠上皮细胞HIEC-6 购于中科院上海细胞库。胎牛血清(上海浩洋生物科技有限公司),RPMI-1640 培养基(上海浩洋生物科技有限公司),LipofectAMINETM2000 转染试剂(上海浩洋生物科技有限公司),miRNA-371-5p 模拟物和对照质粒(深圳市默赛尔生物医学科技发展有限公司)。反转录试剂盒(上海吉玛公司),2×SYBR Green PCR Mas⁃termix 试剂盒(上海吉玛公司),BCA 蛋白定量试剂盒(上海吉玛公司),SDS-PAGE 凝胶快速制备试剂盒(上海吉玛公司),Transwell 小室(武汉普诺赛生命科技有限公司),Ki67 抗体(美国Sigma 公司),增殖细胞核抗原(PCNA)抗体(美国Sigma公司)。
1.3 CRC 组织中miRNA-371-5p 水平的测定取CRC 组织采用miRNA 提取试剂盒提取总RNA,用反转录试剂盒将总RNA 逆转录为cDNA,反应条件为37℃,60 min。将逆转录产物作为模板,利用定量PCR 试剂盒进行PCR 反应,反应条件为95℃15 min,94℃15 s,55℃30 s,72℃30 s,共45 个循环。最后采用PCR 仪检测,miRNA 相对表达量采用2-△△Ct方法,△Ct=CtmiRNA-CtsnRNA[7]。miRNA-371-5p 引物(上游:5'-tgagaactgaattccatgggtt-3';下游:5'-ATCTACTCTC TCCAGGTCCTCA-3')和内参基因U6 small nuclear RNA(snRNA)引物(上游:5'-ctcgcttcggcagcagcaca-3';下游:5'-aacgcttcacgaatttgcgt-3')。
1.4 miRNA-371-5p 模拟物的转染取SW620 细胞,用LipofectAMINETM2000 试剂盒进行转染,步骤如下:首先制备LipofectAMINETM2000 复合物和DNA 复合物(1 μg/μL 质粒和246 μL 无血清培养基),温室静置20 min。将复合物加入96 孔板,6 h 后更换含血清培养基,温室继续培养48 h。将细胞分为miRNA-NC组(转染对照质粒)和miRNA-371-5p 组(转染miR⁃NA-371-5p模拟物),转染24 h后备用。
1.5 SW620细胞增殖情况克隆形成实验:用胰蛋白酶消化转染后的SW620细胞,接种于96孔板中,37℃、5%CO2条件下培养3周。当出现菌落时停止培养。用4%多聚甲醛进行固定,30 min后用结晶紫染色,在低倍显微镜(×10)下计数大于10 个细胞的克隆数。CCK-8 法:用CCK-8 试剂盒检测细胞活性,细胞培养24、48、72和96 h时,向每个培养孔中添加10 μLCCK-8试剂,最后用酶标仪测定450 nm处的吸光度。
1.6 SW620 细胞侵袭和迁移情况迁移实验:在Transwell 迁移板上室加入5×104个SW620 细胞,下室中加入600 μL 完全培养基,在5%CO2、37℃条件下培养24 h。固定膜底细胞并进行0.1%结晶紫染色20 min,光学显微镜下对SW620 细胞数量进行定量。在侵袭实验中,使用预先加入Matrigel 胶的小室,上室中加入5×104个SW620 细胞,在5%CO2、37℃条件下培养48 h,其余步骤同迁移实验。
1.7 蛋白印迹法检测SW620 细胞增殖相关蛋白Ki67、PCNA 表达水平取用RAPI裂解液提取SW620细胞总蛋白,用BCA 试剂盒检测蛋白浓度,用10%SDS-PAGE 电泳分离蛋白,用半干转移法将蛋白转至PVDF 膜上。随后用5%脱脂奶粉封闭2 h,加入Ki67抗体(1∶1 000)、PCNA 抗体(1∶500),4℃过夜孵育,次日除去一抗,用TBST 缓冲液洗涤3 次后加入二抗,封闭1 h。ECL 发光仪进行蛋白成像,Image J 软件分析灰度值。
1.8 随访以门诊和电话相结合方法进行随访,随访截止时间为2018 年4 月。随访时间为54~93 个月。获得有效随访135 例,随访率为72.6%。生存时间定义为术后至因CRC 复发、转移或死亡的时间。分析生存预后与CRC 组织miRNA-371-5p 表达水平的关系。分析CRC患者5年生存率的影响因素。
1.9 统计学处理采用SPSS19.0 软件进行统计学分析,计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以例(%)表示,组间比较采用χ2检验;生存性分析采用Kaplan-Meier法和Log-Rank检验,采用COX回归模型分析影响患者预后的相关因素,以P<0.05为差异有统计学意义。
2 结果
2.1 CRC 组织和CRC 细胞中miRNA-371-5p 表达量的比较CRC 组织中miRNA-371-5p的相对表达量为(3.8±1.0),癌旁组织中为(8.5±2.8),两组比较差异有统计学意义(t=21.559,P<0.05)。正常人肠上皮细胞HIEC-6 和结肠癌细胞株HT29、SW480、SW620 和HCT116 中miRNA-371-5p 相对表达量分别为(4.35±1.01)、(3.04±0.31)、(1.23±0.13)、(2.56±0.49)、(2.10±0.36),差异有统计学意义(F=9.067,P<0.01),结肠癌各细胞株miRNA-371-5p 相对表达量均低于正常人肠上皮细胞株HIEC,其中SW620表达量最低。
2.2 miRNA-371-5p 表达量与CRC 患者临床病理特征的关系以miRNA-371-5p表达量的中位数为截点,将所有患者分为低表达量组和高表达量组。分化程度低、淋巴结转移和TNM 分期高的患者,miR⁃NA-371-5p表达量越低(P<0.05),见表1。
2.3 miRNA-371-5p 表达量与CRC 患者预后的关系有效随访的135 例CRC 患者5 年生存率为64.4%(87/135)。其中miRNA-371-5p高表达组5年生存率为83.8%(62/74),低表达组为41.0%(25/61),组间比较差异有统计学意义(χ2=6.032,P=0.014)。miRNA-371-5p 高表达组生存时间为(82.6±5.0)个月,低表达组为(59.5±4.2)个月,组间比较差异有统计学意义(χ2=15.011,P<0.01),见图1。
2.4 影响CRC 患者5 年生存率的相关因素单因素分析表明患者年龄(≥60 岁)、分化程度低、淋巴结转移和miRNA-371-5p 低表达是影响CRC 患者5 年生存率的因素(P<0.05)。多因素分析表明患者年龄、分化程度、淋巴结转移和miRNA-371-5p 表达量是影响患者生存率的独立危险因素(P<0.05),见表2、3。

表3 影响CRC患者5年生存率的多因素Logistic分析
2.5 转染miRNA-371-5p 模拟物对SW620 细胞增殖、侵袭和迁移的影响对SW620 细胞转染miRNA-371-5p 模拟物后,SW620 细胞的增殖活力明显受到抑制(P<0.05),见图2、3。侵袭和迁移力明显受到抑制(P<0.05),见图4、5。Ki67 和PCNA 蛋白表达水平明显降低(P<0.05),见图6、7。

图2 CCK-8法检测转染miRNA-371-5p模拟物对SW620细胞增殖活力的影响
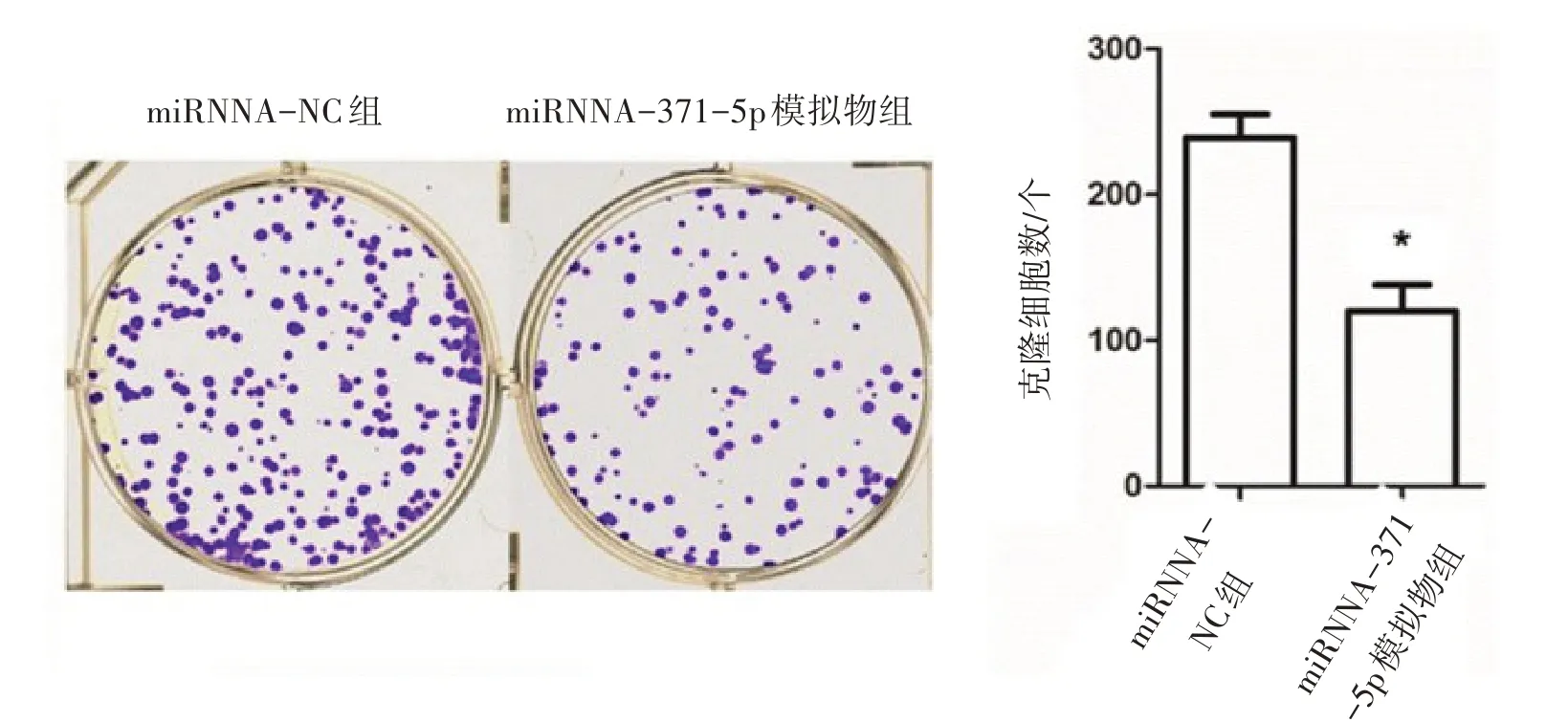
图3 克隆形成实验检测转染miRNA-371-5p模拟物对SW620细胞增殖活力的影响

图4 Transwell实验检测转染miRNA-371-5p模拟物对SW620细胞侵袭力的影响

图5 Transwell实验检测转染miRNA-371-5p模拟物对SW620细胞迁移的影响

图6 蛋白印迹法检测转染miRNA-371-5p模拟物对SW620细胞增殖蛋白Ki67、PCNA表达水平的影响
3 讨论
CRC 是我国常见的消化道肿瘤之一,其发病隐匿,大部分患者发现时已至中晚期,即使手术,5 年生存率也仅为25.0%左右[8]。因此,寻找CRC 特异性标志物显得非常重要。既往研究已证实,miRNA 在肿瘤细胞的增殖、分化、凋亡等过程中发挥重要作用[9]。miRNA 的异常表达与CRC 的发病和预后密切相关。miRNA-371-5p属于基因间miRNA,具有独立的启动子区域。miRNA-371-5p 在不同肿瘤中发挥的作用也不尽相同。Wang 等[10]发现前列腺癌细胞中miR⁃NA-371-5p 的表达量增加,可抑制瘤细胞的增殖、促进凋亡。Li 等[11]发现miRNA-371-5p 可靶向作用于SOX2 促进瘤细胞的增殖,导致胃癌的发生和进展。miRNA-371-5p 在CRC 中的作用及机制既往报道较少,本研究发现miRNA-371-5p 在CRC 组织和细胞中低表达,上调miRNA-371-5p 后CRC 细胞增殖。侵袭和迁移能力受到抑制,与既往报道类似[12],提示miRNA-371-5p在CRC中可能发挥抑癌作用。
本研究采用中位数将患者分为miRNA-371-5p高表达量组和低表达量组,结果发现,低表达量组分化程度较低、淋巴结易转移和TNM 分期越高。提示miRNA-371-5p 可能于CRC 的分化和远处转移等有关。本组研究中,135 例CRC 患者5 年生存率为64.4%(87/135),这与Miao 等研究一致[13]。影响CRC患者预后的因素有很多,而且非常复杂,但是公认的有年龄、分化程度、肿瘤分期、远处转移、免疫状态、复发等[14-17]。本研究采用Logistic 多因素模型进行分析,发现年龄(≥60 岁)、分化程度低、淋巴结转移是影响CRC 患者5 年生存的独立危险因素,这与张卫刚等[18]的研究结果一致。陈香浏等[19]检测了50 例结直肠癌患者血清中miRNA-21、miRNA-371-5p 和miR⁃NA-378 的表达水平,发现miRNA-371-5p 和miR⁃NA-21 与肿瘤复发和预后明显相关,本研究结果与之类似。本研究中,miRNA-371-5p 高表达组5 年生存率为83.8%(62/74),明显高于低表达组为(41.0%),这就提示miRNA-371-5p 可能作为预后CRC患者术后生存时间的标记物。
综上所述miRNA-371-5p 在CRC 组织中低表达,与生存预后有关。上调miRNA-371-5p 可抑制CRC 细胞增殖、侵袭和迁移。本研究也存在一些局限性,例如未检测外周血中miRNA-371-5p的表达水平,未检测miRNA-371-5p下游靶基因的表达。未来需要进一步进行机制研究,深入分析miRNA-371-5p在CRC中的作用机制。

