膜分离蚕豆蛋白酶解产物的理化性质及生物活性
邓永蓉,韩丽娟,2,杨希娟,2,党 斌,2,周 雯,张 雪,代云礼
(1.青海大学 农牧学院,西宁 810016; 2.青海省农林科学院 青海省青藏高原农产品加工重点实验室,西宁 810016)
蚕豆(ViciafabaL.)又名胡豆、佛豆、罗汉豆等,作为一种可食性资源食用历史悠久。我国地域辽阔,种植蚕豆品种多、范围广,主要分布于四川、云南、湖南、湖北、青海等省,是世界上蚕豆种植大国之一[1]。由于青海种植的蚕豆品质优、无虫害,深受市场欢迎[2]。
蚕豆的蛋白质含量为25%~30%,是制作低脂高蛋白食品的理想原料[3]。目前国内对蚕豆蛋白的研究主要集中在蛋白质的提取、蚕豆蛋白酶解多肽的制备及工艺优化方面[4-6],对于不同分子质量蚕豆蛋白酶解产物的分离及生物活性研究较少。蚕豆蛋白酶解产物具有易吸收[4]、降胆固醇[7]、抗氧化[8-9]、抗菌[10]、降血压[11]、抗糖尿病等作用,其分离纯化有多种方法,其中膜分离原理简单、操作方便,无化学污染[12],且可以将酶解产物分离成不同分子质量的组分,从而可以进一步研究各组分的理化性质及生物活性,对酶解产物研究开发有应用价值[13]。如:黄文凯[14]采用膜分离富集具有免疫活性的大豆肽;吴红洋等[15]使用超滤制备的花椒籽蛋白降血压肽ACE抑制率得到提高。
本课题组前期研究表明,蚕豆蛋白经不同蛋白酶处理后氨基酸的种类和含量有所增加,且酶解产物相对于蚕豆蛋白本身具有更高的体外抗氧化活性,在此基础上,本文利用不同蛋白酶酶解蚕豆蛋白,筛选出两种最优的酶进行复合酶解,再采用膜分离技术分级分离蚕豆蛋白酶解产物,进一步研究酶解产物的抗氧化活性及α-葡萄糖苷酶抑制活性,为蚕豆的精深加工奠定理论基础,对深层次开发蚕豆蛋白有一定的实际应用意义。
1 材料与方法
1.1 试验材料
1.1.1 原料与试剂
新鲜蚕豆,采集于青海大通;菠萝蛋白酶(300 U/mg)、木瓜蛋白酶(800 U/mg)、胃蛋白酶(10 000 U/g)、胰蛋白酶(250 U/mg),福州飞净生物科技有限公司;标准牛血清白蛋白,南京都莱生物科技有限公司;VC,南京奥多福尼生物科技有限公司;DPPH(1,1-二苯基-2-苦肼基自由基)、α-葡萄糖苷酶,北京索莱宝科技有限公司;ABTS(2,2-联氮基双(3-乙基苯并噻唑啉-6-磺酸)二铵盐,梯希爱化成工业发展有限公司;过硫酸钾、碳酸钠、氢氧化钠、浓盐酸、磷酸二氢钾、磷酸氢二钾、无水乙醇、三氯乙酸等均为分析纯,天津市河东区红岩试剂厂。
1.1.2 仪器与设备
HHS-4S电子恒温不锈钢水浴锅,上海仪器纱筛厂;JA1003电子天平,上海良平仪器仪表有限公司;DC-350高速多功能粉碎机,浙江武义鼎藏日用金属制品厂;pHS-3C实验室pH计,上海佑科仪器仪表有限公司;UV-2600紫外可见分光光度计,岛津企业管理有限公司;LR10M大容量冷冻离心机,湖南赫西仪器装备有限公司;GS55-9冷冻干燥机,基因有限公司;K9840自动凯氏定氮仪,山东海能科学仪器有限公司;FlowMem-0005-PN40高压平板膜小试设备,厦门福美科技有限公司。
1.2 试验方法
1.2.1 蚕豆蛋白的提取
参考文献[4,16]对蚕豆蛋白进行提取,具体提取工艺为:新鲜蚕豆→去皮→冷冻干燥→粉碎过筛→碱溶(0.5 mol/L NaOH调节pH至8.0,50℃浸提1 h)→离心(3 000 r/min,20 min)→酸沉(1 mol/L HCl调节pH至4.8)→离心(3 000 r/min,20 min)→沉淀冷冻干燥→蚕豆蛋白。
1.2.2 蚕豆蛋白酶解产物的制备
参考文献[4-5,17],称取4 g蚕豆蛋白配制成质量分数为10%的溶液,90℃预处理10 min,调节pH至适宜的酶解环境,分别加入0.08 g胃蛋白酶、胰蛋白酶、菠萝蛋白酶、木瓜蛋白酶或0.08 g胃蛋白酶+0.08 g胰蛋白酶、0.08 g菠萝蛋白酶+0.08 g木瓜蛋白酶进行酶解(各酶酶解条件见表1),酶解结束后取出于90℃灭酶10 min终止反应,冷却后测定反应体系的pH,并用0.2 mol/L NaOH标准溶液调节至酶解前体系的pH,并记录NaOH的消耗体积[18]。
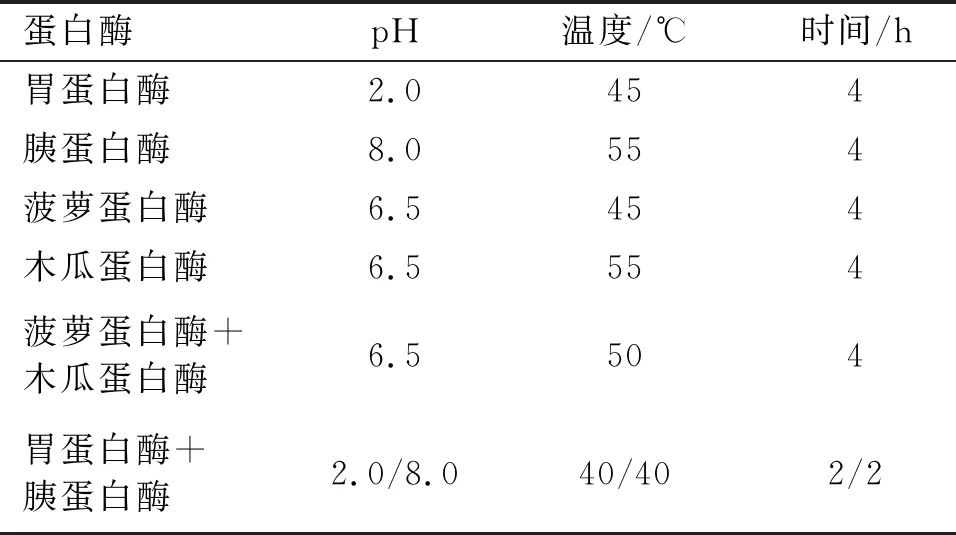
表1 蛋白酶酶解条件
将菠萝蛋白酶+木瓜蛋白酶酶解液于3 000 r/min离心20 min后倒出上清液。将上清液装入透析袋脱盐48 h,冷冻干燥后置于-80℃备用。
1.2.3 水解度及多肽得率的测定
1.2.3.1 水解度(DH)的测定
参考文献[5]采用pH-stat法测定蚕豆蛋白的水解度。计算公式如下:
(1)
式中:HD为水解度;B为NaOH的消耗体积,mL;Nb为NaOH浓度,mol/L;M为蛋白质的质量,g;htot为蛋白质中肽键总数,mmol/g,本试验取7.75;a为蚕豆蛋白氨基的平均解离度,本试验取0.89。
1.2.3.2 多肽得率的测定
参考文献[19-20],采用双缩脲法制作标准曲线,以吸光值(y)与牛血清白蛋白质量浓度(x)进行线性回归,得到回归方程y=0.059x+0.344 8,R2=0.999。根据曲线计算得出样品溶液中的多肽质量浓度,按下式计算多肽得率(Y)。
Y=cV/m×100%
(2)
式中:c为酶解液多肽质量浓度;V为酶解液体积;m为蚕豆蛋白质量。
1.2.4 蚕豆蛋白酶解产物的分离
参考文献[15]并作改动,取冷冻干燥后的双酶酶解产物,用超纯水配制成质量分数为5%的蚕豆蛋白酶解液,于4 000 r/min离心20 min后取上清液,严格按照膜分离设备的操作要求,将上清液分别经过1、3、5、10 kDa滤膜分离,得到5个不同分子质量的酶解产物组分,再经过RO膜处理得到不同分子质量酶解产物组分的浓缩液,分别为BBPHs-Ⅰ(<1 kDa)、BBPHs-Ⅱ(1~3 kDa)、BBPHs-Ⅲ(3~5 kDa)、BBPHs-Ⅳ(5~10 kDa)、BBPHs-Ⅴ(>10 kDa),冷冻干燥后于-80℃保存,计算膜分离后各组分在酶解产物中所占比例。
参照GB 5009.5—2016采用凯氏定氮法进行蛋白质含量测定。
1.2.6 氨基酸含量测定
按GB/T 5009.124—2003采用氨基酸自动分析仪测定未膜分离酶解产物与膜分离后的不同分子质量组分的氨基酸含量。
1.2.7 紫外光谱分析
准备0.2 mg/mL未膜分离与膜分离酶解产物溶液,使用紫外可见分光光度计在200~800 nm范围内扫描得到样品的紫外可见光谱。
1.2.8 红外光谱分析
取2 mg未膜分离与膜分离后的酶解产物,与0.2 g KBr粉末混合压片,在室温下使用红外分光光度计扫描记录样品的红外光谱,扫描范围为500~4 000 cm-1。
异化劳动虽然开启了人的本质力量,但它却使单个的人变得愚蠢片面,把自身和自然当作生活的手段,“一切肉体的和精神的感觉都被这一切感觉的单纯异化即拥有的感觉所代替。”[1]85也就是说只有我们在使用一个东西的时候,它才被我们拥有,那么人将从内心生出一种极度的匮乏感,只要他还没有得到过所有的东西。人的劳动的对象化创造着人最全面的本质,但同时物对人的控制也使人成为最彻底的奴隶。当这种对象化达到顶峰的时候,未来社会将具备代替它的全部材料,即“具有丰富的、全面而深刻的感觉的人”[1]88。异化劳动最终会被自身的发展所否定。
1.2.9 蚕豆蛋白酶解产物抗氧化活性测定
1.2.9.1 蚕豆蛋白酶解产物ABTS自由基清除能力测定
将7 mmol/L ABTS溶液与2.45 mmol/L过硫酸钾溶液等体积混合。吸取1 mL ABTS混合溶液,用无水乙醇稀释,使其在734 nm处的吸光值为0.7±0.1,以此为ABTS工作液。样品用蒸馏水稀释至质量浓度分别为10.0、5.0、2.5、1.25、0.625 mg/mL的溶液;分别与ABTS工作液混合后,置于室温反应6 min,以无水乙醇为空白调零,于734 nm处测定吸光值,以相同质量浓度的VC为阳性对照,按下式计算样品对ABTS自由基的清除率(Y1)。
Y1=(1-A′/A)×100%
(3)
式中:A为ABTS溶液吸光值;A′为ABTS溶液加入样品后的吸光值。
1.2.9.2 蚕豆蛋白酶解产物DPPH自由基清除能力测定
样品用无水乙醇稀释至质量浓度分别为10.0、5.0、2.5、1.25、0.625 mg/mL的溶液;将不同质量浓度样品与0.2 mmol/L DPPH试剂混合,室温下反应1 h,以无水乙醇为空白调零,于517 nm处测定其吸光值,以相同质量浓度的VC为阳性对照,按下式计算样品对DPPH自由基的清除率(Y2)。
Y2=(1-A′/A)×100%
(4)
式中:A为DPPH溶液的吸光值;A′为DPPH溶液加入样品后的吸光值。
1.2.10 蚕豆蛋白酶解产物对α-葡萄糖苷酶活性的抑制能力测定
将不同组分的酶解产物用蒸馏水配制成不同质量浓度(32、16、8、4、2 mg/mL),参考文献[21]并按表2各组反应物体积加样,测定空白组、阴性对照组、样品空白组、样品组在405 nm处的吸光值,以阿卡波糖为阳性对照,按公式(5)计算样品对α-葡萄糖苷酶的抑制率(Y3)。
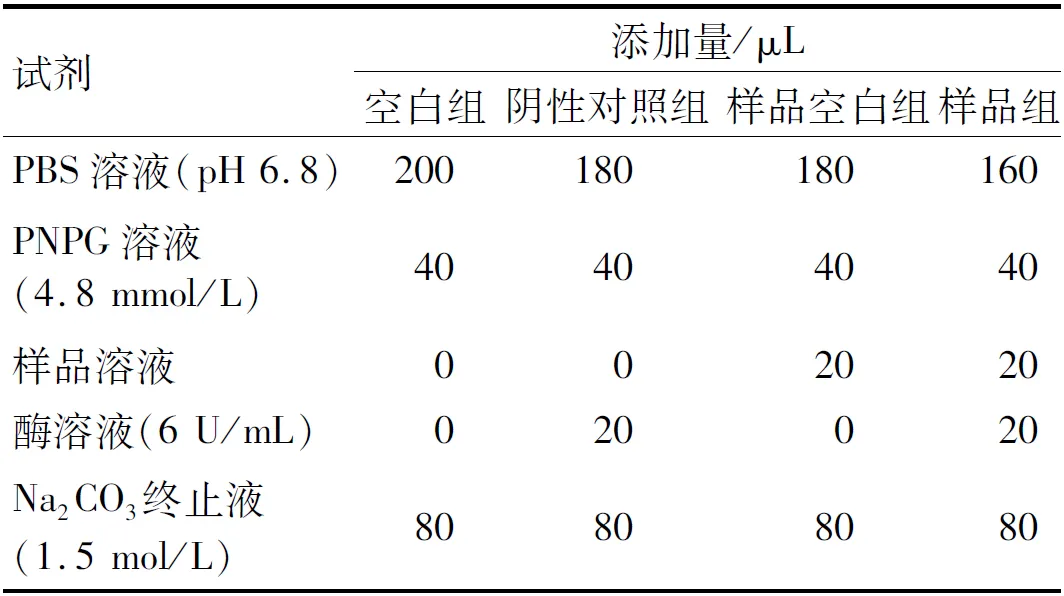
表2 α-葡萄糖苷酶的活性抑制试验反应体系
(5)
式中:A1为样品组吸光值;A2为样品空白组吸光值;A3为阴性对照组吸光值;A4为空白组吸光值。
1.2.11 数据处理
2 结果与讨论
2.1 蛋白酶水解能力的比较(见图1)
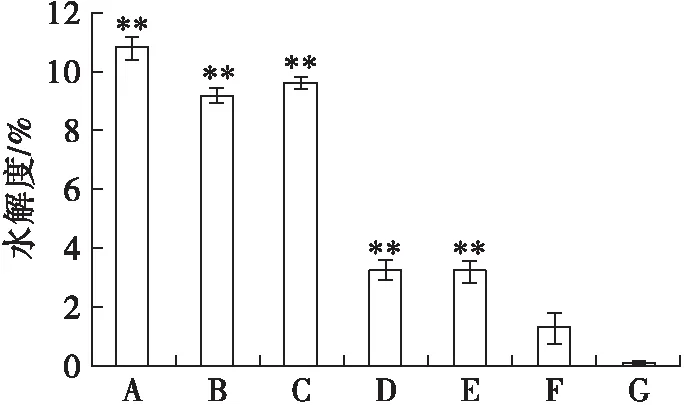
注:A.菠萝蛋白酶+木瓜蛋白酶;B.胃蛋白酶+胰蛋白酶;C.菠萝蛋白酶;D.胃蛋白酶;E.木瓜蛋白酶;F.胰蛋白酶;G.未处理组。与未处理比较,*p<0.05,**p<0.01
水解度(DH)是判断酶水解能力的重要指标。由图1可知,与未酶解比较,菠萝蛋白酶、胃蛋白酶、木瓜蛋白酶处理的蚕豆蛋白水解度及多肽得率都极显著上升(p<0.01)。其中,菠萝蛋白酶酶解产物的水解度高达(9.61±0.19)%,木瓜蛋白酶酶解产物的多肽得率高达(1.83±0.01)%。通过复合酶解试验得出,菠萝蛋白酶与木瓜蛋白酶复合酶解蚕豆蛋白的水解度最高,且所得酶解产物的多肽得率高达(2.18±0.01)%,与胃、胰蛋白酶复合酶解相比有极显著差异(p<0.01)。因此,综合考虑选用菠萝蛋白酶和木瓜蛋白酶作为双酶酶解最优水解酶。
2.2 膜分离后蚕豆蛋白酶解产物各组分所占比例
取5 g蚕豆蛋白酶解产物按1.2.4方法进行分离,得到的5个不同分子质量的组分所占比例见表3。
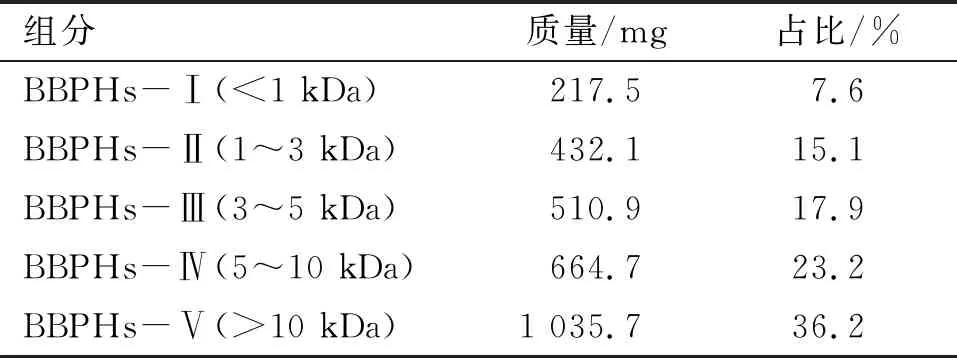
表3 膜分离后蚕豆蛋白酶解产物各组分所占比例
由表3可知,BBPHs-Ⅰ(<1 kDa)、BBPHs-Ⅱ(1~3 kDa)、BBPHs-Ⅲ(3~5 kDa)、BBPHs-Ⅳ(5~10 kDa)、BBPHs-Ⅴ(>10 kDa)组分所占比例分别为7.6%、15.1%、17.9%、23.2%、36.2%。
2.3 氨基酸含量
未膜分离与经膜分离所得不同分子质量蚕豆蛋白酶解产物组分的氨基酸含量见表4。

表4 未膜分离与膜分离后不同分子质量蚕豆蛋白酶解产物组分的氨基酸含量 %
由表4可看出,蚕豆蛋白酶解产物共检出17种氨基酸,其中7种必需氨基酸。经膜分离后10 kDa以下的蚕豆蛋白酶解产物的总氨基酸和必需氨基酸含量均增加。5种膜分离蚕豆蛋白酶解产物中,BBPHs-Ⅲ的总氨基酸、必需氨基酸、疏水氨基酸、芳香氨基酸含量均为最高,分别为65.304%、19.222%、20.762%、8.769%,明显高于未膜分离的酶解产物;6种蚕豆蛋白酶解产物中均含有Phe、Ile、Leu、Val、Pro等疏水氨基酸,说明蚕豆蛋白酶解产物有较好的抗氧化活性;而对于Tyr、Phe等芳香氨基酸,BBPHs-Ⅱ中含量较少,为3.246%,BBPHs-Ⅲ中含量最高,为8.769%,芳香氨基酸可通过电子供体作用将自由基转化为稳定的分子,因此推断BBPHs-Ⅲ有较高的生物活性。
2.4 紫外光谱分析
图2为膜分离前后蚕豆蛋白酶解产物的紫外光谱。紫外吸收光谱法可以根据最大吸收峰的位置及强度判断其共轭体系的类型。
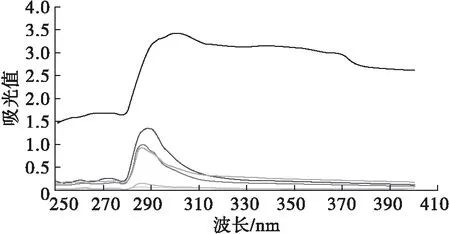
注:285 nm波长处紫外光谱由下到上依次为未膜分离、BBPHs-Ⅰ、BBPHs-Ⅱ、BBPHs-Ⅲ、BBPHs-Ⅳ、BBPHs-Ⅴ
由图2可看出,在200~800 nm波长范围内,6种蚕豆蛋白酶解产物的紫外光谱在285 nm处都有最高吸收峰,判断是π→π*跃迁所引起。而膜分离后酶解产物与未膜分离相比吸收强度有不同程度的升高,可能是膜分离后酶解产物的多肽链侧链发生变化导致紫外吸收强度发生了变化。
2.5 红外光谱分析
图3为膜分离前后蚕豆蛋白酶解产物的红外光谱。红外吸收峰与化合物的官能团有关,可用于分子结构特征分析[22]。酰胺Ⅰ带波数范围为1 600~1 700 cm-1,可以体现蛋白质的α-螺旋、β-折叠、β-转角和无规卷曲等二级结构。
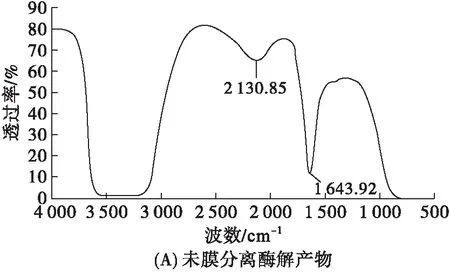
图3 膜分离前后蚕豆蛋白酶解产物的红外光谱

2.6 膜分离前后蚕豆蛋白酶解产物的抗氧化活性
2.6.1 对ABTS自由基的清除能力(见图4)
由图4可看出,6种蚕豆蛋白酶解产物具有一定的ABTS自由基清除能力。在0.625~5.0 mg/mL质量浓度范围内,5种膜分离组分中BBPHs-Ⅳ表现出较高的ABTS自由基清除能力,均大于未膜分离的;此外,BBPHs-Ⅱ和BBPHs-Ⅲ的ABTS自由基清除能力趋势相近。当质量浓度为10 mg/mL时,BBPHs-Ⅳ对ABTS自由基的清除率达到(27.89±0.01)%,与BBPHs-Ⅱ和BBPHs-Ⅲ相比差异极显著(p<0.01),相较于BBPHs-Ⅴ组分其ABTS自由基清除率高出6.35百分点(p<0.01)。说明5种膜分离组分中BBPHs-Ⅳ的ABTS自由基清除能力强且具有稳定性,但质量浓度为10 mg/mL时低于未膜分离组分的ABTS自由基清除率,可能与未膜分离酶解产物中氨基酸组成有关。
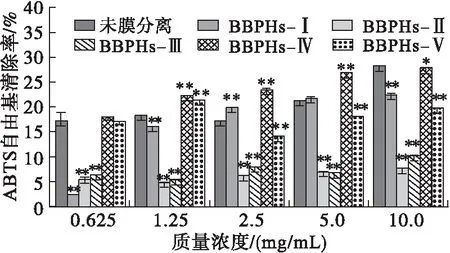
注:*p<0.05,**p<0.01,与未膜分离酶解产物比较。下同
2.6.2 对DPPH自由基的清除能力(见图5)

图5 蚕豆蛋白酶解产物的DPPH自由基清除活性
由图5可看出,与膜分离前比较,蚕豆蛋白酶解产物经过膜分离处理后DPPH自由基清除率有所降低(除BBPHs-Ⅱ),但各组分仍表现出良好的DPPH自由基清除能力。5种膜分离组分中,BBPHs-Ⅱ 组分表现较高的DPPH自由基清除能力,而BBPHs-Ⅴ的DPPH自由基清除率最低;当质量浓度为10 mg/mL时,BBPHs-Ⅱ组分DPPH自由基清除率为(57.70±0.00)%。研究表明,氨基酸的疏水性与酶解产物抗氧化活性密切相关,BBPHs-Ⅰ、BBPHs-Ⅱ、BBPHs-Ⅲ、BBPHs-Ⅳ中疏水氨基酸含量较高,因此分子质量小于10 kDa的膜分离蚕豆蛋白酶解产物具有较好DPPH自由基清除能力,说明小分子质量的酶解产物清除自由基能力的优势值得进一步研究。
2.7 膜分离前后蚕豆蛋白酶解产物对α-葡萄糖苷酶活性的抑制能力
未膜分离与膜分离后的蚕豆蛋白酶解产物对α-葡萄糖苷酶活性抑制结果如图6所示。

图6 蚕豆蛋白酶解产物对α-葡萄糖苷酶活性的抑制率
由图6可看出,蚕豆蛋白酶解产物对α-葡萄糖苷酶有一定的抑制作用,且5个膜分离组分在质量浓度4~16 mg/mL范围内的α-葡萄糖苷酶抑制率均显著高于未分离酶解产物。在2~32 mg/mL质量浓度范围内,蚕豆蛋白酶解产物的α-葡萄糖苷酶抑制率呈剂量依赖性。在2~4 mg/mL质量浓度下,BBPHs-Ⅱ的α-葡萄糖苷酶抑制率高于其他组分。当质量浓度为8~32 mg/mL时,BBPHs-Ⅲ的α-葡萄糖苷酶抑制率最高,且在32 mg/mL时可达(86.56±1.23)%,与阿卡波糖的抑制率(91.38±0.931)%相近,相比于未分离酶解产物增长了26.83百分点;32 mg/mL质量浓度下BBPHs-Ⅳ的抑制率略高于BBPHs-Ⅱ的,为(77.76±0.38)%。在质量浓度2、32 mg/mL时,BBPHs-Ⅰ组分的α-葡萄糖苷酶抑制率与未膜分离相比差异均不显著。在2 mg/mL时,BBPHs-Ⅴ的α-葡萄糖苷酶抑制率显著低于未膜分离蚕豆蛋白酶解物的。综上,5个膜分离组分中,BBPHs-Ⅱ、BBPHs-Ⅲ、BBPHs-Ⅳ组分具有较好的α-葡萄糖苷酶抑制效果,可能与此3个组分含有较多的Ala、Val、Met、Ile、Pro等疏水氨基酸有关,其机制还有待进一步研究。综上所述,1~10 kDa的膜分离蚕豆蛋白酶解产物可能是治疗糖尿病的良好药物制剂。
3 结 论
通过比较酶解蚕豆蛋白的水解度和多肽得率,选择菠萝蛋白酶和木瓜蛋白酶为复合酶对蚕豆蛋白进行酶解,通过膜分离得到不同分子质量的酶解产物组分并评价其生物活性。结果表明:膜分离后得到BBPHs-Ⅰ(<1 kDa,7.6%)、BBPHs-Ⅱ(1~3 kDa,15.1%)、BBPHs-Ⅲ(3~5 kDa,17.9%)、BBPHs-Ⅳ(5~10 kDa,23.2%)、BBPHs-Ⅴ(>10 kDa,36.2%)5个不同分子质量组分。通过氨基酸含量分析,膜分离后10 kDa以下的蚕豆蛋白酶解产物的总氨基酸相对于未膜分离酶解产物有所增加,且BBPHs-Ⅱ、BBPHs-Ⅲ、BBPHs-Ⅳ组分的疏水氨基酸含量较高。在质量浓度为10 mg/mL时,BBPHs-Ⅳ(5~10 kDa)有较高的ABTS自由基清除能力,清除率达到(27.89±0.01)%,BBPHs-Ⅱ(1~3 kDa)有较高的DPPH自由基清除能力,清除率达到(57.70±0.00)%;在2~32 mg/mL质量浓度下,1~10 kDa酶解产物的α-葡萄糖苷酶抑制效果良好。因此,利用酶法水解蚕豆蛋白可以提高其生物活性,小分子质量的蚕豆蛋白酶解产物有更显著的α-葡萄糖苷酶抑制作用,可能是预防有关氧化疾病的良好药物制剂或功能性食品添加剂,值得进一步深入研究。

