生物炭对土壤氮循环及其功能微生物的影响研究进展
王翰琨,吴永波,刘俊萍,薛建辉
〔1.南京林业大学a.南方现代林业协同创新中心,b.生物与环境学院,c.林学院,江苏 南京 210037;2.江苏省中国科学院植物研究所(南京中山植物园),江苏 南京 210014〕
生物炭是指一类在完全或部分无氧的情况下,通过热解炭化而产生的高度芳香化的难溶固体材料[1]。生物炭通常呈碱性[2],具有较多的大孔隙、较高的比表面积[3]、多样的表面官能团[4]以及大量的不稳定有机质和营养物质[5]。生物炭可以作为土壤改良剂施用到土壤中,从而改变土壤理化性质,包括阳离子交换量、酸碱度、土壤持水能力、容重、碳和养分含量等[6-7],受到了众多学者的关注[8-9]。
土壤氮循环是陆地生态系统元素循环的重要组成部分,其主要过程包括生物固氮、氨化作用、氨挥发、硝化作用、硝态氮淋溶和反硝化作用等[10],有些过程如生物固氮、硝化作用和反硝化作用等由特定的微生物功能基因所调控(图1)。近年来,学者们开展了大量有关土壤氮循环及其功能微生物对施用生物炭的响应研究。结果表明,生物炭通过改变土壤理化性质,为固氮菌、硝化菌和反硝化菌的生长和繁殖提供良好的微环境[11],最终影响土壤固氮作用[12]、硝化作用[13]和反硝化作用[14]。但由于不同研究采用的生物炭原料、裂解温度、试验条件以及土壤类型等不同,其研究结果存在差异,且对土壤氮循环及其功能微生物的主要影响因素尚无定论。为此,笔者通过综述近年来国内外有关施用生物炭对土壤氮循环及其功能微生物影响的研究文献,了解该领域相关研究的进展和发展趋势,为探讨生物炭的合理使用以及生物炭调控土壤氮循环的过程与机制提供参考依据。
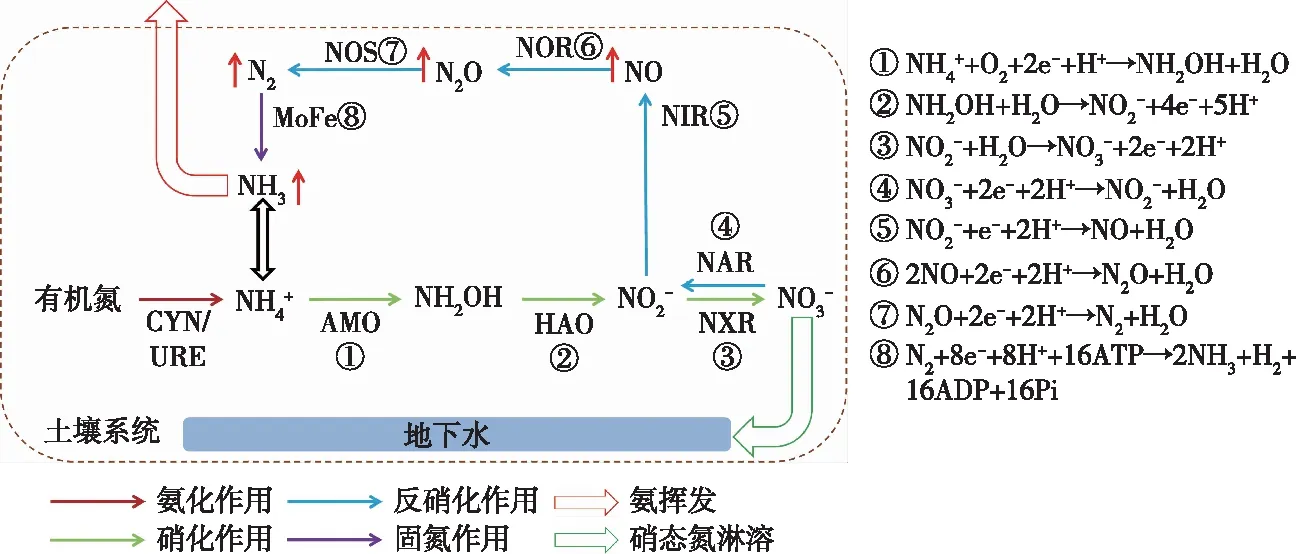
CYN/URE—氰酸酶/脲酶;AMO—氨单加氧酶;HAO—羟胺氧化还原酶;NXR—亚硝酸盐氧化酶;NAR—硝酸盐还原酶;NIR—亚硝酸盐还原酶;NOR—NO还原酶;NOS—N2O还原酶;MoFe—固氮酶。
1 生物炭对土壤生物固氮作用及其功能微生物的影响
生物固氮是通过微生物将大气中的氮气(N2)转化为氨(NH3)(图1),这些微生物也被称为固氮微生物。固氮微生物含有编码固氮酶的基因(包括nifH、nifK、nifD等),其中nifH基因最为保守,常被选为研究固氮微生物群落结构的标记基因[15]。固氮微生物主要分布在7个门共60多个属中[16],包括变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、蓝细菌门(Cyanobacteria)、绿菌门(Chlorobi)、绿弯菌门(Chloroflexi)、厚壁菌门(Firmicutes)、广古菌门(Euryarchaeota)。依据固氮微生物的生活和固氮方式可分为共生固氮菌[17]〔如根瘤菌属(Rhizobium)、弗兰克氏菌属(Frankia)等〕、自生固氮菌〔如固氮菌属(Azotobacter)、克雷伯氏菌属(Klebsiella)、念珠蓝细菌属(Nostoc)、红螺菌属(Rhodospirillum)等〕、联合固氮[18]〔如假单胞菌属(Psedomonas)、类芽孢杆菌属(Paenibacillus)等〕。
固氮微生物群落结构和固氮酶活性受到多种环境因素的影响,主要包括氧气、微量元素铁和钼、养分有效性等。其中,前两者是影响固氮微生物的核心因素,铁和钼是合成固氮酶的必需元素。固氮酶的蛋白质对氧气浓度极为敏感,其一旦暴露在空气中,极易发生不可逆转的失活[19],因此绝大多数固氮微生物是在厌氧或低氧的条件下进行固氮作用。
1.1 施用生物炭对土壤固氮作用的影响
生物炭添加到土壤后,通常会增强其生物固氮能力。施用生物炭对不同地区土壤生物固氮的影响见表1。AZEEM等[20]通过同位素示踪技术研究生物炭对土壤共生固氮的影响,结果表明,施用生物炭提高了根瘤的生物固氮速率,且土壤固氮能力随施用量的增加而增强。有研究认为,生物炭施用会增强豆科植物的固氮能力[21-22]。NISHIO等[23]发现,在苜蓿发育早期添加生物炭后,其固氮能力提高15%,结瘤发育最大时的生物固氮能力可提高227%。孟颖等[12]通过盆栽试验结合土壤培养法,发现增大2种生物炭的施用量(0~60 g·kg-1),土壤自生固氮能力均显著增强。此外,生物炭对土壤固氮作用的影响因制备原料的不同而存在差异。相较于水稻秸秆生物炭,玉米秸秆生物炭对土壤固氮能力的促进作用更强[12]。

表1 施用生物炭对不同地区土壤生物固氮的影响
1.2 施用生物炭对土壤固氮微生物的影响
生物炭可以改善土壤理化特性,提高共生固氮菌和自生固氮菌的数量[12,22,24]。越来越多的研究表明,生物炭的添加改变了土壤固氮微生物的数量和多样性。DUCEY等[25]通过室内培养试验发现,施用柳枝稷生物炭后,土壤nifH基因的拷贝数显著升高,且升高幅度随着施用量的增加而增大,在施用量w为10%时,基因丰度可增大3倍。与此同时,施用生物炭后,相比于对照土壤,土壤nifH基因的相对丰度也显著升高,表明施用生物炭增大了土壤中固氮微生物的多样性。ABUJABHAH等[26]研究表明,土壤固氮菌(包括根瘤菌属和固氮螺菌属等)相对丰度与桉树生物炭的施用量呈正相关。尽管多数研究表明,施用生物炭可提高土壤的nifH基因丰度,提高固氮微生物的总生物量,但这种影响依赖于生物炭的裂解温度、试验类型和覆盖植物等[28]。低温裂解(400 ℃)的生物炭更有利于土壤nifH基因丰度的增加,增幅可达88%;相较于野外试验条件,室内培养条件下土壤nifH基因丰度对生物炭的正响应更明显。Meta分析发现,试验条件显著影响土壤nifH基因丰度对生物炭的响应,室内培养试验中添加生物炭提高了nifH基因的丰度,盆栽试验中添加生物炭却降低了nifH基因的丰度,且由于盆栽试验栽种的植物可形成根瘤,土壤中存在许多共生固氮菌。可见,添加生物炭可能促进自生固氮菌的生长,但抑制共生固氮菌的生长,这种现象的内在机理还不清楚[28]。值得注意的是,XIAO等[28]的研究并未考虑到试验类型不同可能带来的差异,盆栽条件下土壤nifH基因丰度的降低是由于生物炭还是植物的作用,这点还不明确。因此在控制试验类型的条件下,进一步探究生物炭对土壤自生固氮和共生固氮的影响及其内在机制是必要的。
1.3 生物炭影响土壤固氮微生物的机制
1.3.1铁、钼等元素的有效性
铁、钼元素是固氮酶Mo-Fe蛋白的一种成分[29],其有效性的高低直接影响固氮酶活性以及生物固氮,因此铁、钼可能是生物炭影响土壤固氮作用的关键因素。RONDON等[22]研究验证了这一假设,结果表明,钼的有效性随着生物炭的添加而增加,但铁的有效性在生物炭添加前后未发生改变。此外,PEREZ等[30]研究认为,土壤中碳有效性的高低也是影响固氮微生物群落丰度和活性的重要因素。生物炭施用可为土壤固氮微生物提供可利用碳源,从而促进固氮微生物的生长。一些研究表明,土壤固氮菌群落丰度以及固氮酶活性与土壤碳含量存在显著正相关性[22,25-26],土壤SOC、DOC含量的升高是生物炭促进生物固氮的原因之一。
1.3.2氧含量
生物炭具有较高的比表面积和孔隙率,能够有效吸收和保留水分,进而提高土壤含水率[3],而含水率的增大有利于形成厌氧环境,提高固氮酶活性,进而增强土壤的生物固氮能力[20]。此外,生物炭施用后土壤容重降低,土壤中增加的孔隙空间有利于根瘤的形成。
2 生物炭对土壤氨挥发的影响
通过固氮、氨化、水解等过程产生的铵态氮(NH4+)除了被植物吸收外,一部分通过硝化作用转化为NO3-,一部分以氨的形式挥发到大气中(图1),只有少部分保留在土壤中。可见,氨挥发是土壤气态氮损失的重要途径之一,氨挥发不仅降低了氮利用率,还会对水、大气和土壤环境造成严重污染[31-32]。铵态氮在土壤生物系统内的转化是一个包括多种反应的复杂动力学过程[33],其中与氨挥发直接相关的化学平衡包括:NH4+(代换性)⟺ NH4+(液相)⟺ NH3(液相)⟺ NH3(气相)⟺ NH3(大气)。对土壤而言,土壤溶液是液相,土壤表层空气是气相,氨挥发发生在土壤表面。
土壤氨挥发的主要环境因素是土壤pH值和黏粒含量,土壤pH值升高对氨挥发有促进作用[34]。这是因为pH值决定了氨挥发的化学平衡,pH值升高(碱性环境下)有利于铵态氮向氨的转化。与土壤pH值相反,土壤黏粒对氨挥发有抑制作用。FAN等[35]研究表明,黏粒含量较高的土壤氨挥发显著小于黏粒含量较低的土壤,一是由于黏粒对NH4+具有较强的吸附作用,可抑制其向NH3的转化;二是由于较高含量的黏粒能显著降低土壤的通透性,不利于氨气扩散到大气中。
2.1 施用生物炭对土壤氨挥发的影响
许多研究显示,生物炭对土壤氨挥发具有抑制作用(表2)。
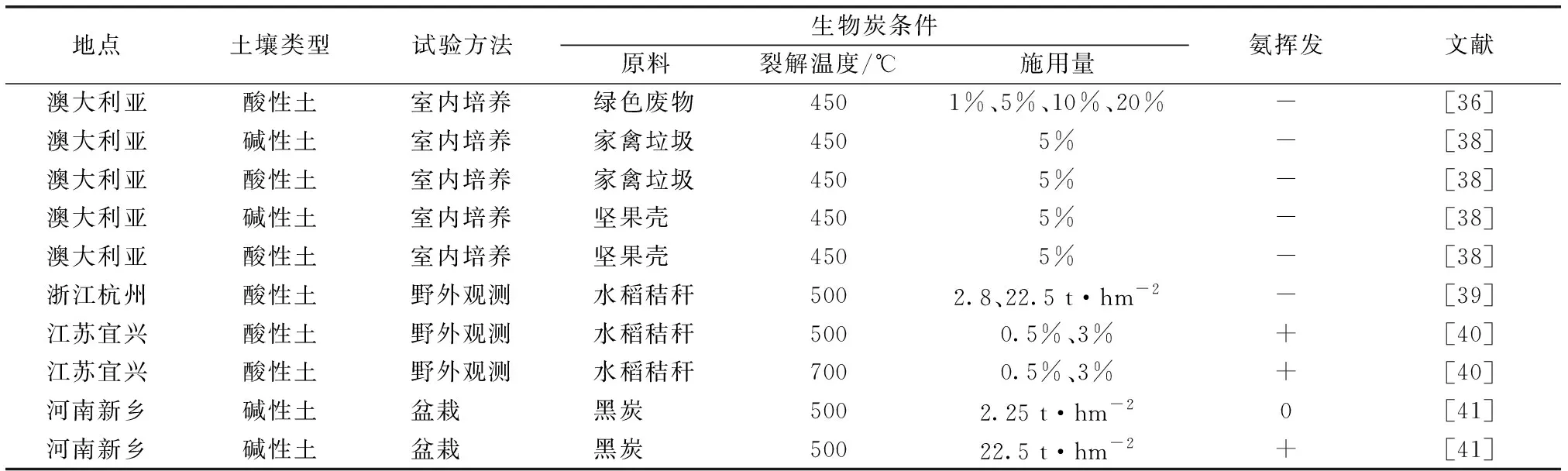
表2 施用生物炭对不同地区土壤氨挥发的影响
CHEN等[36]通过室内培养试验发现,生物炭的添加显著减少了土壤氨挥发,且随着施用量的提高(0~20%),土壤氨气的减排量增加。许云翔[37]通过观测稻秆生物炭对太湖流域稻麦轮作农田土壤氨挥发的影响,发现稻秆生物炭可显著降低土壤氨挥发累积量,但随着施用量的增大(0~22.5%),土壤氨挥发累积量呈先下降后上升的趋势,而最大施用量下的氨挥发累积量仍显著小于对照。因此,中量生物炭的添加既可缓解土壤氨挥发,又可节约经济成本。此外,不同原料制备的生物炭对土壤氨挥发的影响存在差异。MANDAL等[38]研究显示,2种生物炭(垃圾和坚果壳)均显著减缓2种土壤类型(酸性土和碱性土)的氨挥发,且前者对土壤氨挥发的减缓效果更明显。钟婷[39]也认为,秸秆生物炭能显著控制稻田土壤的氨挥发,可减缓20%以上的稻田土壤氨累积挥发。也有一些研究报道了生物炭对土壤氨挥发的促进作用[40-42]。SHA等[43]认为,在不同的土壤、生物炭和试验条件下,生物炭对土壤氨挥发的影响存在很大差异。一般而言,生物炭的施用能减缓土壤氨挥发,但生物炭添加到酸性土壤中可能会刺激土壤的氨挥发[42]。
2.2 生物炭影响土壤氨挥发的机制
2.2.1生物炭的吸附
生物炭因其孔隙结构发达、比表面积巨大等特性,往往具有较强的吸附能力。HALE等[44]研究显示,可可豆壳生物炭和玉米芯生物炭均对氨气和铵态氮有较强的吸附能力。刘玮晶等[45]通过室内模拟试验发现,生物炭添加后,能显著提高土壤对铵态氮和硝态氮的吸附量,表明生物炭在提高土壤对无机态氮的吸附能力方面具有显著的效果。生物炭对土壤铵态氮的吸附可抑制其向氨气的转化,同时生物炭吸附氨气可削弱其扩散到大气中。
2.2.2土壤pH值
pH值是影响土壤氨挥发的重要因素之一。多数生物炭由于自身pH值较高,施用到土壤后会在一定程度上提高土壤pH值,进而打破土壤环境的化学平衡,从而促进土壤氨挥发,特别是酸性土壤[40]。CHEN等[36]认为,生物炭通过pH值影响土壤氨挥发依赖于土壤本底酸碱度的高低,具体表现为:当土壤为酸性时,施用生物炭往往能显著提高土壤pH值(“石灰效应”),从而促进土壤氨挥发;当土壤为中性或微碱性时,施用生物炭降低土壤氨挥发;当土壤为碱性时,施用生物炭不会显著影响土壤氨挥发,此时土壤的铵态氮多数已经通过氨挥发流失到大气中。因此,适量施用木炭等孔隙较大或pH值较低的生物炭,更有利于减缓土壤的氨挥发[43]。
3 生物炭对土壤硝化作用及其功能微生物的影响
硝化作用的过程一般分为2步,均在有氧条件下完成,首先是将铵态氮氧化为亚硝态氮,然后将亚硝态氮氧化为硝态氮(图1),这两步也被称为氨氧化和亚硝酸盐氧化。氨氧化过程主要是由氨氧化细菌(AOB)和氨氧化古菌(AOA)完成,其含有调控氨单加氧酶(AMO)合成的amoA基因。根据16S rRNA测序结果,AOB主要属于β变形菌纲的亚硝基单胞菌科(Nitrosomonadaceae)和γ变形菌纲的着色菌科(Chromatiaceae),包括亚硝化螺菌属(Nitrosospira)、亚硝化单胞菌属(Nitrosomonas)、亚硝化球菌属(Nitrosococcus)等[46]。而目前发现的AOA均属于奇古菌门,但AOA还存在许多未知菌种,对于AOA的认知还处于起步阶段。亚硝酸盐氧化过程主要由亚硝酸盐氧化细菌(NOB)完成。NOB主要分布在4个属[47],包括硝化球菌属(Nitrococcus)、硝化螺菌属(Nitrospira)、硝化杆菌属(nitrobacter)、硝化刺菌属(Nitrospina)。
氧含量和pH值是影响硝化微生物群落组成的关键环境因素。土壤pH值能显著影响土壤硝化作用,是影响氨氧化微生物群落结构的最重要因素之一[48]。氧气是氨氧化反应的基质,由于AOA对氧气的半饱和常数比AOB低[49],因此氧气浓度的高低会对氨氧化微生物的生态位分异造成影响。
3.1 施用生物炭对土壤硝化作用的影响
目前生物炭对土壤硝化作用的影响主要是根据土壤硝化速率确定,一些研究也根据土壤中硝酸盐的变化量来评估[50]。从表3可知,野外条件和室内培养条件下的试验结果均表明,生物炭施用对各地区的土壤硝化作用主要起促进作用。PROMMER等[13]在欧洲温带地区可耕土壤进行野外观测试验发现,施用生物炭后土壤硝化速率加快了3倍多,表明生物炭的施用促进了土壤硝化作用。同样地,SONG等[51]在黄河三角洲的盆栽试验发现,生物炭的施用促进了该地区的土壤硝化速率。生物炭的理化性质因制备工艺(裂解温度和原料)存在差异,故施用后对土壤硝化作用的影响也可能不尽相同。PEREIRA等[52]在美国地中海地区的研究结果表明,杉木在较高温条件下制备的生物炭更能促进土壤硝化作用。由于低温制备的生物炭易含有多环芳烃等毒性化合物,可能会抑制生物炭改良土壤中的硝化作用[53-54]。不同原料所制备的生物炭的理化性质不同,施用后对土壤硝化速率的影响可能会截然相反[13,55]。生物炭的施用量也是学者关注的问题之一[51]。一般而言,土壤硝化速率随着施用量的增多,呈先增大后减小的变化趋势,因此生物炭的施用量不宜过多。此外,生物炭对土壤硝化作用的影响还强烈依赖于土壤类型。根据“石灰效应”理论,生物炭对酸性土壤硝化作用的影响更为强烈[56-57]。
3.2 施用生物炭对土壤硝化微生物的影响
PROMMER等[13]研究表明,土壤氨氧化微生物群落丰度随着生物炭的施用而增加,生物炭处理的土壤AOA和AOB含量均显著高于对照。CHEN等[63]通过室内培养试验也发现了一致的结果,即小麦秸秆生物炭的施用可显著提高土壤AOA和AOB的基因拷贝数。此外,LUO等[58]研究发现,施用生物炭显著增加了亚硝态氮氧化菌(NOB)的丰度,改变了NOB的群落组成,但不影响NOB的α多样性。可见,生物炭对土壤硝化菌具有积极影响。SONG等[51]通过研究不同施用量的生物炭对土壤硝化菌群落的影响,发现高施用量处理下的土壤AOA和AOB基因丰度反而小于低施用量处理,且基因丰度与硝化速率的变化趋势相似。LIU等[59]研究表明,随着生物炭施用量的增加(0~4%),土壤中AOB和NOB的相对丰度降低,且amoA基因的拷贝数减小;但随着施用量的增加(施用量为8%时),amoA基因的拷贝数又有所增大。而ABUJABHAH等[26]却认为,生物炭施用量的增加使黑黏土(black clay loam)中硝化菌丰度提高,尤其是NOB的丰度。因此,生物炭的施用量对土壤硝化菌有显著影响,确定合适的施用量对改善土壤硝化作用有着重要意义。不同原料制备的生物炭对土壤硝化微生物的影响存在差异。与小麦秸秆生物炭相反,花生壳生物炭的施用降低了土壤AOB的基因丰度[50,63],这可能是由于花生壳生物炭中含有一些毒性化合物,抑制了硝化细菌数量的增长。另一项研究也显示,不同生物炭对土壤AOB的基因丰度有着不同程度的抑制作用[52]。但一些研究却发现,由于生物炭对抑制性化合物的吸附以及木炭的“石灰效应”, 向森林土壤中添加野火木炭有利于AOB丰度的增加[57]。LUO等[58]研究也显示,在生物炭+石灰石处理的样品中,硝化螺旋菌Nitrospira(nxrB,NOB)的丰度增加,这与潜在的亚硝酸盐氧化活性(PNO)、pH值和速效钾含量显著相关。此外,一些研究也认为,解释生物炭促进土壤硝化微生物生长的主要理论之一是“石灰效应”[57,64]。
生物炭处理的土壤中硝化微生物含量升高,但不同群体(AOA、AOB以及NOB)对硝化过程的相对重要性和贡献是不同的。XU等[60]的盆栽试验表明,稻草生物炭的施用提高了氨氧化微生物的活性,且古生菌可能比细菌对生物炭增强硝化作用的贡献更大,因为生物炭显著增加了古生菌amoA丰度的表达,而不是细菌amoA。但DUCEY等[25]通过6个月的培养试验,观察到生物炭存在时土壤细菌amoA丰度更高。ZHANG等[65]也认为,AOB对硝化作用的贡献可能更大。SONG等[51]认为,尽管在生物炭处理的土壤中AOB比AOA更丰富,但后者与硝化速率有更强的相关性,AOA是土壤硝化过程的重要参与者。一项近来的研究结果显示,生物炭的短期施用增强了AOB中amoA的基因拷贝,AOB在新鲜生物炭影响土壤硝化作用的过程中发挥了关键作用,解释了生物炭处理下硝化作用变化的6.1%;但在长期生物炭施用下,古生菌在土壤中的氨氧化原核生物中占主导地位,对土壤硝化作用更为重要[61]。到目前为止,AOA和AOB作为硝化作用第1步的调控者被广泛研究,驱动土壤硝化第2步的NOB的作用却被忽视,亚硝酸盐氧化为硝酸盐是生物地球化学氮循环的一个重要过程[47]。一项研究表明,不同硝化菌(AOA、AOB、NOB)对茅台酒糟生物炭的响应存在差异,茅台酒糟生物炭显著降低了土壤AOA和NOB的相对丰度,但显著提高了AOB的相对丰度;NOB是影响土壤氮含量的主要因素,而不是AOA和AOB,茅台酒糟生物炭通过降低亚硝酸盐氧化作用来改变氨氧化作用,从而影响黄土氮养分的有效性,施用量4%处理提高了氮肥保留率,降低了黄土氮浸出损失的风险[62]。
3.3 生物炭影响土壤硝化微生物的机制
3.3.1土壤pH值
土壤pH值是影响硝化微生物的关键因素之一,与土壤硝化作用的变化密切相关。鲍俊丹等[66]通过室内培养试验发现,土壤最大硝化速率与土壤pH值呈显著正相关关系,且酸性土壤不利于硝化菌的生长,其最佳pH值为6.6~8.0。生物炭自身为碱性,施加到土壤中将显著提高土壤pH值,有利于土壤硝化菌的生长。XU等[60]研究表明,施用生物炭引起的土壤pH值变化是土壤微生物群落变化的主要解释因子,占总变化的56.5%。土壤硝化微生物(如AOB和NOB)与土壤pH值之间存在显著相关性[58,67]。施用生物炭对土壤硝化菌丰度的影响受限于土壤类型,在酸性土壤中,施用生物炭对硝化菌丰度的促进效果更为显著[28,68]。此外,土壤pH值是AOA和AOB发生生态位分化的重要原因。许多研究报道了生物炭施用后,土壤AOB的基因丰度大于AOA[25,51,65]。这是由于AOA在酸性环境中更为活跃,而碱性或中性环境更有利于AOB的生长[69-70]。以上研究表明,土壤pH值是生物炭施用背景下影响土壤硝化作用的重要驱动因素。
3.3.2氧含量
经生物炭处理的土壤硝化速率的增加可能归因于土壤氧气状态的改变,包括氧气含量和土壤水分的相关变化,因为硝化作用依赖于土壤氧气的可利用性。土壤中空气和水的平衡对硝化作用至关重要,硝化作用在60%的饱和孔隙度处达到峰值[71],而生物炭的施加显著改变了土壤的水分状况[72]。PROMMER等[13]研究证明,生物炭存在大量可定植的孔隙,在这些孔隙中,AOA和AOB有足够的氧气和可用铵。目前,生物炭施用背景下,土壤含氧量与土壤硝化作用及其功能微生物的关系还鲜见报道,有待进一步开展相关研究。
4 生物炭对土壤反硝化作用及其功能微生物的影响
反硝化作用被认为是土壤中NO3-在厌氧条件下,通过一系列反硝化微生物的作用,渐次还原成NO2-、NO、N2O、N2的生物学过程[16](图1),这4步过程需要的还原酶依次为:(1)nar基因编码的硝酸盐还原酶;(2)nir基因编码的亚硝酸盐还原酶;(3)nor基因编码的一氧化氮还原酶;(4)nos基因编码的氧化亚氮还原酶。反硝化微生物广泛分布于细菌、真菌和古生菌中,包括假单胞菌科(Pseudomonaceae)、芽孢杆菌科(Bacillaceae)、盐杆菌科(Halobacteriaceae)、根瘤菌科(Rhizobiaceae)、红螺菌科(Rhodospirillaceae)、噬纤维菌科(Cytophagaceae)等。
反硝化作用受土壤含氧量、pH值、碳有效性等多种环境因子的影响。反硝化作用是一个厌氧过程,氧气的存在能够抑制硝酸盐还原酶和亚硝酸盐还原酶的合成,进而不利于整个反硝化作用的进行。此外,土壤含氧量不同也会导致反硝化气体产物组成的差异,低含氧量的环境有利于氧化亚氮向氮气的还原[73]。土壤pH值是影响反硝化作用的重要因素之一,酸性环境下反硝化速率慢。大多数反硝化作用是通过异养微生物进行的,因此高度依赖于碳源。且碳源分解的同时产生CO2,有利于低氧环境的形成[74]。
4.1 施用生物炭对土壤反硝化作用的影响
越来越多的研究表明,施用生物炭可缓解土壤N2O的排放(表4)。ZHANG等[75]研究认为,对我国中部平原石灰性土壤施用小麦秸秆生物炭后,N2O 排放量减少10.7%~41.8%,且随着施用量(0~40 t·hm-2)的增加,排放量降幅增大。FUNGO等[76]将桉木生物炭与土壤混合并培养20 d后发现,施用2%生物炭可使土壤N2O排放量减少52%~78%,将生物炭施用量从2%提高到4%,土壤N2O累积排放量进一步减少,但无显著差异。SONG等[77]通过24个月的田间试验研究施用生物炭对亚热带人工林土壤N2O排放的影响,结果表明,施用竹叶生物炭显著降低土壤N2O排放量,且降低速率与生物炭施用量呈正相关。KHAN等[78]和BEAULIEU等[79]研究也表明,生物炭施用量的提高有利于其缓解土壤N2O的排放。BRASSARD等[80]对76种生物炭的特性进行汇编和比较后发现,氮含量较低、C/N比高的生物炭更适合用于缓解土壤N2O的排放。CAYUELA等[81]也报道了相似的结果:生物炭的C/N比<10时,促进土壤N2O的排放;C/N比为10~30时,N2O 的排放会发生显著改变;C/N比>30时,N2O排放减少。但总体而言,施用生物炭减少了土壤中54%的N2O排放。并且,生物炭对N2O排放的影响也会由于生物炭原料、热解条件不同产生显著差异。如施用木炭、有机垃圾生物炭会减少N2O的排放,而施用污泥炭则会促进N2O的排放;裂解温度越高,N2O排放量降幅越大[81]。AMELOOT等[82]也报道了相似的结果,控制环境、施用量和土壤相同条件下,施用350 ℃制备的猪粪和柳木生物炭使N2O排放分别减少19%和36%,而700 ℃制备的猪粪和柳木生物炭使N2O排放分别减少60%和67%。另一项研究结果却显示,尽管施用生物炭减少了30.92%的土壤N2O排放,但这种影响受到生物炭原料、施用量和土壤特性(质地、pH值)的干扰[83]。
相比于单独施用生物炭,生物炭与肥料的联合施用对土壤反硝化作用的影响截然不同。WEI等[85]对生物炭与施肥(氮肥)共同影响土壤氮损失的研究表明,当施氮肥量小于 60 kg·hm-2时,生物炭的施用使农田土壤N2O排放量降低8.23%;当施氮肥量大于 60 kg·hm-2时,施用生物炭使土壤N2O排放量增加18%~26%。CHEN等[86]研究表明,施肥(尿素)土壤中加入稻壳生物炭,将导致N2O排放量高于单独施肥土壤,增加49%。这可能是由于生物炭中的活性碳促进了土壤碳对微生物氮的矿化,从而导致N2O排放增加。LIN等[87]通过室内培养试验研究了生物炭与尿素对土壤N2O排放的影响,结果表明,培养45 d后,4%生物炭与尿素处理下的土壤N2O累计排放量为17.89 mg·kg-1,是单独施肥处理的3.56倍。
4.2 施用生物炭对土壤反硝化微生物的影响
反硝化作用是氧化亚氮排放的重要途径,受微生物功能基因的调控[16]。NO3-还原为NO2-主要由narG和napA基因调控。一项研究表明,生物炭的施用使土壤narG基因丰度平均提高13.7%[28]。HE等[61]研究也表明,施用生物炭显著提高了narG基因的拷贝数。但缺乏施用生物炭如何影响napA基因表达的相关研究。nirK和nirS是调控NO2-还原为NO的关键基因,且被视为测量土壤反硝化作用的标记基因[88]。研究表明,生物炭的施用显著增加了nirS、nirK、nosZ基因的拷贝数[61]以及基因的丰度[11,28]。SHI等[84]研究显示,施用生物炭显著降低了nirS和nirK基因的拷贝数,却显著增加了nosZ基因的拷贝数。这可能是不同试验中采用的覆盖植物类型、生物炭性质等存在差异所致[27,59-60]。
尽管施用生物炭后土壤N2O排放受到抑制,但nirS、nirK以及nosZ等基因的总和不能用于指示N2O 的排放,因为每个基因参与反硝化作用的步骤不同,对反硝化作用的贡献也存在差异。一些研究发现,nirK与nirS丰度比值与N2O排放量之间存在显著正相关关系,且含有nirK和nirS基因的反硝化菌缺乏减少N2O浓度的遗传能力[89],因此它们被认为是反硝化过程中N2O排放的主要贡献者[84]。尽管多数研究结果显示,生物炭促进了土壤反硝化微生物功能基因的拷贝,但生物炭的施用最终减缓了土壤N2O的排放,生物炭的施用减小了nirS+nirK/nosZ比值[67,88],表明nosZ丰度的增长与土壤N2O排放减少更为相关。此外,XIAO等[28]的研究结果显示,nosZ基因丰度与N2O排放量之间存在负相关关系。XU等[60]通过盆栽试验发现,生物炭增加了nosZ基因的拷贝数,而对nirK和nirS的基因丰度没有显著影响,表明生物炭增强的nosZ基因转录可能是土壤N2O排放减少的主要原因。VAN ZWIETEN等[90]也认为,土壤N2O排放减少主要是由于nosZ基因丰度对生物炭的响应所致。生物炭通过促进N2O还原微生物的活性增强和生长,进而影响N2O的最终排放,这个观点被越来越多的学者认同[14,63,91-92]。
4.3 生物炭影响土壤反硝化微生物的机制
4.3.1土壤氧含量
土壤反硝化作用是在厌氧或者低氧的条件下进行的[93],因此土壤氧气含量是控制反硝化速率的重要因素[94]。HARTER等[14,91]认为,由于生物炭含有较高的孔隙率,施加到土壤后能有效改善土壤的透气性,可降低参与反硝化过程的微生物活性,进而抑制土壤反硝化作用。YANAI等[95]也报道了相似的结果,在土壤含水量达78%的黏土中添加10%的生物炭,可使N2O排放量减少89%。研究人员认为,这种减少是由于生物炭表面可能吸收了水分,从而改善了土壤透气性,抑制了N2O的排放。LÉVESQUE等[96]通过338 d的培养试验,研究了施用5%木炭对黏土温室气体排放的影响,结果表明,生物炭的施用显著降低了土壤N2O的排放。相比于高孔隙的生物炭,低孔隙的生物炭施用后,土壤N2O的排放量更多。此外,生物炭可形成对氧气高度敏感的N2O还原酶所需的局部厌氧微场所[97],有利于N2O向N2的转化。
4.3.2土壤pH值
除土壤氧含量外,土壤pH值也是影响土壤反硝化作用的重要因素。IMEK等[98]认为,当土壤pH值高于7时,更有利于土壤反硝化作用的最后一步,此时N2作为反硝化作用的产物,比N2O更重要。多数研究结果表明,由于生物炭的“石灰效应”,其对土壤pH值的增大有助于N2O还原酶活性的提高,促进反硝化作用的完全反应(转化为N2)[90,99]。PEREIRA等[52]也认为,生物炭的添加显著增加了土壤pH值,有利于N2O还原微生物的生长。添加生物炭将显著提高土壤pH值,改善土壤酸环境和相关的反硝化功能基因,从而减弱土壤N2O的排放,土壤pH值和N2O排放量呈显著负相关。
4.3.3氮和碳底物的可用性
有效态氮尤其是硝态氮,是反硝化过程进行的基本底物。CASE等[100]研究表明,生物炭的施用降施用低了沙壤土中N2O的排放量,其主要原因是固氮量(NH4+、NO3-等)的增加而不是土壤pH值的升高。SONG等[77]也报道了相似的研究结果,施用生物炭降低了土壤反硝化速率,减少了N2O的排放,且N2O的排放与土壤含水量无显著相关性,与土壤铵态氮、硝态氮、可溶性有机氮含量呈显著正相关。生物炭的吸附作用可增强土壤固氮作用,降低反硝化作用底物的可利用性,从而抑制反硝化作用的进行。CHEN等[86]研究也表明,碳和氮的可利用性对土壤反硝化过程具有重要作用。反硝化是一个电子消耗和异养过程,土壤有机物为硝态氮的还原提供电子,为反硝化菌的生长和活性提供有机底物。生物炭施用后,土壤DOC含量和电导率等显著提高,可为微生物提供足够的有机碳源和营养物质,增强反硝化菌的活性[61]。
5 展望
施用生物炭对改善土壤氮循环具有重要作用。生物炭的添加有利于土壤pH值的升高,较适用于酸性土壤pH值的调节。同时,生物炭通常具有较高的比表面积和孔隙度,使其能有效地吸附和保留养分、水分等,为微生物的生长提供较好的环境条件,有利于提高土壤微生物活性。大量研究结果表明,施用生物炭有利于改善土壤理化性质,增强固氮菌、硝化菌和反硝化菌的活性,提高nifH、amoA、nirK、nirS、nosZ等基因的丰度,这对促进土壤固氮、氮矿化、减缓NH3和N2O排放发挥了重要作用。近10 a来,有关生物炭对土壤氮循环的作用过程及机理研究取得了较大进展,尤其在阐明微生物功能基因的影响机理方面有所突破,但在许多领域仍有待进一步研究。
(1)由于生物炭在土壤中的存在时间长,因此它对土壤氮循环的作用过程是一个长期过程。目前许多研究的试验周期较短,且大多为盆栽试验,与田间原位试验的土壤环境存在较大差异,可能造成对生物炭影响土壤氮循环的评估出现偏差。因此,应开展长期的定位监测和研究,以准确评估施用生物炭对土壤氮循环的长期作用过程。
(2)目前,施用生物炭对氮循环功能微生物的影响研究较为有限,且多数研究关注施用生物炭对微生物群落丰度的影响,缺乏其对微生物群落组成、活性和关键种的影响等方面的研究。未来应加强相关研究,以综合分析功能微生物对施用生物炭的响应。
(3)目前,虽然有关生物炭影响氮循环功能基因的机理研究已取得一定进展,但有关不同基因对土壤氮循环主要生态过程的贡献大小还存在不确定性,如AOA和AOB对硝化作用的贡献,nirK、nirS、nosZ等基因对反硝化作用的贡献,都有待深入研究。采用稳定同位素技术等手段可以更为精确地识别生物炭施用对土壤氮循环功能微生物变化的作用,有待未来开展进一步研究。

