新型酞菁类光敏剂的合成及其在光动力学抗菌化学疗法中的应用
刘晓龙,赵 鑫
(1. 延安大学医学院,陕西 延安 716000;2. 锦州医科大学医疗学院,辽宁 锦州 121000)
自1942年青霉素投入使用以来,人类就进入了抗生素治疗细菌感染的时代[1]。然而抗生素的滥用导致耐药细菌广泛流行,特别是临床常见的革兰氏阳性耐药菌,如肺炎克雷伯菌(Klebsiella pneumoniae)、耐甲氧西林金黄色葡萄球菌(methicillin-resistant staphylococcus aureus,MRSA)[2-3]、耐万古霉素肠球菌(vancomycin-resistant enterococcus,VRE)[4]和 耐 青 霉素肺炎链球菌(penicillin-resistant streptococcus pneumoniae,PRSP)[5-7]等。
光动力学疗法(photodynamic therapy,PDT)是光敏剂(photosensitizers,PS)在适当波长的光照下,产生对靶细胞有毒的单线态氧(1O2)(图1),杀死靶细胞的一种治疗方法。光动力学抗菌化学疗法(photodynamic antimicrobial chemotherapy,PACT)是PDT 的衍生疗法,其对敏感细菌和耐药细菌的灭活显示出极大潜力[8-10]。迄今为止,PACT 已被证明对多种革兰氏阳性和革兰氏阴性细菌均有灭活效果[11-14],且细菌很难对活性氧或自由基产生耐药[15-16]。光敏剂作为PDT/PACT 中的关键材料,要求其具有独特的结构。近年来,已有以四吡咯为核心的卟啉、卟吩、酞菁等化合物作为PS的研究[17-19]。特别是酞菁(phthalocyanine,PC)化合物,由于其独特的芳香结构使其在经600~800 nm[20-21]波长的光照后能高效率地产生1O2,被认为是一种优良的光敏剂。然而PCs在大多数溶剂中的低溶解性和易发生聚合等缺点,严重地影响菌体内单线态氧的产生效率和利用率,最终使其在PACT 中的使用受到限制。因此,本文通过增加水溶性取代基合成了4 个酞菁化合物,并针对Klebsiella pneumoniae、VRE 和MRSA 3种耐药菌进行PACT和最小抑菌浓度(minimum inhibitory concentration,MIC)实验。
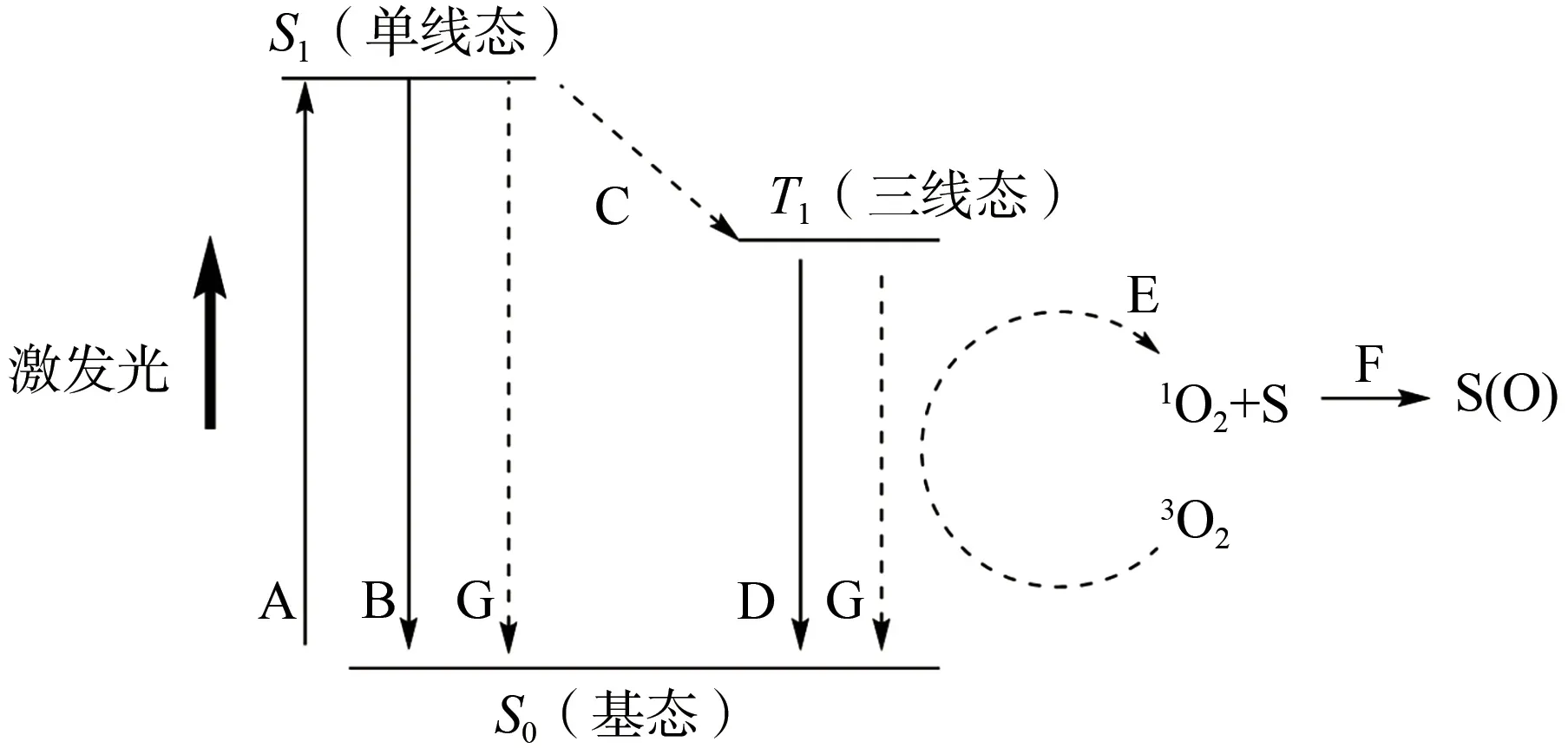
图1 PACT过程中的能量转移示意图
1 材料与方法
1.1 试剂与仪器
所有化学试剂购自西格玛-奥德里奇公司,且无需进一步纯化。肺炎克雷伯菌、耐甲氧西林金黄色葡萄球菌和耐万古霉素肠球菌3 种耐药菌均来自于西京医院。细菌菌株的培养采用从OXOID Luria-Bertani(LB)培养基和Mueller-Hinton(MH)肉汤。四甲基硅烷(Tetramethyl silane,TMS)作为内标,并在INOVA400 液体超导核磁共振谱仪(瓦里安,美国)上以400 MHz 记录1H NMR 光谱。在UV8453 光谱仪(安捷伦,美国)上记录UV-可见吸收光谱。使用Vario ELⅢ元素分析仪进行元素分析。在微型TOF-Q(布鲁克)质谱仪上获得高分辨质谱(High Resolution Mass Spectrometry,HRMS)结果。
1.2 有机合成
酞菁化合物6-9的合成按图2所示路线进行。
1.2.1 中间体合成过程
1.2.1.1 邻苯二甲酰亚胺(1)的合成 邻苯二甲酸酐(5 g,33.7 mmol)、尿素(2.45 g,40.8 mmol)于研钵中,混合研细后加入到提前预热好的100 mL三颈瓶中,搅拌下缓慢加热到140℃,混合物逐渐变成熔融态,并有大量气体放出,且瓶颈上有白色针状晶体析出,随后反应体系体积突然增加到原来体积的3 倍,立即给烧瓶中加入40 g 水,冷却后抽滤,水重结晶,抽滤,干燥。
1.2.1.2 4-硝基邻苯二甲酰亚胺(2)的合成 10 mL浓硫酸于50 mL 双颈瓶中,搅拌下加入3.6 mL 浓硝酸,冰浴条件。待体系温度低于12℃后,并保持温度在12~15℃,缓慢加入1(2 g,13.6 mmol),加完后撤去冰浴,室温反应,反应液逐渐由无色变为黄色浑浊液。3 h后升温至55℃,反应0.5 h,溶液由浑浊变澄清。将上述溶液冷却到40℃以下后缓慢倒入45 g冰中,立即有大量黄色固体析出,冷却,抽滤,收集滤液,干燥,乙醇重结晶,滤去不溶物,冷却,抽滤。
1.2.1.3 4-硝基邻苯二甲酰胺(3)的合成 称取2.4 g(12.5 mmol)4-硝基邻苯二甲酰亚胺于50 mL圆底烧瓶中,加入12 mL 浓氨水,室温反应3 h。待反应结束后,抽滤,5%氨水洗涤,干燥。
1.2.1.4 4-硝基邻苯二甲腈(4)的合成 量取10 mL干燥的N,N-二甲基甲酰胺(N,N-Dimethylformamide,DMF)于50 mL 双颈瓶中,冰盐浴条件下用恒压漏斗滴加370 μL 氯化亚砜,滴加完毕后,继续搅拌10 min后,分次加入对硝基邻苯二甲酰胺0.5 g(2.4 mmol),以上步骤保证温度在5℃以下,继续搅拌45 min 后升至室温继续反应2 h 得浅黄色透明溶液。将上述溶液倒入6 g 冰中立即有米黄色固体析出,冷却,抽滤,5%的碳酸钠溶液洗涤,干燥。

图2 酞菁化合物的合成路线
1.2.1.5 中间体5的合成 称取1.18 g(8.55 mmol)4-硝基邻苯二甲腈,于50 mL 双颈瓶中,加入15 mL干燥的二甲基亚砜(Dimethyl sulfoxide,DMSO),完全溶解得到粉红色溶液,搅拌下将1.18 g(8.6 mmol)对羟基苯甲酸和1.75 g(12.5 mmol)碳酸钾倒入烧瓶中,氮气保护下反应,4 h 和24 h 后分别再次加入1.75 g(12.5 mmol)碳酸钾。随反应的进行体系颜色逐渐变为棕红色,橘黄色,反应两天后,薄层色谱法监测并与两种原料对比发现有新物质产生,继续反应1 d。待反应停止后将溶液加入300 mL 水中,有米黄色黏稠状固体析出,浓盐酸调pH 值到1,冷却,抽滤,少量水洗涤,干燥。
1.2.2 酞菁化合物6-9的合成过程
1.2.2.1 对羟基苯甲酸取代酞菁(6)的合成 称取480 mg(1.81 mmol)化合物5,35 mL 干燥的正戊醇,1 mL 1,8-二偶氮杂双螺环[5.4.0]十一-7-烯于100 mL 双颈瓶中,160℃回流,氮气保护。10 h后停止反应,将溶液倒入90 mL 甲醇∶水=1∶3 的溶液中,有黑色固体絮状物析出,静置,抽滤,乙醇、甲醇、丙酮、水分别洗涤两次直到滤液为无色且pH 为中性,干燥。
1.2.2.2 四硝基取代镍酞菁(7)的合成 取200 mg(1.16 mmol)化合物4 和74.2 mg(0.34 mmol)三氯化镍,20 mL 无水乙醇于50 mL 烧瓶,升温至160℃回流3 h,停止反应,冷却至室温,抽滤,乙醇、甲醇、丙酮、水分别洗涤两次直到滤液为无色且pH 为中性干燥,得蓝绿色固体115.9 mg。将所得产物用N,N-二甲基甲酰胺和无水乙醚两种溶重结晶,抽滤。
1.2.2.3 四硝基取代酞菁(8)的合成 称取173.13 mg(1 mmol)化合物4于100 mL双颈瓶中,加入30 mL 干燥的正戊醇,搅拌下加入1 mL 的1,8-二偶氮杂双螺环[5.4.0]十一-7-烯,氮气保护,160℃回流10 h。反应体系逐渐由无色溶液变为棕绿色直到黑色溶液。反应停止,冷却至室温后将反应液倒入5 mL 甲醇∶水=1∶3 的溶液中搅拌后有黑色固体析出,静置,溶液分层,上层是黑色,下层为棕黄色,抽滤得黑色固体,用乙醇、甲醇、丙酮、水分别洗涤直到滤液为中性。
1.2.2.4 四氨基取代酞菁(9)的合成 称取250 mg(0.33 mmol)化合物8,1.25 g 硫化钠于50 mL 烧瓶中,加入20 mL H2O,50℃下回流5 h。反应停止后,过滤,用盐酸(0.5 mmol/L),氢氧化钠(1.0 mmol/L)溶液反复洗涤3次,再用水洗至中性,70℃烘干。
1.3 抗菌活性评价
1.3.1 MIC 的测定 MIC 的测定选用常量肉汤稀释法,参照美国临床实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)的具体操作方法[22]。以化合物6-9 作为抑菌药物,对肺炎克雷伯菌、耐甲氧西林金黄色葡萄球菌和耐万古霉素肠球菌三种细菌进行MIC 评价。将固体Luriae-Bertani(LB)平板上的上述细菌单菌落转移到10 mL Muellere-Hinton(MH)培养基中,在35℃下培养2~6 h,获得108CFU/mL 菌液。准备750 μg/mL 的化合物6-9的二甲基亚砜溶液,将制备的6-9溶液用MH培养基稀释至1 mL,使每管中化合物6-9 的浓度分别 为375 μg/mL、187 μg/mL、93 μg/mL、46 μg/mL、23 μg/mL、12 μg/mL、6 μg/mL、3 μg/mL、2 μg/mL、1 μg/mL和0.5 μg/mL。1 mL细菌培养物依次添加到制备的溶液中,然后将混合物在37℃下孵育24 h,观察化合物的灭菌效果。
1.3.2 化合物6-9 的PACT 实验 PACT 实验根据文献所述方法进行[23]。37℃下挑取肺炎克雷伯菌,耐甲氧西林金黄色葡萄球菌和耐万古霉素肠球菌的单克隆体在20 mL 液体LB 培养基中过夜培养。4°C 下离心(4000 rpm,10 min)收集菌斑,用0.01 M的PBS 清洗3~6 次,稀释至O.D.600=0.5。准备浓度分别为4 μM,8 μM,12 μM,16 μM,20 μM 的化合物6-9 溶液。取0.5 mL 不同浓度的样品与0.5 mL的菌液混合在37℃的条件下孵育30 min,用400-800 nm的氙灯光源(350 mW)照射3 min,总光剂量为35 J/cm2。光源照射后的样品再离心(4°C,4 000 rpm,10 min),弃去上清液,用0.01 M 的磷酸缓冲盐溶液(phosphate buffer saline,PBS)重悬两次后,用0.01 M的PBS 稀释2.5×103倍,取15 μL 均匀涂布在LB 固体培养基上,37℃下在恒温培养箱中过夜培养,计算生长出的单克隆体的个数,以未光照的样品为空白,计算样品对这3种菌的光动力学灭活率,为了便于误差分析,每个实验重复3遍。
2 结果
2.1 化合物4-9的表征结果
化合物4(产率:55.4%)。1H NMR(400 MHz,DMSO-d6)δ 8.56-8.58(d,1H),8.28(s,1H),8.19-8.22(d,1H)。
化合物5(产率:43.4%,米黄色固体)。1H NMR(400 MHz,CDCl3)δ 8.15-8.17(d,2H),7.77-7.79(d,1H),7.36(s,1H),7.29-7.31(d,1H),7.13-7.15(d,2H)。
化合物6(产率:47%,蓝黑色固体)。元素分析:C32H22N12▪8.2H2O,理论值:碳(C),54.43%;氢(H),3.12%;氮(N),23.82%。实际值:碳(C),54.35%;氢(H),3.12%;氮(N),23.73%。UV-vis(DMF,λmax,nm):606,637,663,666,699。HRMS(ESI)理论值:C60H33N18O12[M-H]-1057.2220,实际值:1057.1988。
化合物7(产率:49%,墨绿色固体)。元素分析:C32H22N12Ni▪6.2H2O,理论值:碳,62.20%;氢,4.00%;氮,11.05%。实际值:碳,60.15%;氢,3.82%;氮,11.13%。UV-vis(DMF,λmax,nm):636,671。 HRMS(ESI)理 论 值C32H13N12O8Ni[M+H]+708.1134,实际值:708.1202。
化合物8(产率:36.74%,黑色固体)。元素分析:C32H14N12O8▪5.6H2O,理论值:碳(C),56.48%;氢(H),3.15%;氮(N),21.18%。实际值:碳(C),56.35%;氢(H),3.22%;氮(N),21.35%。UV-vis(DMF,λmax,nm):661,728。HRMS(ESI)理论值:C32H14N12O8[M+H]+695.1134,实际值:695.1189。
化合物9(产率:60%,黑色固体)。元素分析:C32H22N12▪8.2H2O,理论值:碳(C),氢(H)3.12%;氮(N)%。实际值:碳(C),54.35%;氢(H),3.12%;氮(N),23.73%。UV-vis(DMF,λmax,nm):661,732。HRMS(ESI)理论值:C60H33N18O12[M+H]+575.2166,实际值:575.2102。
元素分析结果、紫外数据及高分辨质谱可得化合物4-9的结构为图2中的目标结构。
2.2 MIC结果
化合物6-9 对肺炎克雷伯菌、耐甲氧西林金黄色葡萄球菌和耐万古霉素肠球菌的MIC 结果如表1所示。从表中结果可以看出,化合物6-9 对所有的测试菌的MIC 值均大于128 μg/mL,表明化合物6-9本身不能灭活3种测试菌。

表1 化合物6-9的MIC值(μg/mL)
2.3 光动力学灭菌结果
从化合物6-9 的MIC 结果可以看出所有化合物对三种耐药细菌均无灭活作用。在进一步的PACT 实验中我们依然选用肺炎克雷伯菌、耐甲氧西林金黄色葡萄球菌和耐万古霉素肠球菌这3 种耐药菌作为待测菌株。针对不同浓度化合物6-9的光动力灭菌效果见图3。图3 中的结果显示随着化合物6-9 浓度的增加,这4 种化合物对3 种耐药细菌的光灭活作用均增强,表明化合物6-9 的光灭活作用均呈剂量依赖性。特别是化合物6,当其浓度为4 μmol/L 时,对3 种耐药菌的灭活率约80%,当浓度为6 μmol/L 时对三种耐药细菌的灭活率均超过90%(图3A);对硝基取代的镍酞菁7 而言,其浓度为10 μmol/L 时对Klebsiella pneumoniae 和VRE的灭活率约50%,而对MRSA 的灭活率仅为20%(图3B);化合物8 虽然对3 种耐药菌都有一定的灭活效果,但对3 种菌的光灭活作用均很弱(10 μmol/L 时的灭菌率低于40%,图3C);氨基取代的酞菁化合物9 显示出与化合物7 相似的光灭活效果,其在10 μmol/L 下 对MRSA 的 灭 活 率 超 过40%,而 对VRE 和MRSA 两种耐药菌的灭活率不到40%(图3D)。
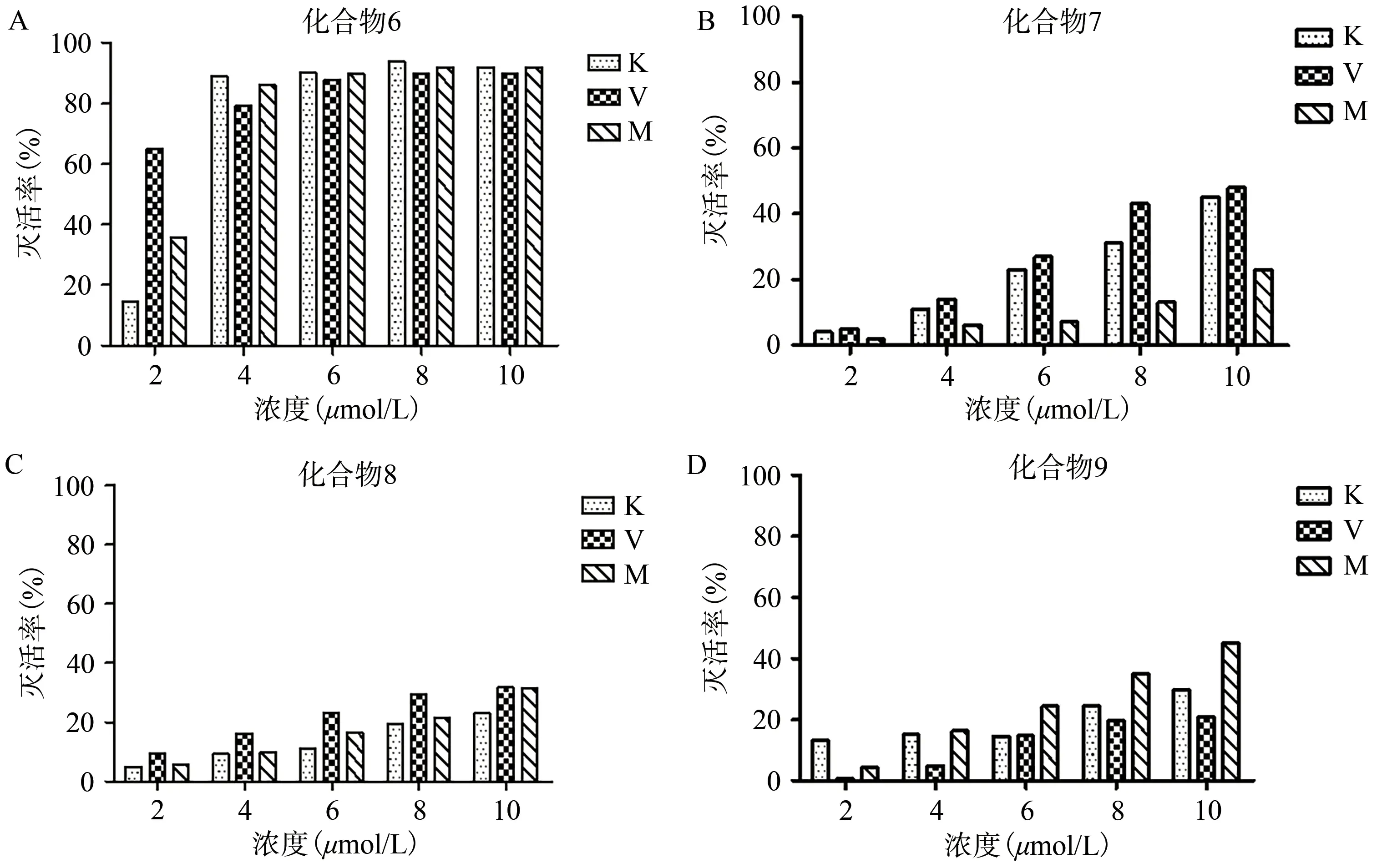
图3 化合物6-9的光动力学灭菌结果
3 讨论
PACT 作为一种能有效灭活耐药细菌的方法,其光敏剂的选择意义重大。本研究中通过有机合成的方法合成了4 种酞菁类化合物(6-9),并将这4种酞菁化合物作为光敏剂测试了其对肺炎克雷伯菌、耐甲氧西林金黄色葡萄球菌和耐万古霉素肠球菌这3种耐药细菌的MIC值和光动力灭菌效果。实验结果表明化合物6-9 对3 种耐药菌的MIC 值均>128 μg/mL,表明化合物本身对3 种细菌均无灭活作用;PACT 实验结果表明,化合物6-9 分别对3 种耐药菌有一定程度的灭活作用,特别是苯甲酸取代的化合物6,随其浓度的升高,光动力灭菌效果增强,当其浓度为6 μmol/L 时对3 种耐药细菌的灭活率均超过90%,显示出优秀的光动力灭菌效果。上述结果表明,酞菁化合物是一类优秀的光敏剂,且通过增加酞菁化合物的溶解度可有效提高其光动力灭菌效果。

