奥曲肽联合奥美拉唑治疗肝炎后肝硬化合并上消化道出血的效果
谭明 贺栋梁(通信作者)
421001 衡阳市中心医院消化内科,湖南衡阳
肝炎后肝硬化是指由不同病因引起的慢性、进行性与弥漫性肝病,大部分患者因肝炎初期未重视而转化为肝硬化,主要病理表现为肝细胞变性坏死、纤维组织增生及再生结节形成[1]。同时,随着肝硬化病情加重,患者普遍合并多种并发症,其中上消化道出血是其主要并发症之一。若大出血时,患者治疗、抢救不及时,可因失血过多而迅速死亡,严重危及患者生命健康安全。目前,临床对于治疗肝炎后肝硬化合并上消化道出血患者常采用的办法是止血,其中奥曲肽药理作用与生长抑素相似,可选择性作用于患者血管以降低患者门静脉压、减少血液流动量,常作为治疗肝硬化合并上消化道的止血药物[2]。但由于该药对患者胃酸抑制效果有限,当患者体内存在大量胃酸时,会加大患者再出血发生风险。而奥美拉唑是一种较强抑酸质子泵抑制剂,通过阻断患者胃壁细胞上的H+-K+-ATP 酶和抑制患者胃酸的分泌及合成,使患者胃内环境得到改善,进而加快血管内血小板聚集速度,起到有效治疗上消化道出血的目的[3]。有学者指出,将奥曲肽与奥美拉唑联用能够有效治疗肝炎后肝硬化合并上消化道患者[4]。基于此,本文将重点分析奥曲肽与奥美拉唑联合治疗肝炎后肝硬化合并上消化道出血的临床效果,报告如下。
资料与方法
选取2020年5月-2021年5月衡阳市中心医院收治的62 例肝炎后肝硬化合并上消化道出血患者为研究对象,根据患者入院编号进行分组,单数为对照组,双数为研究组。对照组31 例,男16 例,女15例;年龄32~86 岁,平均(54.39±6.31)岁;肝硬化分级A 级5 例,B 级14 例,C 级12 例;学历本科及以上10例,专科及以下21例。研究组31例,男17例,女14 例;年龄31~85 岁,平均(54.63±6.19)岁;肝硬化分级A 级4 例,B 级13 例,C 级14 例;学历本科及以上11 例,专科及以下20 例。两组患者基本资料比较,差异无统计学意义(P>0.05),具有可比性。
纳入标准:①临床诊断肝硬化合并上消化道出血患者;②患者知情并签署同意书;③患者临床资料完善。
排除标准:①病因非上消化道出血肝硬化者;②严重器质性病变患者;③合并心、脑血管疾病患者;④对奥曲肽、奥美拉唑药物过敏及易过敏体质患者。
方法:给予两组患者对症支持,在患者治疗期间严格监测患者生命体征,并给予患者静脉补充营养物质,预防患者并发症发生等。对照组在给予对症治疗的基础上进行醋酸奥曲肽注射液(生产企业:海南中和药业股份有限公司;批准文号:H20103210;规格:1 mL∶0.05 mg)治疗,初始剂量为0.3 mg,溶于50 mL 的0.9%氯化钠注射液,摇晃混匀后用微量泵以4.2 mL/h 静脉注射,患者需连续用药4~7 d。患者使用醋酸奥曲肽可能出现注射部位疼痛或针刺感,一般于15 min后可缓解。研究组采用奥曲肽联合奥美拉唑治疗,其中奥曲肽用法用量同对照组,并给予奥美拉唑(生产企业:武汉长联来福制药股份有限公司;批准文号:H20093278;规格:40 mg)治疗,取40 mg奥美拉唑溶于100 mL 的0.9%氯化钠注射液中,摇晃混匀后用微量泵以6.1 mL/h 静脉滴注,2 次/d,连续治疗5~7 d。
观察指标:①详细记录两组患者治疗期间具体止血时间、住院治疗时间。②采用全自动生化分析仪对两组患者治疗后C 反应蛋白(CRP)、降钙素原(PCT)、白介素1β(IL-1β)及白介素2(IL-2)进行检测。③详细记录两组患者治疗期间出现恶心呕吐、肠胃道痉挛、心悸及心律失常的情况。
统计学方法:采用SPSS 23.0 统计学分析系统展开数据处理;计量资料用(±s)表示,采用t检验;计数资料用[n(%)]表示,采用χ2检验;以P<0.05 为差异有统计学意义。
结 果
两组患者恢复情况比较:治疗后,研究组止血时间及住院时间短于对照组,差异均有统计学意义(P<0.05),见表1。
表1 两组患者恢复情况比较(±s)

表1 两组患者恢复情况比较(±s)
组别 n 止血时间(h) 住院时间(d)对照组 31 47.28±5.89 7.02±1.13研究组 31 34.21±5.43 5.71±0.94 t 8.16 4.46 P<0.05 <0.05
两组患者治疗前后炎症因子水平比较:治疗前,两组患者CRP、PCT、IL-1β 及IL-2 比较,差异无统计学意义(P>0.05);治疗后,研究组CRP、PCT、IL-1β及IL-2均低于对照组,差异有统计学意义(P<0.05),见表2。
表2 两组患者治疗前后炎症因子水平比较(±s)
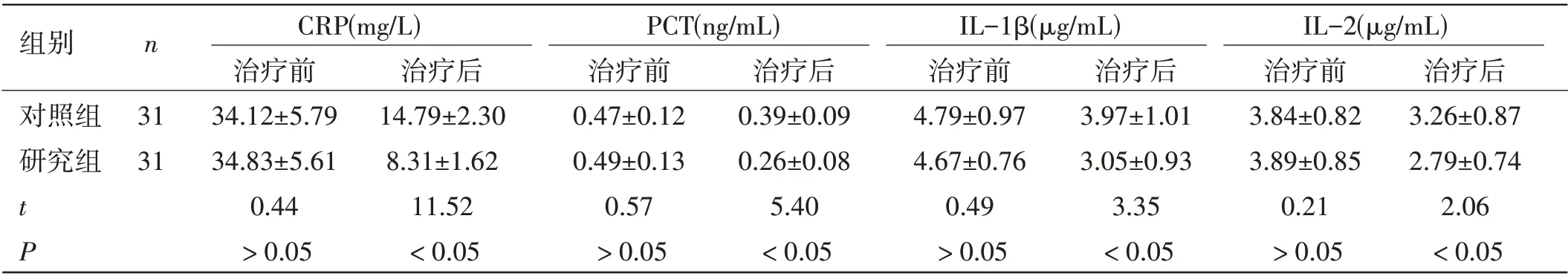
表2 两组患者治疗前后炎症因子水平比较(±s)
组别 n CRP(mg/L) PCT(ng/mL) IL-1β(μg/mL) IL-2(μg/mL)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 31 34.12±5.79 14.79±2.30 0.47±0.12 0.39±0.09 4.79±0.97 3.97±1.01 3.84±0.82 3.26±0.87研究组 31 34.83±5.61 8.31±1.62 0.49±0.13 0.26±0.08 4.67±0.76 3.05±0.93 3.89±0.85 2.79±0.74 t 0.44 11.52 0.57 5.40 0.49 3.35 0.21 2.06 P>0.05 <0.05 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05
两组患者治疗期间不良反应发生情况比较:治疗期间两组患者出现恶心呕吐及心律失常情况比较,差异无统计学意义(P>0.05);研究组出现肠胃道痉挛、心悸情况少于对照组,差异有统计学意义(P<0.05),见表3。

表3 两组患者治疗期间不良反应发生情况比较[n(%)]
讨 论
目前,肝硬化患者疾病控制的关键是早发现、早治疗,若肝硬化患者在早期未及时取得治疗,便可发展成为肝癌、自发性腹膜炎等疾病,或出现合并上消化道出血等并发症[5]。因而治疗肝硬化合并上消化道出血患者止血是主要措施,通过降低患者门静脉压力及侧支循环系统压力,可缓解患者病情。有关资料显示,与传统临床采用的三腔二囊管压迫或采用垂体后叶素止血措施相比,奥曲肽与奥美拉唑联合使用能够及时止血并减少患者胃酸分泌与合成,对于治疗肝硬化合并上消化道出血具有十分积极的作用[6]。
在本次研究中,研究组止血、住院时间短于对照组,表明应用奥曲肽与奥美拉唑联合治疗肝炎后肝硬化合并上消化道出血患者,可缩短患者止血、住院时间,提升治疗效率,减少患者再出血等情况发生。主要原因为奥曲肽药理作用与生长素相似,具有半衰期长、能抑制扩血管多肽等特点,因而可减少血液流动量。人工合成的奥曲肽相对于天然抑制素的稳定性更佳,酶活性更强,受破坏概率更低。同时,奥美拉唑对患者体内的腺嘌呤核苷三磷酸酶活性有抑制作用,通过降低胃蛋白酶活性,可抑制患者胃酸分泌与合成,进而促进血小板凝聚。
在患者上消化道出血的同时,体内的CRP 等炎症因子水平会因受到刺激而提升,因而可通过测定患者血清中的炎症因子水平,来观测患者用药后身体炎性反应和应激程度。在本次研究中,治疗后研究组CRP、PCT、IL-1β及IL-2均低于对照组,提示对肝硬化合并上消化道患者应用奥曲肽与奥美拉唑联合治疗,可有效缓解患者体内的炎性水平。主要原因为对肝硬化合并上消化道出血患者使用奥曲肽,可有效加快血管收缩,进而促使收缩炎症因子反应状态得到改善。同时,使用奥美拉唑可有效对患者体内胃蛋白进行分级并抑制大量胃酸分泌,起到很好保护胃黏膜的作用。
在对奥曲肽及奥美拉唑两种药物的有效性与安全性分析中,两者联用能够及时为患者上消化道止血,抑制患者胃酸分泌、合成,对于提高临床治疗效率具有十分重要的意义。同时奥曲肽及奥美拉唑两种药物的药物安全性较好,患者药物反应在可耐受范围内。在本次研究中,研究组出现肠胃道痉挛、心悸少于对照组,表明奥曲肽及奥美拉唑两种药物联用安全性较高,患者药物反应在可耐受范围内。原因为奥曲肽、奥美拉唑联合治疗肝硬化合并上消化道出血患者可发挥药物协同作用,在快速止血的同时减少胃酸分泌与合成,进而修复患者胃内黏膜组织,减少患者不良反应发生,故药物安全性较高。
综上所述,应用奥曲肽与奥美拉唑联合治疗肝硬化合并上消化道出血患者,可有效缩短患者止血时间及住院时间,减少患者再出血率,提升临床治疗效果,且患者药物反应在可耐受范围内,安全性较高,值得临床上推广应用。

