生物炭对土壤中三氯生植物有效性和微生物群落结构的影响
王宇菲,罗力,陈卫锋,魏然,c*,倪进治,c
(福建师范大学 a.地理研究所,b.福建省植物生理生态重点实验室,c.地理科学学院,福州 350007)
0 引言
三氯生(Triclosan, TCS)作为一种广谱抗菌剂,自20世纪90年代被大量应用到药品和个人护理品中后,已在越来越多的环境介质中被检出。TCS通过生活污水进入污水处理厂,一些常规的污水处理工艺并不能将其完全去除,残留的TCS会在污泥中累积形成潜在的污染源[1]。由于TCS水溶性低(logKow=4.76),稳定性强,在环境中持久存在,并能随环境介质迁移和积累[2]。污水排放和污泥施用会导致TCS进入土壤,进而随食物链危害人体健康[3]。TCS具有潜在的致癌风险,进入动物和人体后,可能会导致神经系统的结构或功能性损伤[4]。有研究表明,孕妇长期暴露于TCS的环境中可能会导致男婴出生后一系列行为表达问题,使其患多动症及躯体化障碍等疾病的概率升高[5]。因此,TCS在土壤中残留和生物有效性已成为目前研究的热点问题。
生物炭是生物质高温热解下形成的一种材料,其有机碳含量高,孔隙结构丰富,比表面积大,对有机污染物的吸附能力很强,有机污染物能够稳定在生物炭表面及其孔隙结构中,因此生物炭常被用作土壤环境中有机污染物的吸附剂[6]。生物炭具有降低土壤中污染物生物积累和毒性的潜力,污染物被生物炭吸附和锁定后,土壤孔隙水中污染物含量减少,植物根系对污染物的可接近性也会下降[7-8]。生物炭还可以提高土壤的阳离子交换量,它富含矿质营养元素,如N、P、K、Ca、Mg和S等[9],能够促进作物生长,提高农作物产量。另外,生物炭含有的大量可降解有机质也能够为土壤微生物提供生长所需的底物,提高微生物活性,改变土壤微生物群落结构,微生物对污染物的降解能力也会增强[10]。
萝卜作为日常食用的根茎类蔬菜,对土壤中污染物在食物链中传递暴露的风险性更强[11]。为了探究生物炭的添加对土壤中TCS植物有效性以及土壤微生物生态的影响,本研究利用盆栽实验,向污泥施用的土壤中分别添加两种不同温度下制备的互花米草生物炭,通过分析盆栽植物萝卜的生物量和TCS含量以及土壤微生物群落结构的变化,为生物炭的农业利用及其阻控土壤中污染物的迁移转化提供科学依据。
1 材料与方法
1.1 材料
供试土壤采自福州闽侯大学城某水稻田,采样深度为表面耕层0~20 cm。土样采回后,除去石子和动植物残体,风干后过2 mm筛。土壤pH值用哈希pH计(配PHC301玻璃复合电极)测定,水土比为2.5∶1(v∶w),测得pH值为7.42。土壤有机碳和氮采用元素分析仪(Elementar Vario Max CN Germany)测定,含量分别为7.48和1.12 g·kg-1。土壤粒径分布采用马尔文激光粒度仪2000型进行测定,按照美国土壤质地分类制,土壤质地名称为壤土。实验所用污泥采自福州市祥坂污水处理厂沉淀池中,新鲜样品运回后于-20℃冰箱冷冻保存。取出部分污泥样品冷冻干燥,除去杂质后研磨过60目筛,储存于干燥器中备用,测得污泥(干重)中TCS含量为5.87 mg·kg-1。
实验选用互花米草作为供试生物炭原料。将互花米草置于管式炉(江苏前锦炉业设备有限公司, O-KTF1200),持续通入高纯氮气,恒温热解2 h,制备温度为300℃和600℃。两种温度下制备的生物炭分别用BC300和BC600表示。将生物炭研磨后过60目筛,密封存储于棕色瓶中备用。称取一定量的生物炭于石英舟中,在马弗炉中750℃下灼烧6 h,测得灰分重量。利用元素分析仪测定生物炭中C、H、N元素的百分含量,由生物炭总量减去C、H、N元素和灰分的含量后即得到O元素含量。生物炭的比表面积(BET-N2)用NOVA-2000E表面分析仪进行测定。生物炭pH的测定方法为,称取0.5 g生物炭加入50 mL超纯水,充分摇匀后静置过滤,测定溶液的pH值。生物炭的基本性质见表1。

表1 供试生物炭基本性质Table 1 Properties of the tested biochars
盆栽植物为中蔬红樱桃萝卜(RaphanussativusL.var.radculuspers,又名四季萝卜),种子购于北京金土地农业技术研究所。
1.2 盆栽实验
向一定量土壤中分别添加0%、1%、2%和5%的BC300或BC600生物炭,使其总重量均为450 g,再加入50 g污泥(干重),全部混合均匀后装入陶瓷花盆,调节土壤含水量为田间含水量的60%,置于温室平衡稳定2周。提前将萝卜种子撒在去离子水浸润的滤纸上催芽,待种子发芽后移栽。播种深度2~3 cm,每盆8株,盆栽时间为90 d,设置种植和未种植萝卜2种处理,每种处理3个重复。期间用去离子水补充水分。90 d后收获萝卜植株,将每一植株分为茎叶和根系两部分,清洗干净后放入冷冻干燥机。将冻干的植物样品称重后粉碎,过60目筛用于TCS的检测。将土壤样品分成两部分,一部分冷冻干燥后过60目筛,用于TCS的检测,另一部分新鲜土样过2 mm筛,-80℃保存用于PLFAs测定。
1.3 土壤与植物中TCS的提取与定量
利用超声方法对土壤与植物中TCS进行提取,提取剂为丙酮,提取物的净化采用C18净化柱,洗脱溶剂为乙腈,详见姚思睿等[12]的研究。TCS的测定参照罗力等[13]的方法,即采用超高效液相色谱系统(Waters ACQUITY UPLCTM)配紫外检测器,外标法定量。色谱柱为Waters ACQUITY UPLCTM BEH C18柱(50 mm×2.1 mm,1.7 μm),流动相为乙腈和超纯水,比例为各50%,流速0.3 mL·min-1;检测波长280 nm,柱温40℃,进样量3.0 μL。采用向土壤中添加TCS标准品计算回收率的方法来保证TCS提取和测定过程中的质量保证和控制。当土壤中TCS的添加量为0.1、1.0和10 mg·kg-1时,回收率分别为108.8%±2.6%、101.5%±1.3% 和94.9%±2.5%。
1.4 土壤微生物磷脂脂肪酸分析
称取8.0 g相当于干土重的鲜土,依次添加磷酸缓冲液、三氯甲烷和甲醇提取,并用硅胶柱净化分离土壤中的磷脂脂肪酸,再加入甲醇与甲苯混合液(1∶1,v/v)和0.2 mol·L-1氢氧化钾溶液进行皂化和甲基化形成脂肪酸甲酯。利用气相色谱仪(Agilent 6890 N)并结合MIDI微生物识别系统(MIDI Inc., Newark, DE)对微生物群落的脂肪酸进行鉴定,土壤微生物磷脂脂肪酸(PLFAs)的提取与测定具体方法详见杨美玉等[14]的方法。
2 结果与讨论
2.1 生物炭对萝卜生物量及其TCS含量的影响
植物根系对土壤中的TCS具有一定的富集能力,未添加生物炭的对照处理,萝卜根系中TCS的平均含量为660 μg·kg-1,但添加生物炭处理下,萝卜根系中都未检出TCS(表2),说明生物炭能够有效抑制萝卜吸收土壤中的TCS。可能是生物炭添加后,吸附了土壤中游离的TCS,降低了土壤孔隙水中TCS的浓度以及TCS在土壤中的迁移,使得植物无法吸收富集土壤中的TCS[8]。此外,未添加生物炭处理的萝卜茎叶中也未检出TCS,说明TCS很难从根系向茎叶转移,这可能与TCS水溶性相对较低有关。
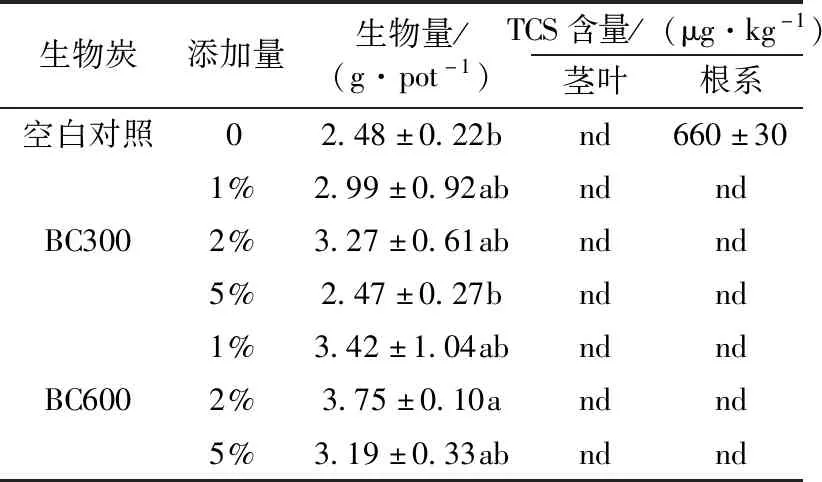
表2 不同处理下萝卜生物量及其体内TCS含量Table 2 Biomass and TCS contents of radish under different treatments
2.2 生物炭对土壤中TCS可提取量的影响
由图1可知,盆栽前以及盆栽90天后未种植和种植萝卜的土壤中TCS可提量都随着生物炭添加量的增加而下降,说明生物炭的添加可以明显降低土壤中TCS的可提取量。与盆栽前相比,未种植萝卜的对照中,只有添加1%BC300和2%BC600处理的土壤中TCS可提取量有显著降低(P<0.05),其他处理的土壤中TCS可提取量都无显著性变化;而种植萝卜后,除了添加2%BC300和5%BC300的处理外,其他处理的土壤中TCS可提取量均有显著降低(P<0.05),说明了种植萝卜会促进土壤中TCS的消解。生物炭的热解温度及其添加量对土壤中TCS可提取量都有一定的影响。在同种生物炭的不同处理下,生物炭的添加量越多,土壤中TCS可提取量减少的幅度越大。在盆栽前和未种植萝卜的土壤中,添加相同比例BC600的土壤中TCS可提取量均明显高于添加BC300;而在种植萝卜的土壤中,添加相同比例BC600的土壤中TCS可提取量均显著低于添加BC300(P<0.05),说明了高温制备的生物炭BC600具有较大的比表面积(表1),对TCS吸附能力要强于低温制备的生物炭BC300,使土壤中的TCS消解量减少;而种植萝卜后,植物根系分泌物中的有机酸可能会促进生物炭中养分的 释放[15]。由于BC600的灰分含量高于BC300(表1),受根系分泌物的影响,其释放的养分可能也会多于BC300,激发了土壤中能降解TCS的微生物活性,进而促进TCS的降解[16]。
生物炭对土壤中有机污染物环境行为的影响是多方面的。生物炭的比表面积越大,孔隙度越丰富,对有机污染物的吸附能力越强,添加到土壤中后会影响有机污染物的生物和化学降解[17]。生物炭也能通过改变土壤pH和释放养分等途径来影响土壤微生物对有机物污染物的降解[18]。此外,生物炭中含有的持久性自由基也会促进土壤中有机污染物的化学降解[19]。
2.3 生物炭对土壤中微生物群落结构的影响
土壤中TCS的降解与土壤微生物之间的关系密不可分,为了进一步探究不同生物炭处理下土壤中TCS含量的减少与土壤微生物群落结构之间的关系,对盆栽90 d后土壤中微生物PLFAs进行了提取分析。由图2可知,土壤微生物群落以细菌(包括革兰氏阳性菌和革兰氏阴性菌)为主,细菌PLFAs占微生物PLFAs总量的72.34%~78.43%,其次为真菌(9.50%~13.93%),最后是放线菌(5.15%~9.30%)和丛枝菌根真菌(4.09%~5.62%)。
与未添加生物炭的对照相比,添加生物炭明显增加了土壤中微生物PLFAs总量[20],增加率范围为6.85%~224.87%(图2)。热解温度不同的生物炭对土壤微生物PLFAs含量影响很大,在未种植萝卜的处理中,添加BC300较未添加生物炭的土壤PLFAs总量增加了6.85%~13.62%,而添加BC600较未添加生物炭的土壤PLFAs总量增加了180.72%~224.87%(图2a)。这可能是由于生物炭加入土壤中,未破坏土壤的酸碱平衡,同时提高了土壤碳氮比,土壤中硝化作用增强[21],更有利于微生物生存利用,因此提高微生物活性,使微生物量增多[22]。种植萝卜的处理中,添加BC300和BC600较未添加生物炭的土壤微生物PLFAs总量分别增大了0.24%~5.77% 和69.93%~246.31%(图2b)。整体上看,未种植萝卜的土壤中,同种生物炭的不同添加量对土壤微生物PLFAs总量影响较小;种植萝卜的土壤中,BC300的添加量对土壤微生物PLFAs总量影响甚微,而BC600的添加量越多,土壤微生物PLFAs总量越高。与未种植萝卜相比,种植萝卜对添加BC300的土壤中PLFAs总量几乎没什么影响,种植萝卜明显提高了添加5%BC600的土壤中微生物PLFAs总量,但却明显降低了添加1%BC600的土壤中微生物PLFAs总量。以上结果说明了生物炭与萝卜的共同作用能显著影响土壤中微生物的数量[23],种植萝卜对土壤中PLFAs含量的影响程度要取决于生物炭的种类以及生物炭的添加水平,也就是说生物炭是影响土壤中PLFAs含量的主要因子。
根据土壤中检测出的脂肪酸种类和数量,对土壤微生物群落结构进行了主成分分析,结果如图3所示。第一主成分对PLFAs数据变异解释的比例是85.37%,第二主成分对PLFAs数据变异解释的比例为6.82%,总共解释了微生物群落结构变化的92.19%。在PC1轴上,添加BC300和BC600的不同处理分别聚集在一起,说明生物炭种类对土壤微生物群落结构的影响较大[24]。生物炭的添加改变了土壤的通气性和持水性,使土壤微生物群落结构发生变化[25]。BC300不同处理间的离散程度明显低于BC600,且更靠近未添加生物炭的对照,说明了添加BC600及其不同添加量对土壤微生物群落结构的影响程度要明显大于BC300。在PC2轴上,添加不同比例生物炭未种植萝卜的样本间离散度较大,且BC600不同添加量之间的离散度要远大于BC300,说明生物炭添加量对土壤微生物群落结构也有一定的影响,且BC600添加量的不同对微生物群落结构的影响要大于BC300。种植萝卜的样本在PC2轴上的值都较为集中,说明种植萝卜能够在一定程度上降低生物炭添加量对土壤微生物群落结构改变的影响。
3 结论
互花米草制备的两种生物炭BC300和BC600都具有较高的灰分含量和较大的比表面积,土壤中适量添加(1%或2%)两种生物炭都可以促进萝卜的生长,并且都能够明显降低土壤中TCS的可提取量,有效抑制萝卜根系对土壤中TCS的吸收。相比较而言,BC600灰分含量更高、比表面积更大,对萝卜生长和降低土壤中TCS的生物有效性要优于BC300。此外,BC600的添加还能显著改变土壤微生物群落结构,而种植萝卜可以在一定程度上降低生物炭对土壤微生物群落结构的影响。本研究中的生物炭来源于互花米草,污染物为TCS,植物为萝卜,研究结果是否具有可推广性还不得而知,未来应开展生物炭和污染物的种类以及农作物品种等不同组合实验方面的研究,以期为生物炭应用于污染土壤的农业安全利用提供更多的数据支撑。

